DATHE, F. (2010)
Haltung und Fortpflanzung von Gelbkopfschildkröten, Indotestudo elongata (Blyth, 1824) im Tierpark Berlin.
Milu, Berlin 13 (1): 51-66.
Inhalt:
Der Artikel berichtet über die Haltungsgeschichte der Gelbkopfschildkröten im Tierpark Berlin, ihre Haltungsbedingungen, die Eiablagen seit 2006 und die Jungenaufzucht ab 2008. Es werden detaillierte biometrische Daten über das Jungtierwachstum gegeben.
dathe-biblio
SCHREINER, C. (2011)
Environmental Enrichment bei drei Menschenaffen-Arten im Zoo Krefeld - eine Untersuchung etablierter Methoden zur Tierbeschäftigung
Environmental enrichment in three great ape species at the Zoo Krefeld - a study of established methods of animal occupation
Bachelor - Thesis
96 Seiten
AG Verhaltensbiologie und Didaktik der Biologie der Ruhr-Universität Bochum (Betreuung: Prof. Dr. W.H. Kirchner) und
Zoo Krefeld (Betreuung Dr. W. Dressen)
Veröffentlicht als: Environmental Enrichment bei drei Menschenaffen-Arten im Zoo Krefeld - eine Untersuchung etablierter Methoden zur Tierbeschäftigung. Zool. Garten N.F. 81 (2012), Heft 4:161-174 Link, um Arbeit zu kaufen: http://www.sciencedirect.com/science/article/pii/S0044516912000421
Zusamenfassung:
Environmental Enrichment hat einen festen Platz in der modernen Zootierhaltung und wird von der WAZA (2005) von ihren Mitgliedern erwartet. Es gibt viele Aspekte, die den Einsatz von Environmental Enrichment rechtfertigen bzw. eindringlich fordern. Ange-fangen bei einer optimalen Haltung des einzelnen Tieres, über die positive Resonanz der Besucher bis hin zu einem erfolgreichen Management der einzelnen Arten. Die Möglichkeiten, Environmental Enrichment einzusetzen, sind vielfältig und müssen jeweils auf die Fähigkeiten der einzelnen Individuen zugeschnitten werden. Für Menschenaffen bieten sich u.a. Gegenstände an, aus welchen mit Hilfe von Werkzeug Futter entnommen werden kann. Die Auswirkungen von Environmental Enrichment auf Tiere sind bekannt, allerdings wird oftmals nicht näher beschrieben, wie aufwändig einerseits die Vorbereitung solcher Maßnahmen ist, und wie lange sich andererseits ein Tier bzw. eine Gruppe von Tieren mit den angebotenen Beschäftigungsmethoden befasst. Das Ziel dieser Studie ist es, diesen zeitlichen Kosten-Nutzen-Aspekt in Bezug auf Vorbereitungszeit der Tierpfleger und die Beschäftigungszeit der Tiere herauszustellen. Hierzu wurden erprobte Beschäfti-gungsmethoden modifiziert und bei Borneo Orang-Utan (Pongo p. pygmaeus), Schimpanse (Pan troglodytes) sowie westlichem Flachlandgorilla (Gorilla g. gorilla) im Zoo Krefeld getestet. Die Ergebnisse der Studie zeigen, dass zeitlich effiziente Tierbeschäftigung möglich ist und erlauben es den Tierpflegern, Tierbeschäftigung in den Arbeitsablauf effektiv zu integrieren. Außerdem ermöglichen die Ergebnisse den Verantwortlichen, zu entscheiden, welche Neuanschaffungen sich auf längere Zeit lohnen.
Abstract:
Environmental enrichment has a fixed place in modern animal husbandry in zoos und is expected of WAZA (2005) and its members. There are many aspects which justify or claim vividly the use of environmental enrichment: Beginning with an ideal husbandry of the individual animal, extending to the positive feedback of the visitors, up to a successful management of the species. The possibilities to use environmental enrichment are versatile and have to be adjusted to the abilities of the individuals. For great apes the use of items, from which food can be extracted with the help of tools, offers itself. The impacts of environmental enrichment on animals are known. On the other hand, the effort for the preparation of those procedures and how long the animal or a group of animals is using the offered method of environmental enrichment are not described. The aim of this study is to point out the time efficiency defined as the time needed for preparation of the keepers versus the time of occupation for the animals. Approved methods of environmental enrichment were modified and tested on Borneo orangutans (Pongo p. pygmaeus), chimpanzees (Pan troglodytes) and Western lowland gorillas (Gorilla g. gorilla) at the zoo Krefeld. The results of the study show, that time efficient environmental enrichment is possible which allows keepers to integrate environmental enrichment in their daily routine work efficiently. The results offer to decide which new acquisitions are worth to be made on a long term scale to the persons in charge.
schreiner-biblio
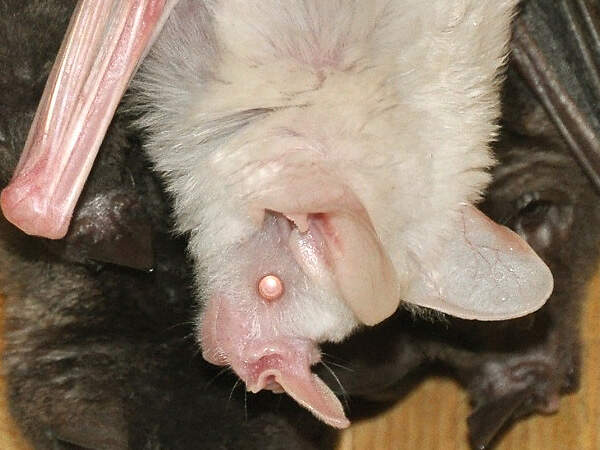
Brillenblattnase
Überordnung: LAURASIATHERIA
Ordnung: Fledertiere (CHIROPTERA)
Unterordnung: Fledermäuse (Microchiroptera)
Überfamilie: Hasenmaulartige (Noctilionoidea)
Familie: Blattnasen (Phyllostomidae)
Unterfamilie: Kurzschwanzblattnasen (Carolliinae)

Brillenblattnase
Carollia perspicillata • The Seba's Short-tailed Bat • Le fer-de-lance à lunettes
- Körperbau und Körperfunktionen
- Verbreitung
- Lebensraum und Lebensweise
- Gefährdung und Schutz
- Bedeutung für den Menschen
- Haltung
- Taxonomie und Nomenklatur
- Literatur und Internetquellen
|
Weitere Bilder auf BioLib |
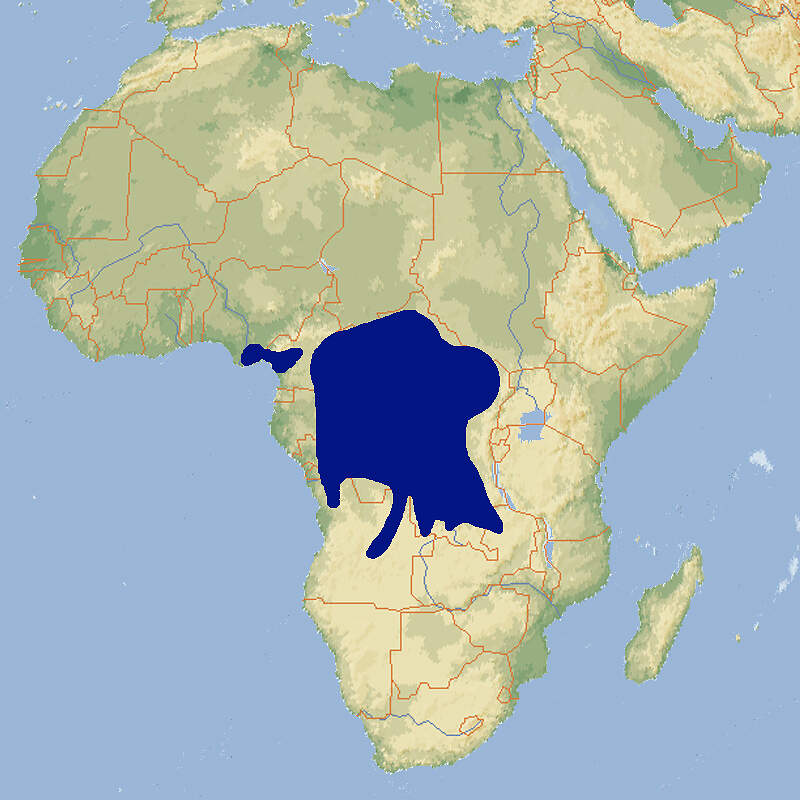
Die neuweltlichen Blattnasen sind die einzige Fledermausfamilie von der mehrere Arten regelmäßig und in größerer Zahl in europäischen Zoos gezeigt werden. Geeignet sind insbesondere Arten, die sich auf den Verzehr von Nektar, Früchten oder Blut spezialisiert haben, wie die harmlose und daher für begehbare Anlagen geeignete, fruchtfressende Brillenblattnase. Körperbau und KörperfunktionenIhren Namen verdanken die Blattnasen dem charakteristischen Nasenaufsatz, der wie ein Blatt aussieht. Die Kopf-Rumplänge beträgt etwa 5.5 cm, der Schwanz ist 1 cm lang, der Unterarm misst im Mittel 41 mm und das mittlere Gewicht beträgt 17 g für Männchen und 16 g für Weibchen [4]. VerbreitungMittel- und Südamerika : Belize, Bolivien, Brasilien, Costa Rica, Ekuador, El Salvador, Französisch Guiana, Guatemala, Guyana, Honduras, Kolumbien, Mexiko, Nikaragua, Panama, Paraguay, Peru, Saint Kitts und Nevis, Surinam, Trinidad und Tobago [1]. Lebensraum und LebensweiseBrillenblattnasen schlafen in kleinen Gruppen oder in Kolonien von mehreren hundert Tieren in Fels- oder Baumhöhlen, Tunnels oder unter dem Dach von Häusern. Sie ernähren sich ausschließlich von Früchten, die sie mit Hilfe ihres ausgezeichneten Geruchssinns finden. Zu ihrer Lieblingsnahrung gehören Beeren und Steinfrüchte von Pfeffergewächsen, daneben nehmen sie Nektar und Pollen oder, wenn pflanzliche Nahrung knapp wird, Insekten. Sie wurden auch schon beim Fressen von Guaven, Bananen und wilden Feigen beobachtet. In einem großen Teil ihres Areals bringen die Weibchen nach einer Tragzeit von 115-120 Tagen im Abstand von 115-173 Tagen jeweils ein Junges zur Welt. Dieses ist schon weit entwickelt. Es hat ein Geburtsgewicht von 5 g und hat die Augen bereits geöffnet. Es bleibt während der ersten zwei Lebenswochen praktisch ständig auf der Mutter [1; 2; 3]. Gefährdung und SchutzDie Brillenblattnase wird aufgrund einer Beurteilung aus dem Jahr 2015 nicht als gefährdet angesehen, da sie weit verbreitet ist, eine große Gesamtpopulation hat, auch in Schutzgebieten vorkommt und vom Menschen modifizierte oder geschaffene Lebensräume nutzen kann. (Rote Liste: LEAST CONCERN) [1]. Der internationale Handel ist durch CITES nicht geregelt. Bedeutung für den MenschenDie Art wird witschaftlich weder genutzt noch richtet sie Schäden an [1]. HaltungFledermäuse können Wirte und potenzielle Überträger von auf den Menschen übertragbaren Viren und anderen Krankheitserregern sein. Bei Brillenblattnasen aus deutschen Haltungen wurden z. B. Chlamydien nachgewiesen. Übertragungen quf den Menschen sind aus Zoos allerdings keine bekannt. Auch sonst sind Brillenblattnasen vollkommen harmlos. Sie sind sehr wendig und können dank ihrem Echoortungssystem im dichten Blattwerk und auf engstem Raum manövrieren. Sie werden deshalb gerne freifliegend in für Besucher begehbaren Tropen-oder Nachttierhallen gehalten. Sie sind unter Zoobedingungen recht langlebig. Den Altersrekord hält ein im Henry Doorley Zoo, Omaha, gborenes Weibchen, das dort nach 17 Jahren immer noch am Leben war [4]. Die Art wird in rund 40 Zoos gehalten, von denen sich etwa ein Viertel im deutschsprachigen Raum befinden. Für Details siehe Zootierliste. Mindestanforderungen an Gehege: Die im Säugetiergutachten 2014 des BMEL vorgegebenen Zahlen entbehren einer wissenschaftlichen Grundlage und sind, zuminderst wenn es um große Kolonien geht, aus der Sicht der tierhalterischen Praxis überzogen. Wie die Tierschutzsachverständigen der Zoos festhielten, zeigt die Erfahrung, dass in einem Gehege von 20m³ problemlos 50 Brillenblattnasen gehalten werden können (laut Gutachten dürften es nur 20 sein), und dass ein Raumvolumen von 160m³ für 700 Brillenblattnasen absolut auseichend ist (das Gutachten gibt 292 m³ vor). Grundsätzlich sollte keine Mindestfläche, sondern nur ein Volumen vorgegeben werden. Das Gutachten’96 gab für kleine Fledermäuse keine Gehegedimensionen an. Es empfiehlt sich, die Beurteilung der Haltung von Kleinfledermäusen darauf abzustellen, ob bei der in einer Haltung gegebenen Besatzdichte Probleme auftreten oder nicht. Die Schweizerische Tierschutzverordnung (Stand 01.06.2022) schreibt für bis zu 20 Tiere eine Grundfläche von 10 m² bei einer Höhe von 2 m vor, für jedes weitere sind 0.2 m² zusätzliche Fläche erforderlich. Nach der 2. Tierhaltungsverordnung Österreichs (Stand 2023) sind für bis zu 20 Tieren eine Grundfläche von 20 m² und eine Höhe von 2.5 m erforderlich, für jedes weitere Tier ist die Grundfläche um 2 m² zu erhöhen. Letzteres ist unsinnig, nachdem für die ersten 20 nur eine Fläche von 1 m² pro Tier verlangt wird. Taxonomie und NomenklaturDie Art wurde 1758 von Carl von LINNÉ als "Vespertilio perspicillata" beschrieben. John Edward GRAY, ein Mitglied der Londoner Zoologischen Gesellschaft stellte sie 1838 in die neue Gattung Carollia [5]. |
Literatur und Internetquellen
- BARQUEZ, R. et al. (2015). Carollia perspicillata. The IUCN Red List of Threatened Species 2015: e.T3905A22133716. http://www.iucnredlist.org/details/3905/0. Downloaded on 15 May 2018.
- EISENBERG, J. F. (1989)
- GRZIMEK, B. (Hrsg. 1970)
- WEIGL, R. (2005)
- WILSON, D. E. & REEDER, D. M. (2005)
- FRITSCHI, J. S. (2020)
Zurück zu Übersicht Insektenfresser und Fledertiere
Weiter zu Gemeiner Vampir (Desmodus rotundus)
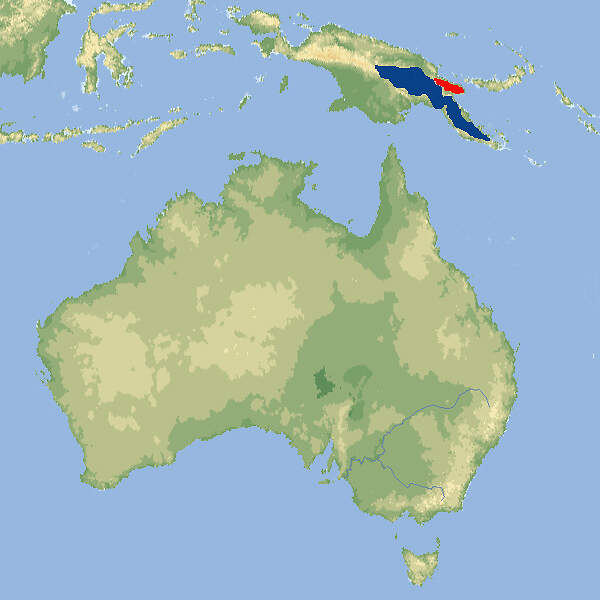
Matschie-Baumkänguru
Unterklasse: Beuteltiere (MARSUPIALIA)
Ordnung: Känguruverwandtschaft (DIPROTODONTIA)
Unterordnung: Känguruartige (Macropodiformes)
Familie: Kängurus (Macropodidae)
Unterfamilie: Eigentliche Kängurus (Macropodinae)
Matschie-Baumkänguru
Dendrolagus matschiei • The Matschie's Tree Kangaroo • Le dendrolague de Matschie
- Körperbau und Körperfunktionen
- Verbreitung
- Lebensraum und Lebensweise
- Gefährdung und Schutz
- Bedeutung für den Menschen
- Haltung
- Taxonomie und Nomenklatur
- Literatur und Internetquellen
|
Weitere Bilder auf BioLib.cz |
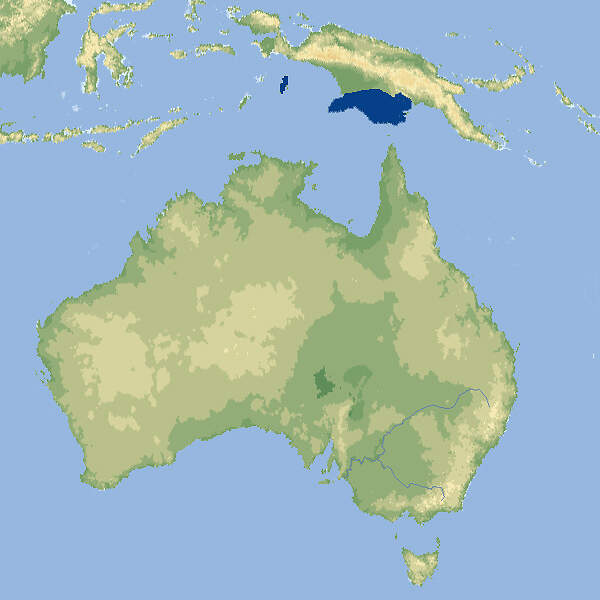
Das Matschie-Baumkänguru ist eine auffällige Erscheinung und eignet sich daher gut als Botschafter für Natur- und Artenschutz in Neuguinea. In Europa wird die Haltung zugunsten des Goodfellow-Baumkängurus aufgegeben, währenddem in Nordamerika ein koordiniertes Zuchtprogramm weiterläuft. Körperbau und KörperfunktionenDendrolagus matschiei ist eine kleinere Baumkänguru-Art ohne markanten Geschlechtsdimorphismus. Beide Geschlechter sind in etwa gleich groß. Die Kopf-Rumpflänge beträgt etwa 51-66 cm, die Schwanzlänge 45-68 cm, und das Gewicht liegt zwischen 7 und 10.5 kg. Das kontrastreiche Fell ist kurz und wollig. Mitten auf dem Rücken befindet sich ein Paar Haarwirbel. Die Färbung ist ähnlich wie beim Goodfellow-Baumkänguru, jedoch fehlen die hellen Längsstreifen auf dem Rücken [1; 10]. VerbreitungNeuguinea: Papua-Neuguinea, höhere Lagen der Huon-Halbinsel. Ferner gibt es eine vermutlich eingeführte Population auf der Vulkaninsel Umboi. Das Artareal umfasst etwa 14'000 km² [10]. Lebensraum und LebensweiseDas Matschie-Baumkänguru besiedelt Regenwälder in Höhenlagen von 1'000 bis 3'300 m. Über sein Sozialverhalten im Freiland ist wenig bekannt. Vermutlich lebt es einzeln bzw. als Mutter-Kind-Gruppe. Es nutzt Streifgebiete von rund 140 ha, was im Vergleich zu anderen Baumkängurus sehr viel ist. Es ernährt sich am Boden oder auf Bäumen von Blättern verschiedener Bäume und Büsche, Schlingpflanzen und Farnen und bisweilen auch von Blüten oder Früchten [8; 10]. Weibchen werden mit etwa 25 Monaten geschlechtsreif. Paarungen können während des ganzen Jahres stattfinden. Nach einer Tragzeit von rund 44-45 Tagen wird in der Regel ein einzelnes Junges geboren. Kurz vor der Geburt reinigt das Weibchen akribisch seinen Beutel. Das Junge beginnt mit rund 9 Monaten festes Futter zu sich zu nehmen. Es steigt erstmals mit 10 Monaten aus dem Beutel und verlässt ihn mit etwa 13 Monaten definitiv. Danach begleitet es die Mutter für weitere 2-3 Monate [2; 4; 8]. Gefährdung und SchutzDas Matschie-Baumkänguru hat bereits natürlicherweise eine geringe Populationsdichte und ein kleines Verbreitungsgebiet (begrenzt auf höhere Lagen). Durch die Jagd und den Lebensraumverlust werden die Bestände noch weiter dezimiert. Ein weiteres Problem besteht darin, das alle Tiere nur einer einzigen Subpopulation angehören. Deshalb wird die Art (ohne Berücksichtigung der Umboi-Population) als stark gefährdet beurteilt (Rote Liste: ENDANGERED) [10]. Der internationale Handel wird durch CITES nicht geregelt. Zoogestütztes Artenschutzprojekt (Beispiel):
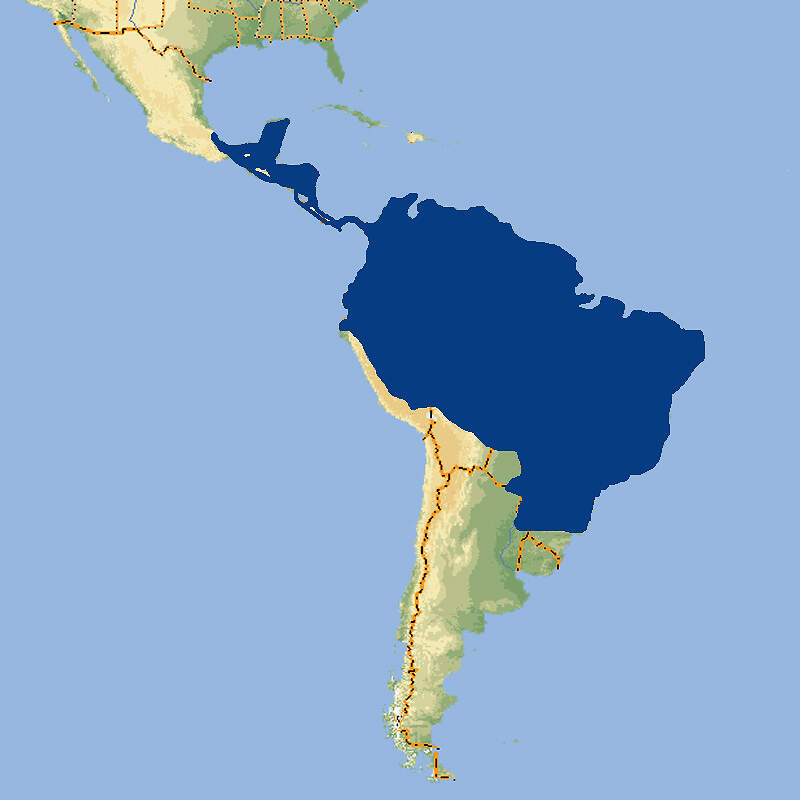
Bedeutung für den MenschenWirtschaftliche Bedeutung: Das Matschie-Baumkänguru wird auf der Huon-Halbinsel Neuguineas traditionell zur Fleischgewinnung bejagt [10]. HaltungMatschie-Baumkängurus sollten in Gehegen mit ausreichend Klettermöglichkeiten und erhöht angebrachten Futterstellen untergebracht werden. Idealerweise sollte die Umgebungstemperatur für diese Tiere tropischer Bergwälder bei 18-22ºC liegen, jedoch ertragen Matschie-Baumkängurus ohne Schaden zu nehmen erhebliche Temperaturschwankungen. Im Zoo von Adelaide, wo sie zusammen mit anderen Känguruarten ganzjährig in einem größeren Außengehege gehalten wurden, schwankten die Temperaturen zwischen 0°C im Winter und 47.6°C im Sommer. Bei hohen Temperaturen lecken sich die Baumkängurus die Unterarme, um abzukühlen [1]. Meist werden sie paarweise oder als Trios gehalten. Eine Vergesellschaftung mit Schnabeligeln, Klein- oder Rattenkängurus, Flughunden oder Vögeln ist möglich. Das älteste, von WEIGL erfasste Matschie-Baumkänguru, ein Weibchen, starb in einer amerikanischen Institution im Alter von 26 Jahren und 11 Monaten [7]. Es gibt seit 1987 ein Internationales Zuchtbuch (ISB), das am Lincoln Children's Zoo, Nebraska, geführt wird. Dieses umfasste im Juni 2014 73 lebende Individuen in 27 Einrichtungen [IZY 52]. Haltung in europäischen Zoos: Die ersten Matschie-Baumkängurus gelangten in den 1930er-Jahren in den Londoner Zoo, wo es 1932 zur Erstzucht kam. 1936 gelangte das erste Tier in den Frankfurter Zoo und damit aufs europäische Festland [6]. Die Art wird gegenwärtig (2023) nur noch in einem einzigen Zoo gehalten. Für Details siehe Zootierliste. Das 1990 ins Leben gerufene, vom Krefelder Zoo koordinierte Europäische Erhaltungszuchtprogramm (EEP) wurde aufgegeben. Es wird versucht, in Europa einen Bestand an goodfellowi aufzubauen, währenddem sich die amerikanischen Zoos auf matschiei konzentrieren. Früher wurde die Art relativ häufig in Europa gehalten. In den 1970er-Jahren war der Zoo Zürich der erste europäische Zoo, der wieder Matschie-Baumkängurus aus Papua-Neuguinea erhielt. Von 1971-1982 wurden dort 16 Jungtiere geboren und aufgezogen [JB und Tierbestandslisten Zoo Zürich]. Die deutsche Erstzucht gelang dem Zoo Berlin im Jahr 1976. Forschung im Zoo: Unter Beteiligung zahlreicher Zoos wurde eine umfangreiche Arbeit über das Ruheverhalten verschiedener Känguru-Arten, darunter Dendrolagus matschiei, durchgeführt [5]. Die Kenntnisse über das Fortpflanzungsverhalten beruhen weitgehend auf einer Dissertation, die Lisa DABEK in Seattle durchgeführt hat [2; 8]. Mindestanforderungen an Gehege: Das Säugetiergutachten 2014 des BMEL gibt ein fakultatives Außengehege mit einer Mindestfläche von 40 m² für ein Paar und 10 m² für jedes weitere Tier an. Das Innengehege soll 16 m² groß und 3 m hoch sein, und für jedes weitere Tier ist die Fläche um 8 m² zu erhöhen. Die Tierschutzverordnung der Schweiz (Stand 01.06.2022) schreibt für 1- 2 Tiere je ein Innen- und ein Außengehege von 16 m²/40m³ vor. Für jedes weitere Tier sind die Grundflächen um jeweils 4 m² zu erhöhen. Die 2. Tierhaltungsverordnung Österreichs (Stand 2023) verlangt für ein Paar ein Außen- und ein Innengehege von je 20 m²/60 m³. Für jedes weitere Tier ist die Fläche außen wie innen um 2 m² zu erhöhen. Nach JACKSON soll für 2 Tiere eine Gehegefläche von 40 m² nicht unterschritten werden [3]. Taxonomie und NomenklaturDas Matschie-Baumkänguru wurde 1907 dem deutschen Naturforscher Friedrich Förster und dem englischen Bankier und Zoologen Lionel Walter Rothschild anhand eines Exemplars aus dem damaligen Deutsch-Neuguinea unter seinem heute noch gültigen Namen beschrieben. Zeitweilig wurden goodfellowi und spadix als Unterarten von matschiei angesehen, aber diese werden jetzt als selbständige Arten anerkannt [8]. Sie sind aber nahe mit dem Matschie-Baumkänguru verwandt. Die Artareale von goodfellowi und matschiei stoßen aneinander und in Menschenobhut hybridisieren die beiden Arten leicht. Eventuell gibt es auch im Freiland eine Übergangszone. |
Literatur und Internetquellen
- CROOK, G. A. & SKIPPER, G. (1987)
- DABEK, L. (1994)
- JACKSON, S. M. (2003)
- OLDS, T. J. & COLLINS, L. R. (1973)
- SCHÜRER, U. (1978)
- SCHÜRER, U. (2019)
- WEIGL, R. (2005)
- WILSON, D. E. et al. eds. (2009-2019)
- WOODLAND PARK ZOO - YUS CONSERVATION AREA
- ZIEMBICKI, M. & POROLAK, G. (2016). Dendrolagus matschiei. The IUCN Red List of Threatened Species 2016: e.T6433A21956650. http://www.iucnredlist.org/details/6433/0. Downloaded on 15 June 2018.
- ROSS, T. & DABEK, L. (2006)
Zurück zu Übersicht Kloaken- und Beuteltiere
Neuguinea-Filander
Unterklasse: Beuteltiere (MARSUPIALIA)
Ordnung: Känguruverwandtschaft (DIPROTODONTIA)
Unterordnung: Känguruartige (Macropodiformes)
Familie: Kängurus (Macropodidae)
Unterfamilie: Eigentliche Kängurus (Macropodinae)

Neuguinea-Filander
Thylogale brunii • The Dusky Pademelon • Le pademelon à queue courte
- Körperbau und Körperfunktionen
- Verbreitung
- Lebensraum und Lebensweise
- Gefährdung und Schutz
- Bedeutung für den Menschen
- Haltung
- Taxonomie und Nomenklatur
- Literatur und Internetquellen
|
Weitere Bilder auf BioLib |
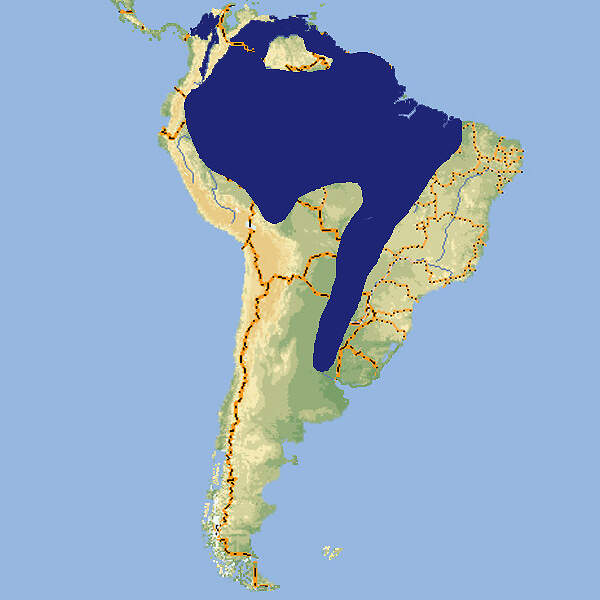
Als an das Waldleben angepasster Vertreter der Kängurufamilie ist der Neuguinea-Filander von einem gewissen zoopädagogischen Interesse. Als kleinere Art ist es auch für begehbare Gehege geeignet. Er war in den 1970-80er Jahren in europäischen Zoos relativ gut vertreten, war dann nur noch in wenigen Einrichtungen zu sehen, und in den letzten Jahren nimmt die Zahl der Haltungen wieder zu. Körperbau und KörperfunktionenBei den Neuguinea-Filandern haben die Böcke eine Kopf-Rumpflänge von 58-60 cm und eine Schwanzlänge von 40-57 cm, die Weibchen von 46-53 bzw. 32-35 cm. Das Fell ist oberseits dunkel graubraun gefärbt, auf der Unterseite deutlich heller. An Gesicht und Hüften befinden sich weiße Streifen [4]. VerbreitungAustralasien: Südliches Neuguinea (Papua-Neuguinea und Indonesien) sowie die Aru- und Kai-Inseln Indonesiens [2]. Lebensraum und LebensweiseDer Neuguinea-Filander besiedelt Tiefland-Regenwald, Monsunwald, Galeriewälder, Sekundärwälder und Savannen. Er ist vermutlich überwiegend dämmerungs- und nachtaktiv, aber es ist sehr wenig über seine Lebensgewohnheiten im natürlichen Lebensraum bekannt. Er frisst Gräser, Laub und vermutlich Pilze [4]. Die im Vergleich zu Steppenkängurus deutlich geringeren Körperausmaße, der kurze Hals, der keilförmige Kopf und der runde Rücken sind Anpassungen an die Lebensweise im dichten Unterholz, die den Filandern dort ein schnelles Fortkommen ermöglichen. Sie besetzen so die ökologische Nische, die in „beuteltierfreien“ Gebieten beispielsweise von Muntjakhirschen oder Duckern eingenommen wird. Die ersten vier bis sechs Lebensmonate verbringt das Kängurujunge im Beutel. Neuguinea-Filander sind früh geschlechtsreif und können bereits nach einem guten Jahr mitunter schon selbst für Nachwuchs sorgen [PM Zoo Magdeburg]. Gefährdung und SchutzGefährdung und Schutz: Der Neuguinea-Filander wurde in einem Teil seines Verbreitungsgebiets bereits ausgerottet, und die verbleibenden Bestände nehmen ab. Er wird deshalb aufgrund einer Beurteilung aus dem Jahr 1994, letztmals überprüft 2015, als gefährdet eingestuft (Rote Liste: VULNERABLE) [2]. Der internationale Handel ist unter CITES nicht geregelt. Bedeutung für den MenschenDer Neuguinea-Filander wird zwecks Fleischgewinnung bejagt [2]. HaltungNach JACKSON soll für 5 Tiere eine Gehegefläche von 70 m² nicht unterschritten werden [1]. Als Höchstalter werden 9 Jahre und 5 Monate für ein in den USA gehaltenes Weibchen angegeben [3]. Im Zoo Magdeburg leben die Filander zusammen mit Lachenden Hänsen (Dacelo gigas) in einer Voliere, im Tierpark Berlin zusammen mit einem Goodfellow-Baumkänguru. Haltung in europäischen Zoos: Die Zahl der Haltungen hat in den letzten Jahren meklich zugenommen. Gegenwärtig (2023) wird die Art in etwa 20 Zoos gezeigt, darunter einzelnen im deutschsprachigen Raum. In praktisch allen Einrichtungen gelingt die Zucht. Für Details siehe Zootierliste. Mindestanforderungen an Gehege: Das Säugetiergutachten 2014 des BMEL gibt für das Außengehege eine Mindestfläche von 150 m² für bis 5 Tiere und 15 m² für jedes weitere Tier an. Das Innengehege soll 10 m² groß sein und für jedes weitere Tier ist die Fläche um 2 m² zu erhöhen. Die Tierschutzverordnung der Schweiz (Stand 01.06.2022) schreibt für bis 5 Tiere ein Außengehege von 250 m² und für jedes weitere Tier zusätzlich 15 m² vor. Das Innengehege muss 15 m² groß sein und für jedes weitere Tier ist die Fläche um 3 m² zu erhöhen. Die 2. Tierhaltungsverordnung Österreichs (Stand 2023) verlangt für bis 5 Tiere ein Außengehege von 200 und ein Innengehege von 4 m². Für jedes weitere Tier ist die Fläche außen wie innen um 10% zu erhöhen. Taxonomie und NomenklaturDer Neuguinea-Filander wurde 1778 vom thüringischen Naturforscher Johann Christian Daniel von SCHREBER in Band III seines in Erlangen verlegten Werks "Histoire naturelle des quadrupèdes représentés d´après nature" unter dem Namen "Didelphis brunii" erstmals wissenschaftlich beschrieben. Die Gattungsbezeichnung Didelphis wird heute nur noch für amerikanische Opossums verwendet. Thylogale wurde 1837 von John Edward GRAY vom Britischen Museum in London für den Rothalsfilander (Thylogale thetis) eingeführt. Zu den Filandern gehören sieben Arten, die von Tasmanien über Ostaustralien bis Neuguinea verbreitet sind. Vier davon wurden bis vor wenigen Jahren zur Art Thylogale browni zusammengefasst, darunter auch Thylogale brunii. Heute gilt T. brunii als monotypische Art [2; 4]. |
Literatur und Internetquellen
- JACKSON, S. M. (2003)
- LEARY, T. et al. (2016). Thylogale brunii. The IUCN Red List of Threatened Species 2016: e.T21870A21958826. http://www.iucnredlist.org/details/21870/0. Downloaded on 15 June 2018.
- WEIGL, R. (2005)
- WILSON, D. E. et al. eds. (2009-2019)
Zurück zu Übersicht Kloaken- und Beuteltiere
Weiter zu Sumpfwallaby (Wallabia bicolor)
KURZ, J. (2006)
Untersuchungen zu den Sozialbeziehungen von Kalifornischen Seelöwen (Zalophus californius californius) und Seehunden (Phoca vitulina) in der Gemeinschaftshaltung des Tiergartens Nürnberg.
München, GRIN Verlag GmbH, http://www.diplomarbeiten24.de/vorschau/66110.html
ISBN (eBook): 978-3-638-58419-7. DOI: 10.3239/9783638584197. Dateigröße: 2299 KB
Examensarbeit im Fach Biologie
144 Seiten
Ruprecht-Karls-Universität Heidelberg
Zusammenfassung
Seit dem Spätsommer 2005 leben im Aqua Park, einer Wassergehegeanlage des Nürnberger Tiergartens, Kalifornische Seelöwen (Zalophus californius californius) gemeinsam mit Gemeinen Seehunden (Phoca vitulina). Diese Vergesellschaftung bietet eine der seltenen Möglichkeiten, das Verhalten der beiden sozial lebenden Arten nicht nur auf Sozialbeziehungen innerhalb der Art hin zu untersuchen, sondern auch in Bezug auf zwischenartliche soziale Kontakten.
Kalifornische Seelöwen sind polygam, d.h. sie bilden Haremsverbände, die von erwachsenen Männchen dominiert werden. Gemeine Seehunde schwimmen in der Regel einzeln, tummeln sich aber an Land zumeist in kleineren Gruppen, die allerdings keine festen sozialen Beziehungen haben.
Obwohl eine Zoohaltung den Tieren in keiner Weise Lebensbedingungen bieten kann, die vollständig denen in Freiheit entsprechen, können Studien über das Verhalten von Tieren in Gefangenschaft durchaus Aufschluss über Verhaltensspektren geben, die auch in freier Wildbahn auftreten.
In dem Seelöwen-Seehundgehege des Aqua Parks leben derzeit neun erwachsene Seelöwen: Der Bulle Patrick und acht Weibchen von denen drei zur Zeit der Beobachtung Jungtiere hatten. Die Seehundfamilie ist wesentlich kleiner, sie besteht nur aus dem jungen Geschwisterpaar Finchen und Nele.
Fragestellung:
Folgende Hypothesen wurden aufgestellt und auf ihre Richtigkeit hin untersucht:
• Nullhypothese: Die Tiere haben untereinander gleich stark ausgeprägte soziale Kontakte.
• Alternativhypothese: Es zeigen sich deutliche Unterschiede in der Intensität der sozialen Kontakte zwischen den Tieren.
• Nullhypothese: Die Tiere nutzen das ihnen zu Verfügung stehende Gehege gleichmäßig.
• Alternativhypothese: Die Tiere nutzen das ihnen zu Verfügung stehende Gehege nicht gleichmäßig.
kurz-biblio
Tigerspatelwels
Überklasse: Knochenfische (OSTEICHTHYES)
Klasse: Strahlenflosser (ACTINOPTERYGII)
Unterklasse: Neuflosser (NEOPTERYGII)
Teilklasse: Echte Knochenfische (TELEOSTEI)
Ordnung: Welsartige (Siluriformes)
Familie: Antennenwelse (Pimelodidae)
Tigerspatelwels
Pseudoplatystoma fasciatum • The Barred Sorubim • Le surubi tigré
- Körperbau und Körperfunktionen
- Verbreitung
- Lebensraum und Lebensweise
- Gefährdung und Schutz
- Bedeutung für den Menschen
- Haltung
- Taxonomie und Nomenklatur
- Literatur und Internetquellen
|
Weitere Bilder auf BioLib.cz |
Der Tigerspatelwels erregt wegen seiner Größe und Gestalt die Aufmerksamkeit des Publikums und bietet sich so als Botschafterart für den Schutz der Gewässer und Tieflandregenwälder Südamerikas an. Er wird daher recht häufig in europäischen Zoos und Schauaquarien gezeigt. Körperbau und KörperfunktionenDer Tigerspatelwels wird bis 104 cm lang und 70 kg schwer. Er hat einen langen, vorne abgeflachten Kopf, der an einen Entenschnabel erinnert, und drei lange Bartelpaare, die meist nach vorne gerichtet sind. Der Körper ist langgestreckt und schlank. Die Oberseite ist olivbraun, die Unterseite weißlich gefärbt, auf dem Rücken und den Seiten schwarz oder dunkelbraun getigert [1; 2]. VerbreitungSüdamerika: Einzugsgebiete der größeren Fluss-Systeme östlich der Anden: Argentinien, Bolivien, Brasilien, Ekuador, Französisch Guyana, Guyana, Kolumbien, Paraguay (?). Peru, Surinam, Uruguay, Venezuela [1; 3]. Lebensraum und LebensweiseDer Tigerspatelwels ist ein nachtaktiver Räuber, der alles frisst, was er überwältigen kann. Tagsüber versteckt er sich gerne zwischen Wasserpflanzen, im Wasser liegenden Bäumen oder unter Uferüberhängen [2; 3]. Gefährdung und SchutzDie Art wurde im Rahmen der Roten Liste der IUCN noch nicht beurteilt. Der internationale Handel ist durch CITES nicht geregelt. Bedeutung für den MenschenDer Tigerspatelwels ist Gegenstand der gewerblichen und der Sportfischerei. Er befindet sich im internationalen Aquarienfischhandel [2]. Angebote liegen z.B. bei 15 € für 10 cm lange Jungtiere und 70-120 € für 40-50 cm lange Tiere (Online-Inserate 2018). HaltungEine Gemeinschaftshaltung ist nur mit Fischen möglich, die sehr groß oder sehr klein sind. Alle anderen werden gefressen. Für die Haltung in Privathand ist die Art wegen ihrer Größe und Fresslust nur sehr bedingt geeignet [3]. Haltung in europäischen Zoos: Die Zahl der Haltungen hat in den letzten Jahren abgenommen. Gegenwärtig (2022) wird die Art noch in rund 45 europäischen Einrichtungen gezeigt, von denen sich etwa ein halbes Dutzend im deutschsprachigen Raum befinden. Für Details siehe Zootierliste. Mindestanforderungen: In Deutschland gibt es keine konkreten Mindestnormen für das Halten von Tigerspatelwelsen. In Österreich fordert die 2. Tierhaltungsverordnung (Stand 2022) für 2 Tiere ein Becken mit einer Mindestfläche von 4 m². In der Schweiz gibt Anhang 2, Tabelle 8 der Tierschutzverordnung an, wie viele Liter Wasser pro cm Gesamtkörperlänge (ohne Schwanzflosse) der gehaltenen Fische angeboten werden müssen. Taxonomie und NomenklaturDie Art wurde bereits von Carl von LINNÉ (1766) unter dem Namen "Silurus fasciatus" beschrieben. 1862 stellte sie der niederländischer Ichthyologen Pieter BLEEKER in die neue Gattung Pseudoplatystoma [1]. |
Literatur und Internetquellen
Zurück zu Übersicht Fische
Elefantenrüsselfisch
Überklasse: Knochenfische (Osteichthyes)
Klasse: Strahlenflosser (Actinopterygii)
Unterklasse: Neuflosser (Neopterygii)
Teilklasse: Echte Knochenfische (Teleostei)
Ordnung: Knochenzünglerartige (Osteoglossiformes)
Familie: Nilhechte und Elefantenfische (Mormyridae)

Elefantenrüsselfisch
Gnathonemus petersii • The Peters' Elephantnose Fish • Le poisson-éléphant
- Körperbau und Körperfunktionen
- Verbreitung
- Lebensraum und Lebensweise
- Gefährdung und Schutz
- Bedeutung für den Menschen
- Haltung
- Taxonomie und Nomenklatur
- Literatur und Internetquellen
|
Weitere Bilder auf BioLib.cz |
Trotz seiner überwiegend nächtlichen Lebensweise ist der Elefantenrüsselfisch eine attraktive Art, die als schwach elektrischer Fisch auch zoopädagogisch etwas hergibt. Sie wird allerdings in europäischen Zoos und Schauaquarien nicht sehr oft gehalten. Körperbau und KörperfunktionenElefantenrüsselfische erreichen eine Gesamtlänge von 20-23 cm. Am Unterkiefer des endständigen Mauls haben sie einen fleischigen Fortsatz, den "Rüssel". Sie sind sogenannt aktiv schwach-elektrische Fische. Sie produzieren mit einem speziellen Organ am Schwanzansatz elektrische Impulse, die ein dreidimensionales Feld um den Fischkörper herum aufbauen. Objekte, Artgenossen oder Beutetiere, die in die Nähe kommen, besitzen eine andere Leitfähigkeit als das Umgebungswasser und „verbiegen“ das elektrische Feld. Der Rüsselfisch kann diese sehr feinen Feldveränderungen mit Sinnesorganen wahrnehmen, die sich in grosser Menge – es sind mehr als 2000! – auf seiner ganzen Körperoberfläche befinden. Besonders sensibel ist das sogenannte Schnauzenorgan, eine rüsselförmige Verlängerung des Unterkiefers. Mit ihm untersucht der Fisch seine Umgebung nach Fressbarem, es vollführt dabei rhythmische seitliche Suchbewegungen [3; 4; 5]. VerbreitungZentral- und Westafrika: Von Nigeria bis zur Zentralafrikanischen Republik im Osten, und bis Angola und Sambia im Süden. Lebensraum und LebensweiseIn Flüssen und Seen. Elefantenrüsselfische sind territorial, d.h. im Aquarium werden schwächere Tiere der eigenen Art bekämpft oder unterdrückt. Gegenüber Fischen anderer Arten sind sie dagegen verträglich [4]. Gefährdung und SchutzDer Elefantenrüsselfisch ist weit verbreitet, und gilt seit 2010 aufgrund einer Beurteilung aus dem Jahr 2009 global wie regional als nicht-gefährdet (Rote Liste: LEAST CONCERN). Dies wurde 2020 übereprüft und bestätigt. Allerdings sind weitere Untersuchungen zur Taxonomie nötig, da es sich auch um mehr als eine Art handeln könnte [1]. Der internationale Handel ist durch CITES nicht geregelt. Bedeutung für den MenschenDie Art wird lokal zu Speisezwecken gefangen und befindet sich im Aquarienfischhandel [2]. Ihr elektrische Organ, bot Anlass, sie in Wasserwerken als Trinkwasserwächter einzusetzen. Normalerweise können 800 Stromschläge pro Minute gemessen werden [4]. HaltungHaltung in europäischen Zoos: Die Art wird, wohl als einzige ihrer Gattung, in rund 40 europäischen Einrichtungen gezeigt, von denen sich etwa ein Drittel im deutschsprachigen Raum befinden. Für Details siehe Zootierliste Mindestanforderungen: In Deutschland empfiehlt das Gutachten über Mindestanforderungen an die Haltung von Zierfischen (Süßwasser) für die Haltung von Elefantenrüsselfischen als Gruppe oder vergesellschaftet mit anderen Arten ein Mindest-Wasservolumen von 150 l. Dasselbe Volumen wird in Österreich durch die 2. Tierhaltungsverordnung vorgeschrieben. Anhang 2, Tabelle 8 der Schweizerischen Tierschutzverordnung gibt an, wie viele Liter Wasser pro cm Gesamtkörperlänge (ohne Schwanzflosse) der gehaltenen Fische angeboten werden müssen. Taxonomie und NomenklaturDie Art wurde 1862 von dem aus Esslingen stammenden und am Londoner Naturhistorischen Museum tätigen Taxonomen Albert Karl Ludwig Gotthilf GÜNTHER als "Mormyrus petersii" beschrieben. Die Gattung Gnathonemus wurde ein Jahr später von dem amerikanischen Ichthyologen Theodore Nicholas GILL aufgestellt [2]. |
Literatur und Internetquellen
- OLAOSEBIKAN, B.D. et al. 2020. Gnathonemus petersii. The IUCN Red List of Threatened Species 2020: e.T181553A134970864. https://dx.doi.org/10.2305/IUCN.UK.2020-2.RLTS.T181553A134970864.en . Downloaded on 19 December 2020.
- FISH BASE
- GRZIMEK, B. (Hrsg. 1970)
- RIEHL, R. & BAENSCH, H.A. (1985)
- ZOO BASEL
Zurück zu Übersicht Fische
Weiter zu Arapaima (Arapaima gigas)
Südafrikanisches Stachelschwein
Überordnung: EUARCHONTOGLIRES
Taxon ohne Rang: Nagetiere und Hasen (GLIRES)
Ordnung: Nagetiere (RODENTIA)
Unterordnung: Stachelschweinverwandte (Hystricomorpha)
Familie: Stachelschweine (Hystricidae)

Südafrikanisches Stachelschwein
Hystrix africaeaustralis • The Cape Porcupine • Le porc-épic de l'Afrique du Sud
- Körperbau und Körperfunktionen
- Verbreitung
- Lebensraum und Lebensweise
- Gefährdung und Schutz
- Bedeutung für den Menschen
- Haltung
- Taxonomie und Nomenklatur
- Literatur und Internetquellen
|
Weitere Bilder auf BioLib.cz |
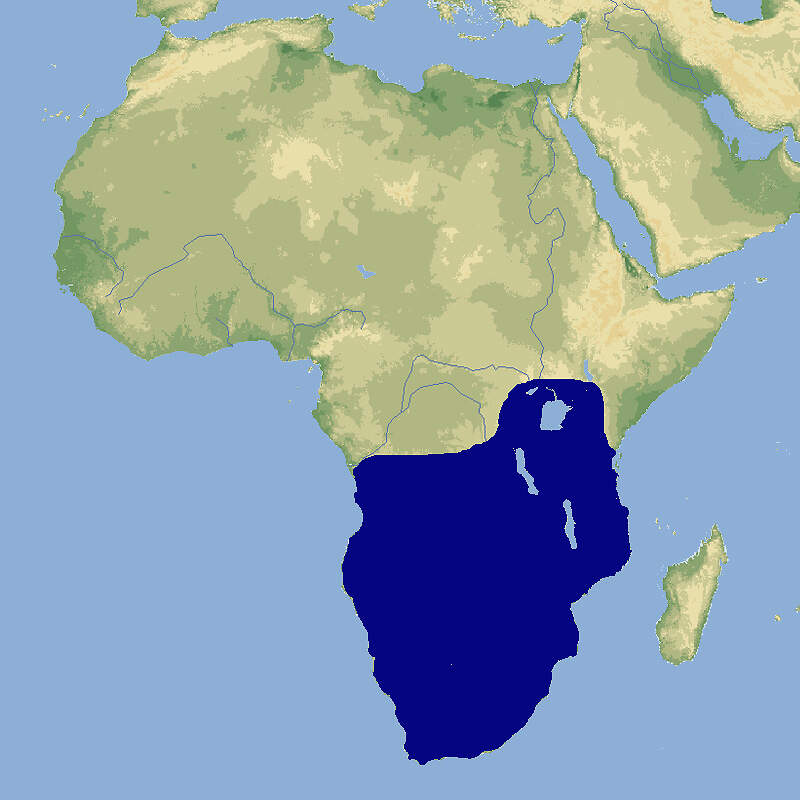
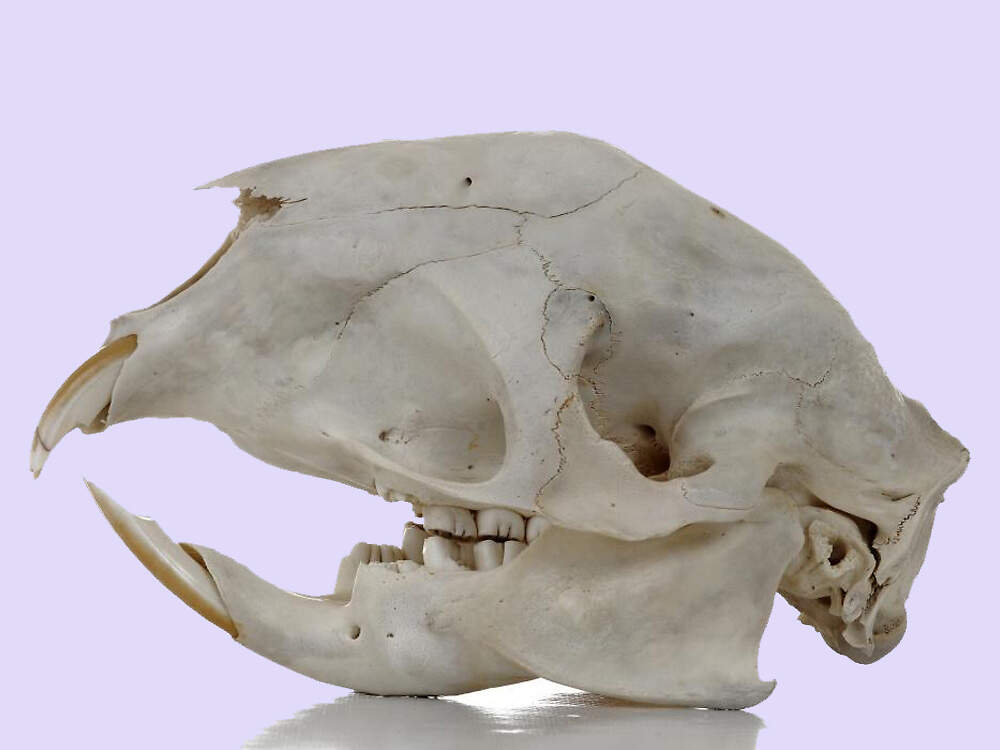
Die Vertreter der Gattung Hystrix im engeren Sinne sind wegen der Umwandlung des Haarkleids in ein Stachelkleid und wegen ihres Verhaltens von besonderem zoopädagogischem Interesse und gehören zu den Standardtieren in Zoologischen Gärten, wobei die genaue Artbestimmung bisweilen Mühe macht. Körperbau und KörperfunktionenZusammen mit dem Gewöhnlichen Stachelschwein (Hystrix cristata) ist das Südafrikanische Stachelschwein die größte Nagetierart auf dem Afrikanischen Kontinent. Die Tiere erreichen eine Kopf-Rumpflänge von 63-81 cm, eine Schwanzlänge von 10-13 cm und ein Gewicht von 10-12(-24) kg. Die Weibchen werden bis zu einem Viertel schwerer als die Männchen, sie haben 2-3 Paar Zitzen, ansonsten unterscheiden sich die Geschlechter äußerlich nicht. Wie bei Hystrix cristata und im Gegensatz zu Hystrix indica sind beim Südafrikanischen Stachelschwein die Spitzen der Nackenmähne weiß [4]. VerbreitungOst- und Südliches Afrika: Botswana, Burundi, Kenia, Kongo, Kongo Dem., Lesotho, Malawi, Mosambik, Namibia, Ruanda, Sambia, Simbabwe, Südafrika, Swasiland, Tansania, Uganda [1]. Lebensraum und LebensweiseDas Südafrikanische Stachelschwein besiedelt unterschiedlichste Lebensräume von Seehöhe bis 2000 Meter über Meer. Es meidet dichten Wald, kommt aber in lockerem Wald (Miombo) bis hin zur Namibwüste vor. Den Tag verbringen die Tiere in natürlichen, selbst gegrabenen oder von Erdferkeln (Orycteropus afer) übernommenen Erdhöhlen [2]. Ihr Stachelkleid macht Stachelschweine zu einer wenig einladenden Beute für Großkatzen oder große Greifvögel. Sie erscheinen dadurch wesentlich wuchtiger als sie in Wirklichkeit sind. Die Wirkung wird durch ein typisches Abwehrverhalten noch gesteigert: Bei Beunruhigung sträuben die Tiere die Stacheln und erscheinen dadurch plötzlich doppelt so groß. Hält die Bedrohung an, rasseln sie mit dem Schwanz. Nähert sich der Feind dennoch, kehrt das Stachelschwein ihm das Hinterteil zu und rammt ihm seine Stacheln in den Körper. Eingedrungene Stacheln gehen am Stachelschweinrücken leicht aus [2; 3]. Stachelschweine leben in Familiengruppen, innerhalb derer sich nur das monogame α-Paar fortpflanzt Nach einer Tragzeit von 93-105 Tagen gebärt die Weibchen meist nur einmal im Jahr 1-3 etwa 300-400 g schwere, weit entwickelte Junge, deren Körper mit noch weichen Stacheln bedeckt ist. Die Jungen werden 3-4 Monate gesäugt. Männchen werden mit 8-18 Monaten, Weibchen im 2. Lebensjahr geschlechtsreif [6]. Gefährdung und SchutzDie Art ist weitverbreitet, kommt in zahlreichen Schutzgebieten vor und gilt daher aufgrund einer Beurteilung im Jahr 2016 als nicht-gefährdet (Rote Liste: LEAST CONCERN) [1]. Internationaler Handel durch CITES nicht geregelt. Bedeutung für den MenschenDas Südafrikanische Stachelschwein wird zur Fleischgewinnung bejagt [1]. HaltungWEIGL gibt als Höchstalter über 23 Jahre und 6 Monate an, erreicht von einem im Leipziger Zoo gehaltenen männlichen Tier [5]. Haltung in europäischen Zoos: Die Art wird in rund 70 Zoos gehalten, von denen sich ein paar wenige im deutschsprachigen Raum und beinahe die Hälfte in Großbritannien befinden. Für Details siehe Zootierliste. Nach Säugetiergutachten 2014 können Stachelschweine der Gattung Hystrix ganzjährig in Außengehegen gehalten werden, wenn sie im Winter Zugang zu einem frostfreien Schutzraum haben. Für 2 Stachelschweine soll eine Mindestfläche von 20 m² angeboten werden, für jedes weitere Tier 5 m² mehr. Die Schweizerische Tierschutzverordnung (Stand 01.06.2022) schreibt für 2 Stachelschweine ein Außengehege mit einer Mindestfläche von 40 m², Grabgelegenheit und Schlafboxen, eventuell heizbarem Innenraum vor. Nach der 2. Tierhaltungsverordnung Österreichs (Stand 2023) ist für ein Paar oder eine Familiengruppe Stachelschweine ein Außengehege mit einer Mindestfläche von 40 m² mit einer Sand- oder Erdschicht als Bodengrund und Unterstand erforderlich. Taxonomie und NomenklaturDas Südafrikanisches Stachelschwein wurde 1852 vom nachmaligen Direktor des Berliner Zoos, Wilhelm PETERS unter seinem heute noch gültigen Namen erstmals wissenschaftlich beschrieben [6]. |
Literatur und Internetquellen
- CASSOLA, F. (2016). Hystrix africaeaustralis (errata version published in 2017). The IUCN Red List of Threatened Species 2016: e.T10748A115099085. http://www.iucnredlist.org/details/10748/0. Downloaded on 22 May 2018.
- MILLS, G & HES, L. (1999)
- MOHR, E. (1965)
- RUDLOFF, K. (2011)
- WEIGL, R. (2005)
- WILSON, D. E. et al. eds. (2009-2019)
Zurück zu Übersicht Hasen und Nagetiere
BRANDT, B. (2013)
Notizen zur Haltung und Zucht der Elenantilope (Taurotragus oryx [Pallas, 1776]) im Zoologischen Garten Berlin seit dem Zweiten Weltkrieg.
BONGO Berlin 44 (2013): 35-52.













![Matschie-Baumkänguru (Dendrolagus matschei). Illustration zur Originalbeschreibung von FÖRSTER, F. & ROTHSCHILD, L. W. (1907) in Novitates Zoologicae, Pl. IV. Gemeinfrei. Anmerkung: Die helle Gesichtszeichnung ist nicht dargestellt [siehe 6]. 102 012 006 006 dendrolagus matschiei novitates](images/101-Mono-Mars/102-012-006-006_dendrolagus_matschiei_novitates.jpg)