Beutelwolf †
Unterklasse: Beuteltiere (MARSUPIALIA)
Ordnung: Raubbeutlerartige (DASYUROMORPHIA)
Familie: Beutelwölfe (Thylacinidae)
Beutelwolf
Thylacinus cynocephalus † • The Thylacine or Tasmanian Tiger • Le loup marsupial
- Körperbau und Körperfunktionen
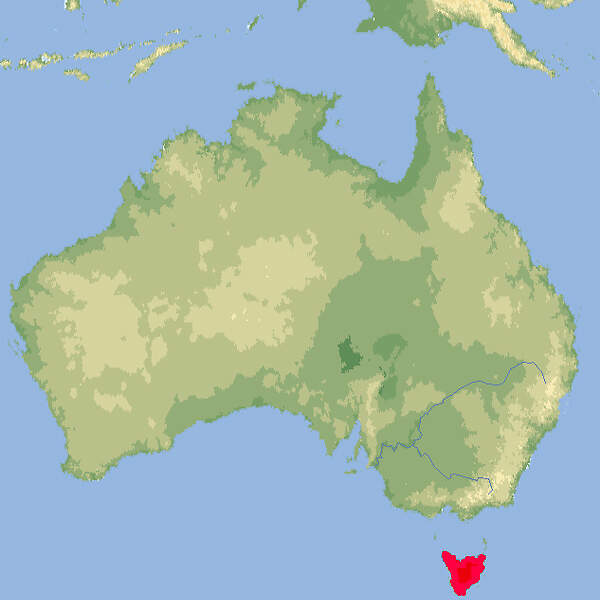
- Verbreitung
- Lebensraum und Lebensweise
- Gefährdung und Schutz
- Bedeutung für den Menschen
- Haltung
- Taxonomie und Nomenklatur
- Literatur und Internetquellen
|
Weitere Bilder auf BioLib.cz |
Der Beutelwolf war der größte Raubbeutler, der in geschichtlicher Zeit in Australien lebte. Etwa 30 Tiere wurden in europäischen Zoos gehalten, es kam aber zu keiner Zucht. Das letzte bekannte Tier, ein Weibchen, starb 1936 im Zoo von Hobart auf Tasmanien. Körperbau und KörperfunktionenDer in seinem Habitus einem Hund ähnliche Beutelwolf wies eine Kopf-Rumpflänge von 85-118 cm, eine Schwanzlänge von 33-61 cm und ein Gewicht von 15-35(-45) kg auf. Einzelne Individuen sollen noch viel größer gewesen sein. Das kurzhaarige Fell war graubraun, stellenweise ins Gelbliche gehend, und auf dem Rücken und der Schwanzwurzel befanden sich auffällige schwarzbraune Querstreifen, denen das Tier seinen englichen Namen "Tasmanian Tiger" verdankt. Die Weibchen hatten einen nach hinten geöffneten Beutel und vier Zitzen [4]. VerbreitungAustralien: Ehemals Tasmanien. Auf dem australischen Festland vor 2'000 Jahren, auf Neuguinea noch früher ausgestorben [1]. Lebensraum und LebensweiseMit Ausnahme der kühlen Feuchtwälder besiedelten Beutelwölfe alle Lebensräume Tasmaniens. Sie waren hauptsächlich nachtaktiv. Ihre Hauptbeute waren Kängurus und Wallabies, die sie einzeln oder zu zweit jagten [1]. Gefährdung und SchutzAuf der Roten Liste der IUCN ist die Art seit 1982 als ausgestorben aufgeführt [1]. Die Art unterlag Handelsbeschränkungen nach CITES-Anhang I, wurde aber mit Wirkung auf den 12. Juni 2013 aus dem Anhang gestrichen. Bedeutung für den MenschenDer Beutelwolf stand im Ruf, ein Schafräuber zu sein, und wurde deshalb intensiv verfolgt. Als er schon sehr selten war, kam die Sammeltätigkeit für Museen als weiterer, das Aussterben beschleunigender Faktor dazu. Es bestehen hier also Parallelen zum Aussterben des "Lämmergeiers" im Alpenraum [1]. Haltung im ZooIn europäischen Zoos wurden insgesamt etwa 30 Beutelwölfe gehalten, die meisten davon im Londoner Zoo, der erstmals 1850 ein Paar eingeführte. Der nächste traf 1856 aus dem damals „Van Diemen’s Land“ genannten Tasmanien ein [2]. Der letzte starb am 9. August 1931. Im deutschsprachigen Raum wurden zwischen 1864 und 1910 insgesamt 6 Beutelwölfe in den Zoos von Berlin und Leipzig gehalten. Für Details siehe Zootierliste. Lebenserwartung und Zucht: Der älteste bekannte Beutelwolf starb im Alter von 12 Jahren und 6 Monaten im Zoo von Hobart (Tasmanien) [3]. Mindestanforderungen an Gehege: Auch wenn die Art wider Erwarten nicht ausgestorben sein sollte, ist nicht davon auszugehen, dass sie je wieder in Europa gehalten wird. Daher gibt es keine Mindestanforderungen. Taxonomie und Nomenklatur1808 beschrieb der britische Kolonialbeamte George Prideaux Robert HARRIS den Beutelwolf als "Didelphys cynocephalus". Die Gattung Thylacinus wurde 1824 vom ersten Direktor des Leidener Naturkundemuseums, Coenraad Jacob TEMMINCK, im ersten Band seiner "Monographies de Mammalogie" aufgestellt. Es sind keine Unterarten anerkannt [1]. Die aus mindestens 8 Gattungen bestehende Familie der Beutelwölfe entstand im Oligozän, d h. vor rund 30 Millionen Jahren. Das am längsten überlebende Genus, Thylacinus, war, soweit man bis jetzt weiß, eine artenarme Gattung. Eine erste Art, Thylacinus macknessi, ist aus dem frühen Miozän (vor ca. 16 Millionen Jahren) bekannt. Zu Ende des Miozäns und im frühen Pliozän entwickelten sich vier Arten, von denen es nur Th. cynocephalus bis in das Pleistozän und die Jetztzeit schaffte [5]. |
Literatur und Internetquellen
- BURBIDGE, A.A. & WOINARSKI, J. (2016). Thylacinus cynocephalus. The IUCN Red List of Threatened Species 2016: e.T21866A21949291. http://www.iucnredlist.org/details/21866/0. Downloaded on 05 April 2018.
- SCLATER, P. L. (1862 ff). List(s) of the vertebrated animals now or lately living in the gardens of the Zoological Society of London. Printed for the Society; England.
- WEIGL, R. (2005)
- WILSON, D. E. et al. eds. (2009-2019)
- YATES, A. M. (2015)
Zurück zu Übersicht Kloaken- und Beuteltiere
Weiter zu Koala (Phascolarctos cinereus)
Riesenbeutelmarder
Unterklasse: Beuteltiere (MARSUPIALIA)
Ordnung: Raubbeutlerartige (DASYUROMORPHIA)
Familie: Raubbeutler (Dasyuridae)
Unterfamilie: Beutelmarder (Dasyurinae)

Riesen- oder Fleckenschwanzbeutelmarder
Dasyurus maculatus • The Tiger Quoll • Le chat marsupial à queue tachetée
- Körperbau und Körperfunktionen
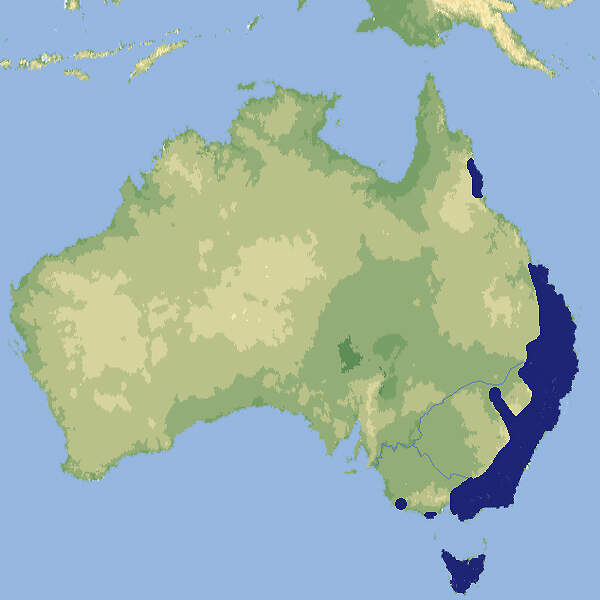
- Verbreitung
- Lebensraum und Lebensweise
- Gefährdung und Schutz
- Bedeutung für den Menschen
- Haltung
- Taxonomie und Nomenklatur
- Literatur und Internetquellen
|
Weitere Bilder auf BioLib.cz |
Wie sein Name sagt, ist der Riesenbeutelmarder die größte Art seiner Gattung. Er war in europäischen Zoos stets ein seltener Gast und wird jetzt seit über 40 Jahren nicht mehr gehalten. Körperbau und KörperfunktionenDer Riesenbeutelmarder zeigt einen ausgeprägten Sexualdimorphismus. Rüden der Nominatform erreichen eine Kopf-Rumpflänge von 38-76 cm, eine Schwanzlänge von 37-55 cm und ein Gewicht von 1.5-5 kg, Fähen eine Kopf-Rumpflänge von 35-45 cm, eine Schwanzlänge von 34-42 cm und ein Gewicht von 0.9-12.5 kg. Tiere der nördlichen Unterart D. gracilis bleiben etwas kleiner. Die erste Zehe ist vorhanden. Die Sohlenballen sind stark gerippt. Das Gebiss ist mehr an Fleischnahrung angepasst als bei den anderen Arten der Gattung. Das Fell ist braun mit weißen Flecken. Auch der Schwanz ist gefleckt [2; 6]. VerbreitungAustralien: Queensland, New South Wales, Süd-Australien, Tasmanien [1]. Lebensraum und LebensweiseDer Riesenbeutelmarder besiedelt unterschiedliche Waldtypen vorzugsweise oberhalb einer Höhe von 900 m, Küstenbusch und auf Tasmanien Heiden. Die Tiere sind auch tagsüber aktiv, allerdings häufiger während der Nacht. Sie sind Einzelgänger, die große Streifgebiete nutzen, wobei die Weibchen einen Teil davon mit einer Fläche von 180-1'000 ha als Territorium verteidigen, auf dem sie nur ihre eigenen Nachkommen tolerieren. Die Riesenbeutelmarder bewegen sich mehr am Boden als auf Bäumen. Sie nutzen vorzugsweise Baumhöhlen als Unterkünfte. Sie überwältigen gelegentlich kleinere Wallabies oder große Vögel, ihre Hauptbeute sind aber Reptilien, Kleinvögel, Kleinsäuger und Vogeleier [1; 6]. Die Angaben zum Sexualzyklus der Weibchen variiert je nach Quelle von 28 bis 36-58 Tagen. Der Östrus dauert 3-5 Tage, Paarungen können sich über 17 Stunden hinziehen. Nach einer Trächtigkeit von 21 Tagen werden pro Wurf 4-6 Junge geboren. Diese lassen mit 35-49 Tagen die Zitzen los und bleiben im Bau, bis die Mutter von der Jagd zurückkommt. Mit 96 Tagen verlassen sie den Beutel definitiv, werden mit 125-150 Tagen entwöhnt und mit 12 Monaten geschlechtsreif. Fähen können sich bis zu einem Alter von 3, Rüden von 5 Jahren fortpflanzen [3; 6]. Gefährdung und SchutzMit rund 20'000 erwachsenen Individuen sind die Bestände noch relativ groß, aber sie nehmen ab. Aufgrund einer Beurteilung aus dem Jahr 2008 wird die Art deshalb als potenziell gefährdet eingestuft (Rote Liste: NEAR THREATENED) [1]. Der internationale Handel ist unter CITES nicht geregelt. Es gelten Ausfuhrbeschränkungen Australiens. Bedeutung für den MenschenWie echte Marder fühlen sich die Riesenbeutelmarder zu Hühnerhöfen hingezogen und werden daher oft von den Geflügelhaltern getötet [1; 2]. Haltung im ZooRiesenbeutelmarder werden in der Regel in Nachttierhäusern gehalten. Männchen und Weibchen können nur während der Paarungszeit zusammen gehalten werden [4]. Der älteste bekannte Riesenbeutelmarder in Menschenobhut verstarb im Londoner Zoo im Alter von 6 Jahren und 10 Monaten [5]. Haltung in europäischen Zoos: Riesenbeutelmarder waren in europäischen Zoos stets außerordentlich selten. 1860 erhielt der Londoner Zoo erstmals einen Wildfang aus Tasmanien. Die letzte Haltung, im Zoo von Rotterdam, endete um 1977. Erst 2018 konnte der Hamerton Zoo wieder Tiere aus einem australischen Zoo importieren, das letzte von diesen starb 2022, ohne dass es zu einem Zuchterfolg gekommen wäre. Für Details siehe Zootierliste. Mindestanforderungen an Gehege: Das Säugetiergutachten 2014 des BMEL enthält keine Angaben für Beutelmarder. Im Gutachten von 1996 werden Innengehege von 2-8 m² „je nach Art“ vorgegeben, was bedeutet, dass für Fleckenbeutelmarder 8 m² erforderlich sind. Die Tierschutzverordnung der Schweiz (Stand 01.06.2022) regelt das Halten von Beutelmardern nicht. Die 2. Tierhaltungsverordnung Österreichs (Stand 2023) schreibt eine Grundfläche von 10 m²/Paar sowie eine Raumhöhe von 2 m vor. Taxonomie und NomenklaturDie Art wurde 1792 vom schottischen Arzt und Wissenschaftsjournalisten Robert KERR im Rahmen einer Übersetzung ins Englische von LINNÉs Systema Naturae unter ihrem heute noch geltenden Namen beschrieben. Es werden zwei Unterarten anerkannt: D. gracilis im Norden Queenslands und die Nominatform im übrigen Verbreitungsgebiet. Es wurde auch vorgeschlagen, die tasmanische Population als eigene Unterart zu betrachten [1; 6]. |
Literatur und Internetquellen
- BURNETT, S. & DICKMAN, C. (2008). Dasyurus maculatus. The IUCN Red List of Threatened Species 2008: e.T6300A12601070. http://www.iucnredlist.org/details/6300/0. Downloaded on 15 January 2018.
- GRZIMEK, B. (1966)
- JACKSON, S. M. (2003)
- PUSCHMANN, W., ZSCHEILE, D., & ZSCHEILE, K. (2009)
- WEIGL, R. (2005)
- WILSON, D. E. et al. eds. (2009-2019)
Zurück zu Übersicht Kloaken- und Beuteltiere
Weiter zu Tüpfelbeutelmarder (Dasyurus viverrinus)
Kleiner Soldatenara
Ordnung: Papageienvögel (PSITTACIFORMES)
Familie: Echte Papageien (Psittacidae)
Unterfamilie: Eigentliche Papageien (Psittacinae)
Tribus: Neuweltpapageien (Arini)

 Zootier des Jahres 2023
Zootier des Jahres 2023
Kleiner Soldatenara
Ara militaris • The Military Macaw • L'ara militaire
- Körperbau und Körperfunktionen
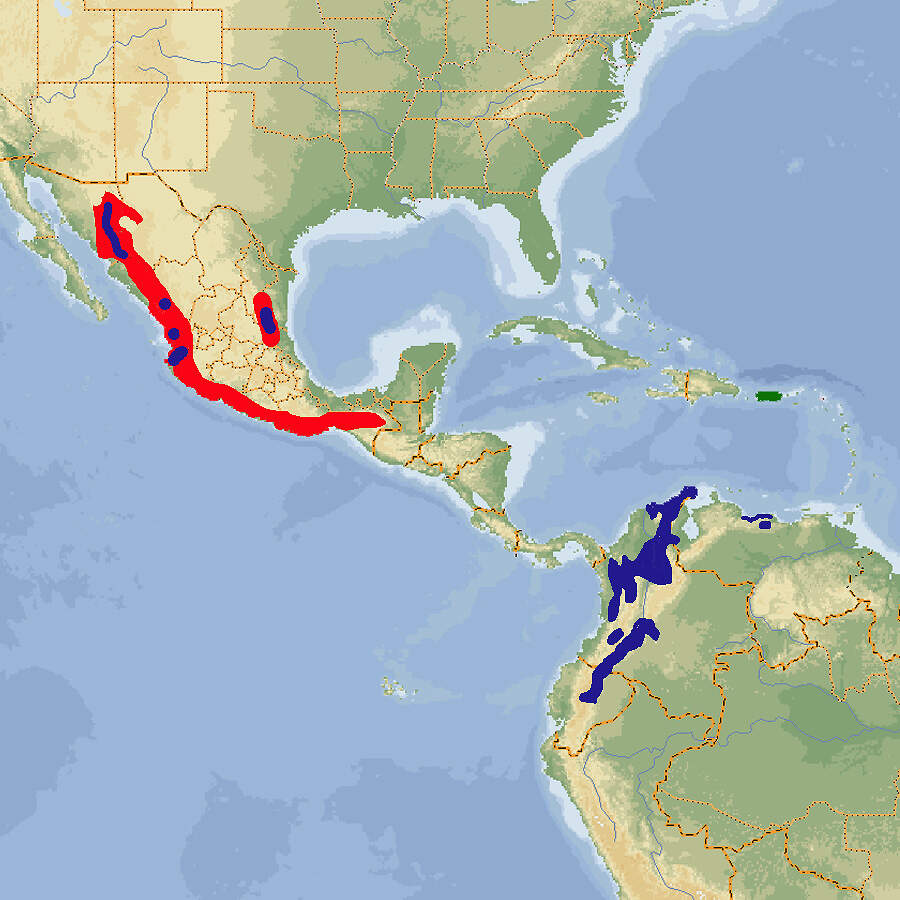
- Verbreitung
- Lebensraum und Lebensweise
- Gefährdung und Schutz
- Bedeutung für den Menschen
- Haltung
- Taxonomie und Nomenklatur
- Literatur und Internetquellen
|
Weitere Bilder auf BioLib.czStimme auf XENO-CANTO |
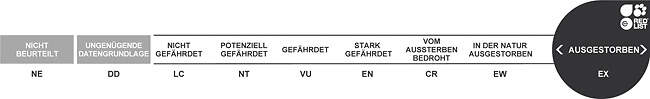
Der Kleine Soldatenara ist eine gefährdete Art, um deren ex situ-Erhaltung sich die Zoos mittels eines europäischen Zuchtbuchs bemühen. In europäischen Tiergärten wird er häufig gehalten. Körperbau und KörperfunktionenDer Kleine Soldatenara erreicht eine Gesamtlänge von 70 cm und ein Gewicht von ca. 970-1'130 g. Er ist also deutlich kleiner als Ara ambiguus. Die Grundfarbe des Gefieders ist grün mit olivem Anflug auf Rücken und Flügeln. Der Kopf ist heller mit bläulichem Schimmer am Hinterkopf. Die Stirn ist rot, die nackte Wangenhaut hell fleischfarben mit Fluren von schwärzlich grünen Federchen. Der Schnabel ist grau-schwarz, die Iris hellgelb und die Füße sind schwarzbraun. Der Kehlfleck ist bräunlich. Die großen Flügeldecken, der Hinterrücken und die Oberschwanzdecken sowie die Außenfahnen der Handschwingen sind blau. Die Schwanzfedern sind oberseits rötlich-braun mit blauen Enden, die Unterseite von Schwanz- und Schwungfedern ist gelb-oliv. Bei Jungvögeln ist die Iris braun [2; 4; 5; 6; 8]. VerbreitungSüdamerika und Mexiko: Argentinien, Bolivien, Ekuador, Kolumbien, Mexiko, Peru, Venezuela [1]. Lebensraum und LebensweiseIn Südamerika besiedelt der Kleine Soldatenara feuchte Tieflandwälder und anschließende offene Gebiete, in Mexiko trockene und halbtrockene offene Wälder, Kiefern-Eichenwälder, feuchte Tieflandwälder und Galeriewälder. Saisonal geht er auch in Dornbusch. Ferner nutzt er Agrarland, Kaffeepflanzungen und Obstgärten. Die Höhenverbreitung reicht vom Meeresspiegel bis auf 3'600 m. Er ernährt sich von verschiedenen Famen, Früchten - vorzugsweise Feigen - und Beeren. Geschlafen und genistet wird in Felswänden oder großen Bäumen. Die Gelege bestehen aus 2-3 Eiern, die während 25-27 Tagen bebrütet werden, die Nestlingszeit dauert 77-98 Tage [1; 7; 8]. Gefährdung und SchutzWegen Lebensraumverlust und Fang für den Tierhandel nehmen die Bestände des Kleinen Soldatenaras seit Jahren ab und werden mittlerweile auf nur noch 2'000-7'000 erwachsene Individuen geschätzt. Er ist deshalb seit 1994, letztmals überprüft 2020, als gefährdet (Rote Liste: VULNERABLE) eingestuft [1]. Der internationale Handel ist seit 1987 nach CITES-Anhang I eingeschränkt. Zoogestütztes Artenschutzprojekt (Beispiel):
Bedeutung für den MenschenVon 2001-2020 wurde als einzigem Ursprungsland aus Mexiko die Ausfuhr von 9 Wildfängen nebst wenig Wissenschaftsmaterial erfasst. Im selben Zeitraum wurden weltweit 1023 Nachzuchtvögel international verschoben. Die meisten davon (350) wurden in Südafrika gezüchtet, gefolgt von den Niederlanden mit 151 Ausfuhren [3]. Haltung1963 glückte dem Wellington Zoo in Neuseeland die Welterstzucht, 1964 dem Fort Woth Zoo die nordamerikanische und 1974 dem Tierpark Berlin die europäische Erstzucht. Bei der Vergesellschaftung mit anderen Ara-Arten kann es leicht zu Mischlingszuchten kommen [7; 8]. Das Höchstalter in Menschenobhut wird mit 54 Jahren und 5 Monaten angegeben [10]. Haltung in europäischen Zoos: Die Art wird in etwa 130 Zoos gezeigt, von denen sich über ein Dutzend im deutschsprachigen Raum befinden. Für Details siehe Zootierliste. Für die Unterart Ara militaris mexicana gibt es ein Europäisches Zuchtbuch (ESB), das am Antwerpener Zoo geführt wird. Mindestanforderungen an Gehege: Nach Papageiengutachten des BMELF von 1995 ist für die Haltung eines Paars oder ausnahmsweise eines Einzelvogels eine Voliere mit einer Fläche von 4 x 2 m und einer Höhe von 2 m erforderlich, ferner ein Schutzraum mit einer Grundfläche von 2 m². Für jedes weitere Paar sind die Grundflächen um 50% zu erweitern. Nach Schweizerischer Tierschutzverordnung (Stand 01.06.2022) sind Aras mindestens paarweise zu halten. Für ein Paar ist eine bei Bedarf unterteilbare Innenvoliere mit Badegelegenheit, einer Grundfläche von 10 m² und einem Volumen von 30 m³ vorgeschrieben, für jedes weitere Tier ist die Grundfläche um 1 m² zu erweitern. Ein Aussengehege ist fakultativ. Ist dieses vorhanden und permanent zugänglich, so können dessen Maße ans Innengehege angerechnet werden, wobei maximal ein Drittel des Innengeheges durch das Außengehege ersetzt werden kann. Die 2. Tierhaltungsverordnung Österreichs (Stand 2023) schreibt für die Haltung eines Paars oder ausnahmsweise eines Einzelvogels eine Voliere mit einer Grundfläche von 4 x 2 m Fläche und einer Höhe von 3 m sowie einen Schutzraum von 2 m² / 2 m Höhe mit einer Mindesttemperatur von 10°C vor. Je weiteres Paar sind die Flächen um 50% zu erweitern. Taxonomie und NomenklaturDer Kleine Soldatenara wurde 1766 von Carl von LINNÉ als "Psittacus militaris" erstmals wissenschaftlich beschrieben und wurde später in die 1799 vom französischen Naturforscher Graf Bernard-Germain-Étienne de LACÉPÈDE eingeführte Gattung Ara gestellt. Es sind drei Unterarten anerkannt: A. m. bolivianus, A. m. mexicanus, A. m. militaris [5]. |
Literatur und Internetquellen
- BIRDLIFE INTERNATIONAL (2020). Ara militaris. The IUCN Red List of Threatened Species 2020: e.T22685548A179407584. https://dx.doi.org/10.2305/IUCN.UK.2020-3.RLTS.T22685548A179407584.en. Downloaded on 18 December 2020.
- CITES IDENTIFICATION MANUAL
- CITES TRADE DATA BASE
- DE GRAHL, W. (1979/82)
- DEL HOYO, J., ELLIOTT, A. et al. (eds., 1992-2013)
- FORSHAW, J. M. & COOPER, W. T. (1981)
- GRUMMT, W. & STREHLOW, H. (2009)
- LANTERMANN, W. (1984)
- LEPPERHOFF, L. (2004)
- YOUNG, A. M., HOBSON, E. A., BINGAMAN LACKEY, L. & WRIGHT, T. F. (2012)
Zurück zu Übersicht Papageienvögel
Weiter zu Rotohrara (Ara rubrogenys)
Gelbbrustara
Ordnung: Papageienvögel (PSITTACIFORMES)
Familie: Echte Papageien (Psittacidae)
Unterfamilie: Eigentliche Papageien (Psittacinae)
Tribus: Neuweltpapageien (Arini)

Gelbbrustara
Ara ararauna • The Blue-and-yellow Macaw • L'ara bleu et jaune
- Körperbau und Körperfunktionen
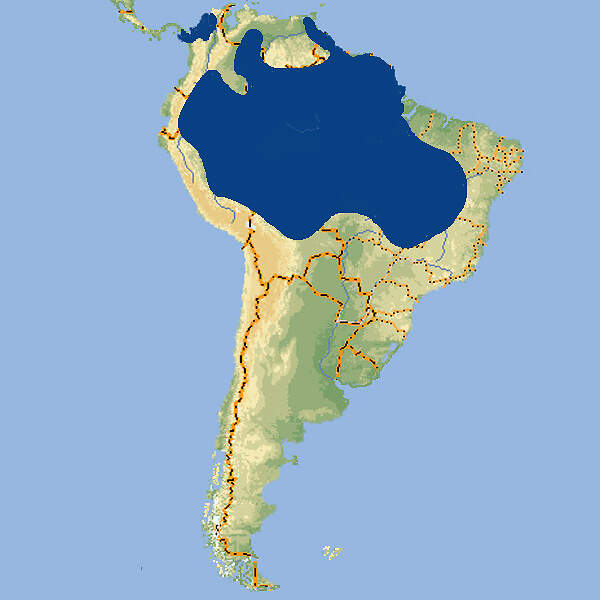
- Verbreitung
- Lebensraum und Lebensweise
- Gefährdung und Schutz
- Bedeutung für den Menschen
- Haltung
- Taxonomie und Nomenklatur
- Literatur und Internetquellen
|
Weitere Bilder auf BioLib.czStimme auf XENO-CANTO |
Der selbst nicht gefährdete Gelbbrustara ist ein plakativ gefärbter Großpapagei, der beim Zoopublikum große Beachtung findet. Er eignet sich daher bestens als Botschafter für Natur- und Artenschutz in seinen südamerikanischen Heimatländern. Er wird aus diesem Grund und weil Zoos öfter in die Lage kommen, aus Tierschutzgründen Vögel aus Privathaltungen zu übernehmen, außerordentlich häufig in europäischen Zoos gehalten. Körperbau und KörperfunktionenDer Gelbbrustara wird 86 cm lang und erreicht ein Gewicht von 1'040-1'286 Gramm. Das Gefieder der Körperoberseite ist hellblau, die Unterseite ist gelb, die Stirn grün und die Kehle schwarz. Der unbefiederte Wangenbereich ist weiß mit schwarzen Federfluren, der Schnabel ist schwarz-grau, die Iris hellgelb und die Füße sind dunkelgrau mit schwarzen Krallen. Bei Jungvögeln ist die Iris dunkel und der Schnabel während der ersten zwei Wochen hell [2; 4; 5; 6; 9; 10]. VerbreitungSüdamerika: Bolivien, Brasilien, Ekuador, Französisch Guiana, Guyana, Panama, Paraguay, Peru, Surinam, Venezuela [1]. Lebensraum und LebensweiseGelbbrustaras bewohnen Galeriewälder und sumpfige Palmenhaine. Zwischen ihren Schlaf- und Futterplätzen können Distanzen von bis zu 25 km liegen. Bevorzugtes Futter sind die Früchte verschiedener Palmen (Mauritia, Oreodoxa, Astrocaryum, Bactris und Maximilianea). Sie sind stets paarweise anzutreffen. Auch wenn sie sich außerhalb der Brutzeit zu größeren Trupps zusammenfinden, ist der Zusammenhalt der Paare deutlich zu erkennen. Die Brutzeit beginnt zwischen Februar und April. Das Nest befindet sich in natürlichen Baumhöhlen abgestorbener Palmen. Es werden 2-4 Eier gelegt, die 25-28 Tage bebrütet werden. Die Nestlingszeit beträgt rund 90-95 Tage und mit 6-9 Monaten werden die Jungvögel selbständig [5; 9; 10]. Gefährdung und SchutzDer Gelbbrustara hat ein sehr großes Verbreitungsgebiet und die Gesamtpopulation ist, trotz rückläufigem Trend, immer noch sehr groß. Er wurde deshalb letztmals 2018 als nicht-gefährdet eingestuft (Rote Liste: LEAST CONCERN) [1]. Der internationale Handel ist nach CITES-Anhang II geregelt. Bedeutung für den MenschenAraraunas werden zur Gewinnung von Fleisch gejagt und für den nationalen und internationalen Heimtierhandel gefangen. Die Ursprungsländer registrierten von 2001-2018 Ausfuhren von 24'848 lebenden Wildfängen, wovon 13'997 aus Guyana, 9'424 aus Surinam kamen. Im selben Zeitraum wurden weltweit Exporte von 64'792 Nachzuchtvögeln erfasst, von denen 55'790 aus Südafrika stammten [1; 3]. HaltungDer Gelbbrustara ist wohl die weltweit am häufigsten gezüchtete Ara-Art. Aus Frankreich sind erfolgreiche Nachzuchten bereits aus den Jahren 1833 und 1892 dokumentiert. In Deutschland wurden Gelbbrustaras 1934 im Grugapark, Essen, gezüchtet. Das Höchstalter in menschlicher Obhut wird mit 48 Jahren und 6 Monaten angegeben [7; 9; 11]. Haltung in europäischen Zoos: Die Art wird in über 500 Zoos gezeigt, von denen sich etwa ein Viertel im deutschsprachigen Raum befinden. Für Details siehe Zootierliste. Forschung im Zoo: Über das Lernverhalten des Gelbbrustaras wurde am Zoo Hannover eine Bachelorarbeit durchgeführt [8]. Mindestanforderungen an Gehege: Nach Papageiengutachten des BMELF von 1995 ist für die Haltung eines Paars oder ausnahmsweise eines Einzelvogels eine Voliere mit einer Fläche von 4 x 2 m und einer Höhe von 2 m erforderlich, ferner ein Schutzraum mit einer Grundfläche von 2 m². Für jedes weitere Paar sind die Grundflächen um 50% zu erweitern. Nach Schweizerischer Tierschutzverordnung (Stand 1.2.2022) sind Aras mindestens paarweise zu halten. Für ein Paar ist eine bei Bedarf unterteilbare Innenvoliere mit Badegelegenheit, einer Grundfläche von 10 m² und einem Volumen von 30 m³ vorgeschrieben, für jedes weitere Tier ist die Grundfläche um 1 m² zu erweitern. Ein Aussengehege ist fakultativ. Ist dieses vorhanden und permanent zugänglich, so können dessen Maße ans Innengehege angerechnet werden, wobei maximal ein Drittel des Innengeheges durch das Außengehege ersetzt werden kann. Die 2. Tierhaltungsverordnung Österreichs (Stand 2022) schreibt für die Haltung eines Paars oder ausnahmsweise eines Einzelvogels eine Voliere mit einer Grundfläche von 4 x 2 m Fläche und einer Höhe von 3 m sowie einen Schutzraum von 2 m² / 2 m Höhe mit einer Mindesttemperatur von 10°C vor. Je weiteres Paar sind die Flächen um 50% zu erweitern. Taxonomie und NomenklaturDer Gelbbrustara wurde 1758 von Carl von LINNÉ als "Psittacus Ararauna" erstmals wissenschaftlich beschrieben. Die heute gültige Gattungsbezeichnung Ara wurde 1799 vom französischen Naturforscher Graf Bernard-Germain-Étienne de LACÉPÈDE eingeführt. Es gibt keine Unterarten [5]. |
Literatur und Internetquellen
- BIRDLIFE INTERNATIONAL (2018). Ara ararauna. The IUCN Red List of Threatened Species 2018: e.T22685539A131917270. http://dx.doi.org/10.2305/IUCN.UK.2018-2.RLTS.T22685539A131917270.en . Downloaded on 04 August 2019.
- CITES IDENTIFICATION MANUAL
- CITES TRADE DATA BASE
- DE GRAHL, W. (1979/82)
- DEL HOYO, J., ELLIOTT, A. et al. (eds., 1992-2013)
- FORSHAW, J. M. & COOPER, W. T. (1981)
- GRUMMT, W. & STREHLOW, H. (2009)
- HEISE, L. (2015)
- LANTERMANN, W. (1984)
- LEPPERHOFF, R. (2004)
- YOUNG, A. M., HOBSON, E. A., BINGAMAN LACKEY, L. & WRIGHT, T. F. (2012)
Zurück zu Übersicht Papageienvögel
Weiter zu Grünflügelara (Ara chloropterus)
Grünflügelara
Ordnung: Papageienvögel (Psittaciformes)
Familie: Echte Papageien (Psittacidae)
Unterfamilie: Eigentliche Papageien (Psittacinae)
Tribus: Neuweltpapageien (Arini)

Grünflügelara, Dunkelroter Ara
Ara chloropterus (A. chloroptera) • The Red-and-green Macaw • L'ara à ailes vertes
- Körperbau und Körperfunktionen
- Verbreitung
- Lebensraum und Lebensweise
- Gefährdung und Schutz
- Bedeutung für den Menschen
- Haltung
- Taxonomie und Nomenklatur
- Literatur und Internetquellen
|
Weitere Bilder auf BioLib.czStimme auf XENO-CANTO |
Der selbst nicht gefährdete Grünflügelara ist ein plakativ gefärbter Großpapagei, der beim Zoopublikum große Beachtung findet. Er eignet sich daher bestens als Botschafter für Natur- und Artenschutz in seinen südamerikanischen Heimatländern. Er wird aus diesem Grund und weil Zoos öfter in die Lage kommen, aus Tierschutzgründen Vögel aus Privathaltungen zu übernehmen, sehr häufig in europäischen Zoos gehalten. Körperbau und KörperfunktionenDer Grünflügelara ist mit 90 und mehr cm Gesamtlänge und einem Gewicht von etwa 1'050-1'700 g etwas größer als der Hellrote Ara. Die Grundfarbe seines Gefieders ist ein dunkleres Rot als bei jenem und die mittleren Flügeldecken sind grün anstatt gelb. Schnabel, Iris und Füße sind bei beiden Arten ähnlich gefärbt: der Oberschnabel zum größeren Teil hornfarben, der Unterschnabel grauschwarz, die Iris hellgelb und die Füße dunkelgrau. Der nackte Wangenbereich ist weiß mit roten Federfluren. Die großen Flügeldecken, die äußeren Armschwingen, die Außenfahnen der Handschwingen und die Schwanzspitzen sind blau [2; 4; 7; 8]. VerbreitungSüdamerika: Argentinien, Bolivien, Brasilien, Ekuador, Französisch Guiana, Guyana, Kolumbien, Panama, Paraguay, Peru, Surinam, Venezuela [1]. Lebensraum und LebensweiseDer Grünflügelara bewohnt hauptsächlich tropische Wälder unterschiedlichen Typs des Tieflandes, sowie Savannen einschließlich des Cerrado. Im Gebirge findet man ihn kaum noch in Höhenlagen über 1'500 m. Er nistet in Baum- oder Felshöhlen, nur selten in Palmenstämmen. Es werden 1-4 Eier gelegt, die 25-28 (24-29) Tage bebrütet werden. Die Nestlingszeit beträgt rund 90-103 Tage und mit 6-9 Monaten werden die Jungvögel selbständig [4; 6; 7; 8]. Gefährdung und SchutzDie Bestände des Grünflügelaras nehmen zwar etwas ab, das Verbreitungsgebiet ist aber so groß, dass die Art letztmals 2016 nicht als gefährdet taxiert wurde (Rote Liste: LEAST CONCERN) [1]. Der internationale Handel ist nach CITES-Anhang II geregelt. Bedeutung für den MenschenGrünflügelaras werden zur Gewinnung von Fleisch gejagt und für den nationalen und internationalen Heimtierhandel gefangen. Die Ursprungsländer registrierten von 2001-2018 Ausfuhren von 21'817 lebenden Wildfängen, wovon 17'711 aus Guyana, 4'091 aus Surinam kamen. Im selben Zeitraum wurden weltweit Exporte von 25'994 Nachzuchtvögeln erfasst, von denen 21'039 aus Südafrika stammten [1; 3]. HaltungVermutlich wurden die ersten Grünflügelaras bereits zu Beginn des 17. Jahrhunderts nach Europa gebracht. Die Welterstzucht gelang 1926 im San Diego Zoo, in Privathand glückte sie 1962 in England. Bei der Gemeinschaftshaltung mit anderen Ara-Arten kann es zu Bastardierungen kommen. Im Zoo Wuppertal z.B. haben ein Ararauna x Grünflügelara-Paar während 18 Jahren an die 40 Jungvögel produziert. Das Höchstalter in menschlicher Obhut wird mit gut 63 Jahren angegeben [6; 7; 9]. Haltung in europäischen Zoos: Die Art wird in rund 310 Zoos gezeigt, von denen sich etwa ein Viertel im deutschsprachigen Raum befinden. Für Details siehe Zootierliste. Mindestanforderungen an Gehege: Nach Papageiengutachten des BMELF von 1995 ist für die Haltung eines Paars oder ausnahmsweise eines Einzelvogels eine Voliere mit einer Fläche von 4 x 2 m und einer Höhe von 2 m erforderlich, ferner ein Schutzraum mit einer Grundfläche von 2 m². Für jedes weitere Paar sind die Grundflächen um 50% zu erweitern. Nach Schweizerischer Tierschutzverordnung (Stand 1.2.2022) sind Aras mindestens paarweise zu halten. Für ein Paar ist eine bei Bedarf unterteilbare Innenvoliere mit Badegelegenheit, einer Grundfläche von 10 m² und einem Volumen von 30 m³ vorgeschrieben, für jedes weitere Tier ist die Grundfläche um 1 m² zu erweitern. Ein Aussengehege ist fakultativ. Ist dieses vorhanden und permanent zugänglich, so können dessen Maße ans Innengehege angerechnet werden, wobei maximal ein Drittel des Innengeheges durch das Außengehege ersetzt werden kann. Die 2. Tierhaltungsverordnung Österreichs (Stand 2022)schreibt für die Haltung eines Paars oder ausnahmsweise eines Einzelvogels eine Voliere mit einer Grundfläche von 4 x 2 m Fläche und einer Höhe von 3 m sowie einen Schutzraum von 2 m² / 2 m Höhe mit einer Mindesttemperatur von 10°C vor. Je weiteres Paar sind die Flächen um 50% zu erweitern. Taxonomie und NomenklaturDer Grünflügelara wurde 1859 von dem britischen Zoologen George Robert GRAY als Ara chloroptera. erstmals wissenschaftlich beschrieben und hieß bis vor wenigen Jahren auch so. Nachdem in einer 2013 veröffentlichten Checkliste festgestellt wurde, dass das grammatikalische Geschlecht von Ara männlich sei, wurde der Artname auf chloropterus geändert. In der Literatur und auf Zoo-Namensschildern finden sich beide Bezeichnungen. Es gibt keine Unterarten [4; 5]. |
Literatur und Internetquellen
- BIRDLIFE INTERNATIONAL (2016). Ara chloropterus. The IUCN Red List of Threatened Species 2016: e.T22685566A93080287. http://dx.doi.org/10.2305/IUCN.UK.2016-3.RLTS.T22685566A93080287.en . Downloaded on 04 August 2019.
- CITES IDENTIFICATION MANUAL
- CITES TRADE DATA BASE
- DEL HOYO, J., ELLIOTT, A. et al. (eds., 1992-2013)
- DEL HOYO, J., COLLAR, N., CHRISTIE, D.A., ELLIOTT, A. & FISHPOOL L.D.C. (2014)
- GRUMMT, W. & STREHLOW, H. (2009)
- LANTERMANN, W. (1984)
- LEPPERHOFF, R. (2004)
- YOUNG, A. M., HOBSON, E. A., BINGAMAN LACKEY, L. & WRIGHT, T. F. (2012)
Zurück zu Übersicht Papageienvögel
Weiter zu Blaulatzara (Ara glaucogularis)
HUA, L., GONG, S., WANG, F., LI, W., GE, Y., LI, X. & HOU, F. (2015)
Captive breeding of pangolins: current status, problems and future prospects.
ZooKeys 507: 99-114 (08 Jun 2015).
https://doi.org/10.3897/zookeys.507.6970.
Abstract:
Pangolins are unique placental mammals with eight species existing in the world, which have adapted to a highly specialized diet of ants and termites, and are of significance in the control of forest termite disaster. Besides their ecological value, pangolins are extremely important economic animals with the value as medicine and food. At present, illegal hunting and habitat destruction have drastically decreased the wild population of pangolins, pushing them to the edge of extinction. Captive breeding is an important way to protect these species, but because of pangolin’s specialized behaviors and high dependence on natural ecosystem, there still exist many technical barriers to successful captive breeding programs. In this paper, based on the literatures and our practical experience, we reviewed the status and existing problems in captive breeding of pangolins, including four aspects, the naturalistic habitat, dietary husbandry, reproduction and disease control. Some recommendations are presented for effective captive breeding and protection of pangolins.
Ganzer Text: http://zookeys.pensoft.net/articles.php?id=5419
BLASZKIEWITZ, B. (1984)
Waldelefanten-Notizen aus dem Zoo Berlin.
BONGO Berlin 8 (1984): 75-80.
Zusammenfassung:
1899 konnte der Berliner Zoo seinen ersten westafrikanischen Elefanten importieren, nach dem PAUL MATSCHIE die Unterart Rundohr- oder Waldelefant (Loxodonta africana cyclotis) beschrieb. Zuvor war nur einmal ein westafrikanischer Elefant nach Europa gelangt, und zwar 1882 in den Hamburger Zoo. Es folgten weitere Tiere, und nach dem zweiten Weltkrieg wurde 1960 durch die Forma RUHE der weibliche Rundohrelefant „Jambo“ importiert, der 1982 im Alter von 27 Jahren im Berliner Zoo starb.
blaszkiewitz-biblio
TIDIÈRE, M., GAILLARD, J-M., BERGER, V., MÜLLER, D.W.H., BINGAMAN LACKEY, L., GIMENEZ, O., CLAUSS, M & LEMAÎTRE, J.-F. (2016)
Comparative analyses of longevity and senescence reveal variable survival benefits of living in zoos across mammals.
Scientific Reports 6, Article number: 36361 (2016)
doi:10.1038/srep36361. http://www.nature.com/articles/srep36361#supplementary-information
Abstract:
While it is commonly believed that animals live longer in zoos than in the wild, this assumption has rarely been tested. We compared four survival metrics (longevity, baseline mortality, onset of senescence and rate of senescence) between both sexes of free-ranging and zoo populations of more than 50 mammal species. We found that mammals from zoo populations generally lived longer than their wild counterparts (84% of species). The effect was most notable in species with a faster pace of life (i.e. a short life span, high reproductive rate and high mortality in the wild) because zoos evidently offer protection against a number of relevant conditions like predation, intraspecific competition and diseases. Species with a slower pace of life (i.e. a long life span, low reproduction rate and low mortality in the wild) benefit less from captivity in terms of longevity; in such species, there is probably less potential for a reduction in mortality. These findings provide a first general explanation about the different magnitude of zoo environment benefits among mammalian species, and thereby highlight the effort that is needed to improve captive conditions for slow-living species that are particularly susceptible to extinction in the wild.
tidiere-biblio
CIRKULAN, S. (2016)
Načrtovanje oskrbe in Živiljenjskega prostora obročkstorepth makijev ali kat (Lemur catta) v Bioparku Lipovec.
Planning of supply and habitat for Ring-tailed Lemur (Lemur catta) in Biopark Lipovec.
Diplomarbeit
Universität Ljubljana, Pädagogische Fakultät und Biotechnische Fakultät
Mentor: doc. dr. Miha Krofel
Zoo Augsburg. Direktorin: Dr. Barbara Jantschke
und andere Zoos
V + 74 Seiten, 12 Tabellen, 36 Abbildungen (Fotos, Grafiken, Pläne)
Abstract:
Ring-tailed Lemur or Katta (Lemur catta) is a species of lemur, which naturally inhabits the gallery forests and spiny scrub of the African island Madagascar. With other lemur species it is one of the endemic species. And it is an extremely flexible and opportunistic species. According to the IUCN Red List from 2014 Ring-tailed Lemur is an endangered species, and is often bred in parks and zoos as part of breeding programs around the world in order to maintain diverse genetic bank and a healthy population of animals in the artificial environment which would be, in the case of extinction in the wild reintroduced into the natural environment. This charismatic lemur will be settled in the Biopark Lipovec, a project that is currently in progress and in Slovenia represents an innovative approach in education, green tourism and especially nature conservation. In the Graduation thesis we used the scientific literature, analysed the life of Ring-tailed Lemurs in nature and compared it with life of animals in an artificial environment in five different European zoos and in the end created a plan of supply, care and living space for the animals to be settled in the Biopark Lipovec. European zoos have very specialized diet plans, based on natural diet. We previewed the best practices and made a diet plan for our lemurs. Ring-tailed lemurs are very flexible and opportunistic, also in nature, that is why in an artificial environment preventive and curative veterinary care is used rarely. Research showed that the quality of exhibit is more important than its size. We also summed up good practices of habitat design and tehniques by other zoos and made a plan of new habitat in Biopark Lipovec and added some innovation and unique solutions for animal display and care. Breeding of Ring-tailed Lemur in an artificial environment is undemanding in comparison with other species. Since the natural environment of Ring-tailed Lemur is still declining due to human impact, the population of wild animals is decreasing, that is why the breeding of animals in zoos and parks, education about endangered species and their habitat, of the most important for the species survival.
cirkulan-biblio
MEEHAN, C.L., MENCH, J.A., CARLSTEAD, K. & HOGAN, J.N. (2016)
Determining Connections between the Daily Lives of Zoo Elephants and Their Welfare: An Epidemiological Approach.
PLoS ONE 11(7): e0158124. doi:10.1371/journal.pone.0158124
Abstract
Concerns about animal welfare increasingly shape people’s views about the acceptability of keeping animals for food production, biomedical research, and in zoos. The field of animal welfare science has developed over the past 50 years as a method of investigating these concerns via research that assesses how living in human-controlled environments influences the behavior, health and affective states of animals. Initially, animal welfare research focused on animals in agricultural settings, but the field has expanded to zoos because good animal welfare is essential to zoos’ mission of promoting connections between animals and visitors and raising awareness of conservation issues. A particular challenge for zoos is ensuring good animal welfare for long-lived, highly social species like elephants. Our main goal in conducting an epidemiological study of African (Loxodonta africana) and Asian (Elephas maximus) elephant welfare in 68 accredited North American zoos was to understand the prevalence of welfare indicators in the population and determine the aspects of an elephant’s zoo environment, social life and management that are most important to prevent and reduce a variety of welfare problems. In this overview, we provide a summary of the findings of the nine papers in the collection titled: Epidemiological Investigations of North American Zoo Elephant Welfare with a focus on the life history, social, housing, and management factors found to be associated with particular aspects of elephant welfare, including the performance of abnormal behavior, foot and joint problems, recumbence, walking rates, and reproductive health issues. Social and management factors were found to be important for multiple indicators of welfare, while exhibit space was found to be less influential than expected. This body of work results from the largest prospective zoo-based animal welfare study conducted to date and sets in motion the process of using science-based welfare benchmarks to optimize care of zoo elephants.
Link zum Volltext: http://journals.plos.org/plosone/article?id=10.1371/journal.pone.0158124
meehan-biblio