RIEGER, I. (1978)
Social Behaviour of Striped Hyenas at the Zurich Zoo.
Carnivore 1: 49-60.
Abstract:
Meeting striped hyenas sniff at the mane and the anal pouch of a conspecific, which presents by turning its tail upright and extruding its anal pouch. During agonistic behavior, striped hyenas turn their black throat patches towards one another. Bites are directed against this patch and the legs. Back returning inhibits attack. For optical displays, striped hyenas use their tails, manes and ears. Meet i ng behavior of striped and spotted hyenas is compared and the evolution of anal gland phermones is discussed. Results of this paper suggest that certain subspecies of striped hyenas might forage in small social units.
rieger-biblio
VÁCLAVOVÁ, L. & ANDĚRA, M. (2007)
Historie chovu a výskytu paovce hřivnaté (Ammotragus lervia) v České republice.
History of keeping and occurrence of the Barbary Sheep (Ammotragus lervia) in the Czech Republic.
Lynx (Praha), n. s., 38: 73–82 (2007). ISSN 0024–7774.
Summary:
In the Czech Republic, Barbary sheep have been kept without interruption since the 1940s. The first animals were imported by W. HAGENBECK to the Prague Zoo in 1935–1936. The greatest development of the Barbary sheep breeding occurred in the 1980s, at which time the Barbary sheep were bred in 9 of the 15 zoos in the Czech Republic, and their total number exceeded 100 head annually (Fig. 1). Thereafter, by the mid-1990s, the number decreased, varying between 33 and 54 head since 1995. In recent years, Barbary sheep have been bred in only four zoos in this country, viz. in Brno, Dvůr Králové nad Labem, Hodonín, and Prague, the latter being the only one that keeps a rather numerous herd. During the past 22 years (1984–2006), with exact evidence of the breeding, 388 births of young were recorded (mean, 17.7 births / year, range 4–38 births / year), yielding a total of 494 young (i.e. 1.3 young per parturition on average). In the period mentioned, the percentage of stillborn young averaged 6.6%, and 55.1% of young survived the 1st year of life on average (Table 1). In captivity, the Barbary sheep show distinct seasonality in breeding: while the young are born throughout the year (except in October when not a single parturition was recorded), the absolute majority of parturitions (86.7%) occurring in late winter and early spring (February to May, Fig. 2). In the 1970s, Barbary sheep several times escaped from within the Plzeň Zoo and, as a result, a free-living population developed (1984–1987). This population appeared to be very vital, capable of reproducing every year and finally divided into several groups which stayed in the areas of several hunting grounds west of Plzeň in the area limited by Road E49 (from Plzeň to Karlovy Vary), the stream of the Mže River, the Hracholusky Dam Reservoir, and the valley of the Úterský Brook (district of Plzeň-sever). The occurrence of the Barbary sheep was recorded in 5 mapping quadrats (6044, 6144, 6145, 6245, 6246), corresponding to 0.8% of the territory of the Czech Republic (Fig. 3). According to unsubstantiated reports, in the early 1990s the population numbered some 47 head, young less than two years of age accounting for over two thirds accounting for that number. In 1991 a decision was reached to completely remove the Barbary sheep from the wild. The last concrete evidence of their occurrence was a female shot in the hunting ground of the Hunters Association at Pernarec in August 1994. The Barbary sheep living in the wild mostly stayed in steep slope terrain locally with rock formations, lying at 380–420 m a. s. l. and mostly grown with secondary young pine-oak woodland (Figs. 4, 5). The animals were rather tame and aggressive at first, but later they gradually adopted the behavioural responses of free-living game. Judging from the occurrence of young, the population reproduced throughout the calendar year. Two shot specimens were subject to epizootological examinations, supplemented by parasitological faecal analyses that revealed the presence of common species of parasites infesting both free-living and domestic ruminants. The occurrence of the Barbary sheep, later recorded in the area to the NE of Plzeň (1999–2000), was connected with several individuals that escaped from the newly established game sanctuary at the boundary between the districts of Rokycany and Rakovník.
Volltext (Tschechisch, PDF)
vaclova-biblio
Gehegeplanung
Der Begründer der Tiergartenbiologie, der Schweizer Zoodirektor Hediger, hat einmal gesagt "nicht jede Ansammlung von Tieren ist ein Zoo". Eine öffentliche Einrichtung mag zwar aufgrund ihres Tierbestands im Sinne der Zoo-Richtlinie der EU als "Zoo" gelten, um aber ihre Aufgaben optimal erfüllen zu können, bedarf es eines Gesamtkonzepts und einer sorgfältigen Planung der Gehege.
|
|
Tiergehege im Zoo, einschließlich Volieren, Aquarien und Terrarien, sind stets ein Kompromiss zwischen den Anforderungen der Tiere, den Wünschen des Publikums und den Notwendigkeiten des Betriebs. Hinzu kommen Einschränkungen, die sich z.B. aus Topographie und Gesamtfläche des Zoos, Rücksichten auf die Anwohner, Finanzierbarkeit, Auflagen der Versicherungen und gesetzlichen Anforderungen, etwa des Umwelt-, Denkmal- oder Baumschutzes ergeben. Im Vordergrund muss aber das Wohl der Tiere stehen. Gehege sind daher so zu gestalten und einzurichten, dass die Verletzungsgefahr für die Tiere gering ist, ihre Gesundheit nicht beeinträchtigt wird und sie sich darin sicher fühlen und arttypisch verhalten können. Dies bedeutet u. a., dass die Gehege im Grundriss keine spitzen Winkel oder Sackgassen aufweisen dürfen, dass in ihnen keine für die Tiere giftigen Pflanzen wachsen, dass ihre Böden keine Schäden an Füßen und Gelenken verursachen, dass ihre Einrichtung alle für die Tiere wesentlichen Fixpunkte beinhaltet, dass, wo erforderlich, Abtrenngehege vorhanden sind und dass sie, Großgehege allenfalls ausgenommen, nicht von allen Seiten für das Publikum einsehbar sind, damit die Tiere sich bei Bedarf zurückziehen können. Nebst Tierwohl- und betrieblichen Aspekten sind die Ansprüche des Publikums zu berücksichtigen: Die Besucher kommen in den Zoo, um Tiere zu sehen. Das muss nicht unbedingt auf dem Präsentierteller sein, aber wenn eine Familie überwiegend an Gehegen vorbeiwandern muss, die scheinbar leer sind, hat der Zoo seinen Zweck verfehlt. Das Gehege soll also ein gewisses Maß an Sichtbarkeit gewährleisten. Darüber hinaus soll das Gehege räumliche Nähe zwischen Besucher und Tier ermöglichen, überraschende Einblicke bieten, einen Eindruck von Großzügigkeit vermitteln, möglichst natürlich wirken und ästhetisch gestaltet sein, damit es für die Besucher attraktiv ist. Währenddem es dem Affen vermutlich ziemlich egal ist, ob er auf einem kubistischen Gerüst herumklettert oder auf einem nachgemachten oder natürlichen Baum, spielt dies für die Wahrnehmung des Publikums eine entscheidende Rolle. Aus zoopädagogischen Gründen wird zudem oft versucht, Landschaft und Vegetation des natürlichen Lebensraums nachzuempfinden, auch wenn das bei Tieren aus manchen Ökozonen nicht ganz einfach ist. Dabei geht es darum, die Tiere so zu präsentieren, dass die Besucher auch ökologische Zusammenhänge erkennen können. Die Planung von Gehegen ist deshalb ein äußerst komplexer, mit großem Aufwand verbundener Prozess, an dem eine breite Palette eigener Mitarbeiter (Kurator, Zootierarzt, Zoopädagoge, Tierpfleger, Gärtner, Handwerker) sowie, nebst dem Architekten, externe Fachleute unterschiedlichster Gebiete teilnehmen sollten. Dies sollte nicht nur für exotische Tierarten gelten, sondern auch für "gewöhnliche" einheimische, die durch geschickte Präsentation deutlich an Attraktivität und damit an edukativem Wert gewinnen, wie dies der ehemalige Direktor des New Yorker Bronx Zoos, Bill CONWAY, bereits 1973 anhand des Ochsenfroschs exemplarisch aufgezeigt hat. Mit zur Planung gehört, sich über Anlagen für die entsprechenden Tiere in anderen Zoos zu informieren, sei es durch Besichtigung, das Einholen von Auskünften beim jeweiligen Zoo sowie das Konsultieren von Fachliteratur oder speziellen Internetauftritten wie der ZooLex Gallery der österreichischen Landschaftsarchitektin Monika FIBY. Dieser enthält nebst gegen 300 Gehegebeschreibungen auch eine umfangreiche Bibliographie sowie Fachartikel, wie z.B. über die Wichtigkeit einer Gesamtplanung (Masterplan) für den Zoo. DOWNLOAD GehegeplanungDOWNLOAD How to exhibit a bullfrog |
Literatur und Internetquellen
- CONWAY, W. G. (1973)
- DOLLINGER, P. (2003)
- FIBY, M. & WORSTELL, C. (2003)
- HEDIGER, H. (1977)
- MEIER, J. (2009)
- SALZERT, W. (2010)
- SOMMER, K. (2016). Tierisch gut gebaut: Die neue Zoo-Architektur. ARCHITONIC
- STERN vom 26.06.2008: Interview mit Peter Rasbach
- ZOO-RICHTLINIE DER EU (1999)
Zurück zu Tierhaltung
Weiter zu Raumangebot
GÜBERT, J., HAHN-KLIMROTH, M. & DIERKES, P. W. (2022)
BOVIDS: A deep learning-based software package for pose estimation to evaluate nightly behavior and its application to common elands (Tragelaphus oryx) in zoos.
Ecology and Evolution 12 (3): e8701. https://doi.org/10.1002/ece3.8701
Abstract:
Only a few studies on the nocturnal behavior of African ungulates exist so far, with mostly small sample sizes. For a comprehensive understanding of nocturnal behavior, the data basis needs to be expanded. Results obtained by observing zoo animals can provide clues for the study of wild animals and furthermore contribute to a better understanding of animal welfare and better husbandry conditions in zoos. The current contribution reduces the lack of data in two ways. First, we present a stand-alone open-source software package based on deep learning techniques, named Behavioral Observations by Videos and Images using Deep-Learning Software (BOVIDS). It can be used to identify ungulates in their enclosure and to determine the three behavioral poses “Standing,” “Lying—head up,” and “Lying—head down” on 11,411 h of video material with an accuracy of 99.4%. Second, BOVIDS is used to conduct a case study on 25 common elands (Tragelaphus oryx) out of 5 EAZA zoos with a total of 822 nights, yielding the first detailed description of the nightly behavior of common elands. Our results indicate that age and sex are influencing factors on the nocturnal activity budget, the length of behavioral phases as well as the number of phases per behavioral state during the night while the keeping zoo has no significant influence. It is found that males spend more time in REM sleep posture than females while young animals spend more time in this position than adult ones. Finally, the results suggest a rhythm between the Standing and Lying phases among common elands that opens future research directions.
gübert-biblio
Goldnackenara
Ordnung: Papageienvögel (PSITTACIFORMES)
Familie: Echte Papageien (Psittacidae)
Unterfamilie: Eigentliche Papageien (Psittacinae)
Tribus: Neuweltpapageien (Arini)

Goldnackenara
Ara = Primolius auricollis • The Golden-collared Macaw • L'ara à collier jaune
- Körperbau und Körperfunktionen
- Verbreitung
- Lebensraum und Lebensweise
- Gefährdung und Schutz
- Bedeutung für den Menschen
- Haltung
- Taxonomie und Nomenklatur
- Literatur und Internetquellen
|
Weitere Bilder auf BioLib.czStimme auf XENO-CANTO |
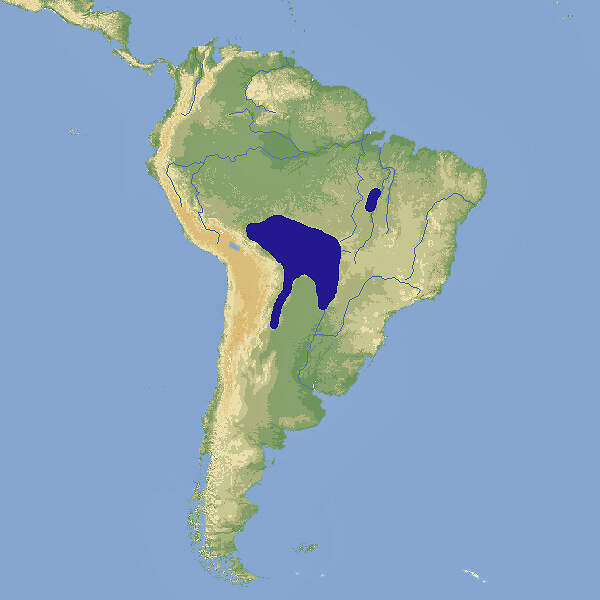
Der Goldnackenara ist ein kleiner Vertreter der Aras. In seinem Verbreitungsgebiet im tropischen und subtropischen Südamerika gilt er als ziemlich häufig und nicht gefährdet. In unseren Zoos ist er nicht allzu oft zu sehen. Körperbau und KörperfunktionenMit einer Gesamtlänge von 38-39 cm, wovon 19-22 cm auf den Schwanz entfallen, einer Flügellänge von 20-22 cm und einem Gewicht von ca. 250 g ist der Gelbnackenara noch etwas kleiner als der Marakana. Die Grundfärbung des Gefieders ist grün. Scheitel und Wangen sind bräunlich-schwarz, der Hinterkopf ist bläulich. Auffällig ist das namengebende gelbe Nackenband, das beim Männchen breiter ist als beim Weibchen. Schwungfedern, Handdecken und Schwanzunterseite sind blau, Die Flügelunterseiten sind oliv-gelb Der Schnabel ist grau-schwarz, zur Spitze hin hornfarben, die Iris orangerot. Die nackten Gesichtspartien sind cremefarben, die Füße gelblich. Jungvögel sind heller und haben ein schmaleres Nackenband und eine dunkelbraune Iris [4; 5; 7; 9; 10]. VerbreitungTropisches und subtropisches Südamerika: Argentinien, Brasilien, Bolivien, Paraguay [1]. Lebensraum und LebensweiseDer Goldnackenara besiedelt trockene oder feuchte Wälder und Savannen wie Cerrado oder Chaco in Höhenlagen bis 600 m, gerne in Wassernähe. Es sind auch Sichtungen in bis zu 2'000 m Höhe bekannt. Früher war er außerhalb der Brutzeit in großen Schwärmen anzutreffen, heute lebt er meist paarweise oder in kleinen Gruppen. Die Nahrung besteht aus Palmfrüchten, Feigen und anderen Früchten, Samen und Knospen, und es können Mais- und Getreidefelder geplündert werden. Genistet wird in Baumhöhlen hoch über dem Boden. Die Gelege bestehen aus 2-3(-4) Eiern, die während etwa 26 (23-28) Tagen bebrütet werden. Die Nestlingszeit dauert etwa 65-70 Tage [1; 5; 8; 9; 10]. Gefährdung und SchutzDer Goldnackenara hat eine weite Verbreitung. Genaue Bestandsangaben fehlen, aber es wird angenommen, dass die Bestände eher wieder zunehmen. Die Art wird deshalb seit 2004, letztmals überprüft 2016, als nicht gefährdet eingestuft (Rote Liste: LEAST CONCERN) [1]. Der internationale Handel ist nach CITES-Anhang II geregelt. Bedeutung für den MenschenDer Goldnackenara wird zur Fleischgewinnung gejagt und für den Tierhandel gefangen bzw. ausgehorstet [1]. Von 1981-1990 meldeten Argentinien die Ausfuhr von 1'554, Bolivien von 8'347, Brasilien von 4 und Paraguay von 7 Wildfängen, danach bis 2020 nur noch Argentinien 30 Stück im Jahr 2003. Von 1981-2020 wurden weltweit Exporte von 13'765 Nachzuchtvögeln erfasst, von denen 12'365 aus Südafrika stammten [3]. HaltungDie Welterstzucht gelang 1968 im Bush Gardens in Tampa FL, die deutsche Erstzucht im Vogelpark Walsrode im Jahr 1976 [8; 10]. Das nachgewiesene Höchstalter in Menschenobhut wird mit 25 Jahren angegeben, andere Quellen geben eine maximale Lebenserwartung von 30-40 bzw. von 50 Jahren an [2]. Haltung in europäischen Zoos: Die Art wird in weniger als 20 Zoos gezeigt, von denen sich einzelne im deutschsprachigen Raum befinden. Für Details siehe Zootierliste. Mindestanforderungen an Gehege: Nach Papageiengutachten des BMELF von 1995 ist für die Haltung eines Paars oder ausnahmsweise eines Einzelvogels eine Voliere mit einer Fläche von 4 x 2 m und einer Höhe von 2 m erforderlich, ferner ein Schutzraum mit einer Grundfläche von 2 m². Für jedes weitere Paar sind die Grundflächen um 50% zu erweitern. Nach Schweizerischer Tierschutzverordnung (Stand 1.2.2022) sind Goldnackaras mindestens paarweise zu halten. Für ein Paar ist ein Käfig mit Badegelegenheit, einer Grundfläche von 0.7 m² und einer Höhe von 120 cm vorgeschrieben, für jedes weitere Tier ist die Grundfläche um 0.1 m² zu erweitern. Dies ist zweifellos für Goldnackenaras nicht adäquat. Die 2. Tierhaltungsverordnung Österreichs (Stand 2022) schreibt für die Haltung eines Paars oder ausnahmsweise eines Einzelvogels eine Voliere mit einer Grundfläche von 4 x 2 m Fläche und einer Höhe von 3 m sowie einen Schutzraum von 2 m² / 2 m Höhe mit einer Mindesttemperatur von 10°C vor. Je weiteres Paar sind die Flächen um 50% zu erweitern. Taxonomie und NomenklaturDer Goldnackenara wurde 1853 von dem amerikanischen Ornithologen John CASSIN unter dem heute noch vielfach gebräuchlichen Namen Ara auricollis erstmals wissenschaftlich beschrieben. In den 1990er-Jahren erfolgte eine Umteilung erst in die Gattung Propyrrhura und danach in die heute gültige, 1857 von Prinz Charles Lucien BONAPARTE, einem Neffen von Kaiser Napoléon Bonaparte, eingeführte Gattung Primolius. Die Art ist monotypisch, sie bildet eine Superspezies mit P. maracana und P. couloni [1; 5; 6; 10]. |
Literatur und Internetquellen
- BIRDLIFE INTERNATIONAL (2016). Primolius auricollis. The IUCN Red List of Threatened Species 2016: e.T22685628A93081914. https://www.iucnredlist.org/species/22685628/93081914 . Downloaded on 12 December 2021.
- PSITTACOLOGY
- CITES TRADE DATA BASE
- DE GRAHL, W. (1979/82)
- DEL HOYO, J., ELLIOTT, A. et al. (eds., 1992-2013)
- DEL HOYO, J., COLLAR, N., CHRISTIE, D.A., ELLIOTT, A. & FISHPOOL L.D.C. (2014)
- FORSHAW, J. M. & COOPER, W. T. (1981)
- GRUMMT, W. & STREHLOW, H. (2009)
- LANTERMANN, W. (1984)
- LEPPERHOFF, L. (2004)
Zurück zu Übersicht Papageienvögel
Weiter zu Weiter zu Rotrückenara (Primolius maracana)
Rotbugara
Ordnung: Papageienvögel (PSITTACIFORMES)
Familie: Echte Papageien (Psittacidae)
Unterfamilie: Eigentliche Papageien (Psittacinae)
Tribus: Neuweltpapageien (Arini)

Rotbugara
Ara severus • The Chestnut-fronted Macaw • L'ara vert ou ara sévère
- Körperbau und Körperfunktionen
- Verbreitung
- Lebensraum und Lebensweise
- Gefährdung und Schutz
- Bedeutung für den Menschen
- Haltung
- Taxonomie und Nomenklatur
- Literatur und Internetquellen
|
Weitere Bilder auf BioLib.czStimme auf XENO-CANTO |
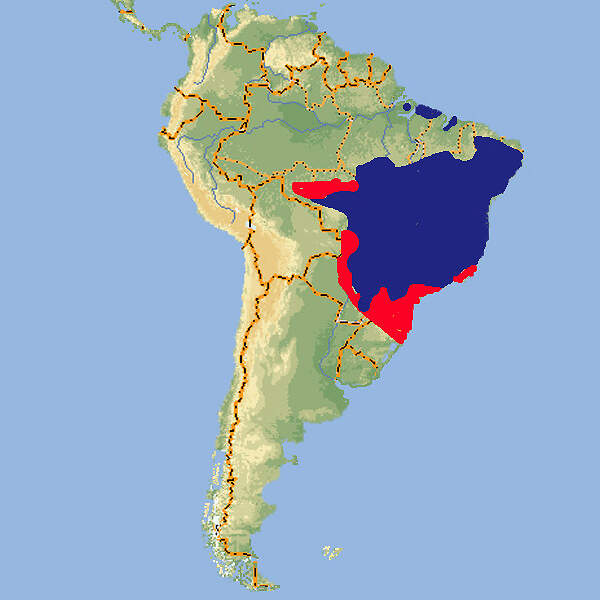
Der Rotbugnara ist der kleinste Vertreter der Gattung Ara im engeren Sinn. Er hat eine weite Verbreitung im tropischen Südamerika, sodass er trotz unbekannter Bestandsgröße und mutmaßlich negativem Bestandstrend als nicht gefährdet gilt. In unseren Zoos ist er nicht häufig zu sehen. Körperbau und KörperfunktionenMit einer Gesamtlänge von 46-48 cm, wovon 20-24 cm auf den Schwanz entfallen, einer Flügellänge von 22-25 cm und einem Gewicht von ca. 350-410 g ist der Rotbugara der kleinste Vertreter des Gattung Ara im engeren Sinn. Die Grundfärbung des Gefieders ist grün. Die Stirn ist dunkelbraun, die Kopfoberseite bläulich. Die Außenfahnen der Handschwingen und -decken sind blau. Auffälligstes Merkmal ist die Rotfärbung von Flügelbug, Flüglspiegel und kleinen Unterflügeldecken. Der Schnabel ist dunkelgrau, die Iris gelb. Die nackten Gesichtspartien sind weißlich, die Füße grau. Jungvögel sind matter gefärbt und haben eine schwarze Iris [4; 5; 7; 9; 10].] VerbreitungTropisches Südamerika: Bolivien, Brasilien, Ekuador, Französisch-Guyana, Guyana, Kolumbien, Panama, Peru, Surinam, Venezuela. Eingeführte Population in den USA [1]. Lebensraum und LebensweiseDer Rotbugara besiedelt Tiefland-Regenwald, Galeriewälder, Sekundärwälder, Sumpfgebiete, Buriti-Palmenhaine (Mauritia flexuosa) und die Chapparales und Llanos genannten Savannen im Norden Südamerikas vom Tiefland bis auf eine Höhe von 800, stellenweise bis 1'500 m. Außerhalb der Brutzeit lebt er in kleinen Gruppen, gelegentlich in größeren Ansammlungen. Er ernährt sich von Samen, Früchten, Blättern, Blüten und der Rinde von Seidenbäumen (Ceiba pentandra). Genistet wird in Höhlen in alten Laubbäumen oder in abgstorbenen Palmen. Die Gelege bestehen aus 3-4 (2-5) Eiern, die während 26-27 (25-28) Tagen bebrütet werden. Die Nestlingszeit dauert etwa 56-63 Tage, mit 4-5 Monaten sind die Jungen selbständig [1; 5; 8; 10]. Gefährdung und SchutzDer Rotbugara hat eine sehr weite, zehn Länder umfassende Verbreitunmg im tropischen Südamerika. Die Größe seines Bestand unbekannt. Es wird angenommen, dass der Populationstrend nach unten zeigt, die vermutete Abnahme gibt jedoch noch keinen Anlass zu Besorgnis. Die Art wird deshalb seit 2004, letztmals überprüft 2016, als nicht-gefährdet eingestuft (Rote Liste: LEAST CONCERN) [1]. Der internationale Handel ist nach CITES-Anhang II geregelt. Bedeutung für den MenschenDer Rotbugara wird zur Fleischgewinnung bejagt und in Surinam in geringem Ausmaß für den internationalen Vogelmarkt gefangen bzw. ausgehorstet [1]. Von 1981-2019 meldeten Ursprungsländer die Ausfuhr von 11'104 Wildfängen. 6'415 wurden bis 1984 von Bolivien ausgeführt, 4'644 von Surinam, dem einzigen Land, das bis in die Gegenwart die Ausfuhr kleiner Kontingente bewilligt. Von 1981-2020 wurden weltweit Exporte von 9'763 Nachzuchtvögeln erfasst, von denen 8'012 aus Südafrika stammten [3]. HaltungDie Welterstzucht gelang im 1940 im San Diego Zoo [8; 10]. Das Höchstalter in Menschenobhut wird mit 39.7 Jahren angegeben [2]. Haltung in europäischen Zoos: Die Art wird in gegen 30 Zoos gezeigt, von denen sich etwa ein Drittel im deutschsprachigen Raum befinden. Für Details siehe Zootierliste. Mindestanforderungen an Gehege: Nach Papageiengutachten des BMELF von 1995 ist für die Haltung eines Paars oder ausnahmsweise eines Einzelvogels eine Voliere mit einer Fläche von 4 x 2 m und einer Höhe von 2 m erforderlich, ferner ein Schutzraum mit einer Grundfläche von 2 m². Für jedes weitere Paar sind die Grundflächen um 50% zu erweitern. Nach Schweizerischer Tierschutzverordnung (Stand 1.2.2022) sind Rotbugaras mindestens paarweise zu halten. Für ein Paar ist ein Käfig mit Badegelegenheit, einer Grundfläche von 0.7 m² und einer Höhe von 120 cm vorgeschrieben, für jedes weitere Tier ist die Grundfläche um 0.1 m² zu erweitern. Dies ist zweifellos für Rotbugaras nicht adäquat. Die 2. Tierhaltungsverordnung Österreichs (Stand 2022) schreibt für die Haltung eines Paars oder ausnahmsweise eines Einzelvogels eine Voliere mit einer Grundfläche von 4 x 2 m Fläche und einer Höhe von 3 m sowie einen Schutzraum von 2 m² / 2 m Höhe mit einer Mindesttemperatur von 10°C vor. Je weiteres Paar sind die Flächen um 50% zu erweitern. Taxonomie und NomenklaturDer Rotbugara wurde 1758 von Carl von LINNÉ als "Psittacus severus" erstmals wissenschaftlich beschrieben. Die heute gültige Gattungsbezeichnung Ara wurde 1799 vom französischen Naturforscher Graf Bernard-Germain-Étienne de LACÉPÈDE eingeführt, womit die Art bis vor Kurzem Ara severa hieß. Nachdem in einer 2013 veröffentlichten Checkliste festgestellt wurde, dass das grammatikalische Geschlecht von Ara männlich sei, wurde der Artname auf severus geändert. In der Literatur und auf Zoo-Namensschildern finden sich beide Bezeichnungen. Es werden oft zwei Unterarten differenziert: Ara s. severus und dsie im Mittel etwas größere Ara s. castaneifrons, es dürfte sich aber um eine Kline handeln [5; 6]. |
Literatur und Internetquellen
- BIRDLIFE INTERNATIONAL (2018). Ara severus. The IUCN Red List of Threatened Species 2018: e.T22685577A130103061. https://www.iucnredlist.org/species/22685577/130103061 .Downloaded on 10 December 2021.
- PSITTACOLOGY
- CITES TRADE DATA BASE
- DE GRAHL, W. (1979/82)
- DEL HOYO, J., ELLIOTT, A. et al. (eds., 1992-2013)
- DEL HOYO, J., COLLAR, N., CHRISTIE, D.A., ELLIOTT, A. & FISHPOOL L.D.C. (2014)
- FORSHAW, J. M. & COOPER, W. T. (1981)
- GRUMMT, W. & STREHLOW, H. (2009)
- LANTERMANN, W. (1984)
- LEPPERHOFF, L. (2004)
Zurück zu Übersicht Papageienvögel
Weiter zu Zwergara (Ara = Diopsittaca nobilis)
Rotrückenara, Marakana
Ordnung: Papageienvögel (PSITTACIFORMES)
Familie: Echte Papageien (Psittacidae)
Unterfamilie: Eigentliche Papageien (Psittacinae)
Tribus: Neuweltpapageien (Arini)

Rotrückenara oder Marakana
Ara = Primolius maracana • The Bluewinged, or Illiger's, Macaw • L'ara maracana
- Körperbau und Körperfunktionen
- Verbreitung
- Lebensraum und Lebensweise
- Gefährdung und Schutz
- Bedeutung für den Menschen
- Haltung
- Taxonomie und Nomenklatur
- Literatur und Internetquellen
|
Weitere Bilder auf BioLib.czStimme auf XENO-CANTO |
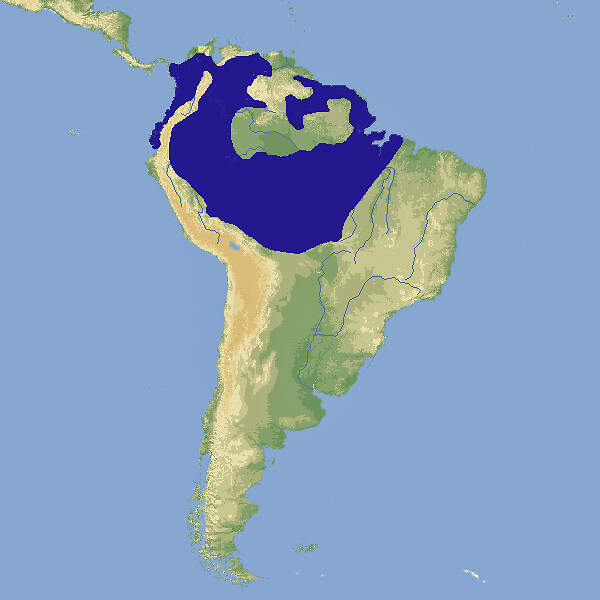
Der Rotrückenara oder Marakana ist ein kleiner Vertreter der Aras. In seinem immer noch relativ weiten, aber schrumpfenden Verbreitungsgebiet im tropischen Südamerika nehmen die Bestände ab, weshalb er als potenziell gefährdet gilt. In unseren Zoos ist er nicht allzu häufig zu sehen. Körperbau und KörperfunktionenMit einer Gesamtlänge von 42-43 cm, wovon 18-22 cm auf den Schwanz entfallen, einer Flügellänge von 20-23 cm und einem Gewicht von ca. 250-290 g gehört Primolius maracana zu den kleinen Aras. Die Grundfärbung des Gefieders ist olivgrün. Die Stirn, der hintere Teil des Rückens und ein Bauchfleck sind rot. Die Flügelunterseiten sind gelblich-grün und gehen ins Blaue über. Auch Oberkopf und die Oberseite des Schwanzendes sind bläulich. Der Schnabel ist schwarz, die Iris braun. Die nackten Gesichtspartien sind weißlich, die Füße hell fleischfarben, bei Jungvögeln grau-schwarz [4; 5; 7; 8; 10]. VerbreitungTropisches Südamerika: Brasilien (ursprünglich Pernambuco, Piauí, Maranhão, Pará, Tocantins, Goiás, Mato Grosso, Mato Grosso do Sul, Minas Gerais, Bahia, Espírito Santo, São Paulo, Paraná, Santa Catarina, Rio de Janeiro and Rio Grande do Sul), wobei das Areal im Süden und Westen geschrumpft ist. In Paraguay kommt die Art nur noch marginal vor, ebenso in Argentinien, wenn überhaupt [1]. Lebensraum und LebensweiseDer Marakana besiedelt Atlantischen Regenwald, Galeriewälder, Palmenhaine und die Savannen von Cerrado, und Caatinga vom Tiefland bis auf eine Höhe von 1'000 m. Außerhalb der Brutzeit lebt er in kleinen Gruppen. Über die Ernährung in der Wildbahn ist wenig bekannt, u.a. werden die Samen des eingeführten Paternosterbaums (Melia azedarach) gefressen und es können Mais- und Getreidefelder geplündert werden. Genistet wird meistens einzelpaarweise in Höhlen in alten Bäumen. Die Gelege bestehen aus 3-4(-5) Eiern, die während 26-27 (21-28) Tagen bebrütet werden. Die Nestlingszeit dauert etwa 70-90 Tage, mit 5-6 Monaten sind die Jungen selbständig [1; 5; 9; 10]. Gefährdung und SchutzDer Rotrückenara hat eine relativ weite Verbreitung, aber der Bestand ist nicht sehr groß und nimmt wegen Lebensraumverlusts und illegalen Vogelhandels tendenziell ab. Die Art wird deshalb seit 2004, letztmals überprüft 2016, als potenziell gefährdet eingestuft (Rote Liste: NEAR THREATENED). Zuvor galt sie seit 1994 als gefährdet [1]. Der internationale Handel ist nach CITES-Anhang I eingeschränkt. Bedeutung für den MenschenVon 1981-1990 meldeten verschiedene südamerikanische Länder die Ausfuhr von 107 Wildfängen (die vermutlich zumindest teilweise illegal aus Brasilien bezogen worden waren), danach keine mehr. Von 1981-2019 wurden weltweit Exporte von 601 Nachzuchtvögeln erfasst, von denen etwa ein Drittel aus Südafrika stammten [3]. HaltungDie Welterstzucht gelang im Londoner Zoo, wo von 1931-1938 insgesamt 10 Jungvögel schlüpften [9; 10]. Das Höchstalter in Menschenobhut wird mit 31 Jahren angegeben, erreicht von einem Vogel im Londoner Zoo [2]. Haltung in europäischen Zoos: Die Art wird in über 40 Zoos gezeigt, von denen sich etwa 40% im deutschsprachigen Raum befinden. Für Details siehe Zootierliste. Mindestanforderungen an Gehege: Nach Papageiengutachten des BMELF von 1995 ist für die Haltung eines Paars oder ausnahmsweise eines Einzelvogels eine Voliere mit einer Fläche von 4 x 2 m und einer Höhe von 2 m erforderlich, ferner ein Schutzraum mit einer Grundfläche von 2 m². Für jedes weitere Paar sind die Grundflächen um 50% zu erweitern. Nach Schweizerischer Tierschutzverordnung (Stand 1.2.2022) sind Rotrückenaras mindestens paarweise zu halten. Für ein Paar ist ein Käfig mit Badegelegenheit, einer Grundfläche von 0.7 m² und einer Höhe von 120 cm vorgeschrieben, für jedes weitere Tier ist die Grundfläche um 0.1 m² zu erweitern. Dies ist zweifellos für Rotrückenaras nicht adäquat. Die 2. Tierhaltungsverordnung Österreichs (Stand 2022) schreibt für die Haltung eines Paars oder ausnahmsweise eines Einzelvogels eine Voliere mit einer Grundfläche von 4 x 2 m Fläche und einer Höhe von 3 m sowie einen Schutzraum von 2 m² / 2 m Höhe mit einer Mindesttemperatur von 10°C vor. Je weiteres Paar sind die Flächen um 50% zu erweitern. Taxonomie und NomenklaturDer Rotrückenara wurde 1816 von dem französischen Ornithologen Louis Jean Pierre VIEILLOT als "Macrocercus maracana" erstmals wissenschaftlich beschrieben. Später wurde er der 1799 von dem französischen Naturforscher Bernard Germain de LACÉPÈDE aufgestellten Gattung Ara zugeordnet. In den 1990er-Jahren erfolgte eine Umteilung erst in die Gattung Propyrrhura und danach in die heute gültige, 1857 von Prinz Charles Lucien BONAPARTE, einem Neffen von Kaiser Napoléon Bonaparte, eingeführte Gattung Primolius. Die Bezeichnung "Ara maracana" war aber bis in die jüngste Zeit noch anzutreffen. Die Art ist monotypisch, sie bildet eine Superspezies mit P. auricollis und P. couloni [1; 5; 6; 10]. |
Literatur und Internetquellen
- BIRDLIFE INTERNATIONAL (2016). Primolius maracana. The IUCN Red List of Threatened Species 2016: e.T22685606A93081612. https://dx.doi.org/10.2305/IUCN.UK.2016-3.RLTS.T22685606A93081612.en. Downloaded on 15 June 2021.
- BROUWER, K., JONES, M. L., KING, C. E. und SCHIFTER, H. (2000)
- CITES TRADE DATA BASE
- DE GRAHL, W. (1979/82)
- DEL HOYO, J., ELLIOTT, A. et al. (eds., 1992-2013)
- DEL HOYO, J., COLLAR, N., CHRISTIE, D.A., ELLIOTT, A. & FISHPOOL L.D.C. (2014)
- FORSHAW, J. M. & COOPER, W. T. (1981)
- GRUMMT, W. & STREHLOW, H. (2009)
- LANTERMANN, W. (1984)
- LEPPERHOFF, L. (2004)
Zurück zu Übersicht Papageienvögel
MÜLLER, D. (2010)
Life expectancy of wild ruminants in zoological institutions.
Vet. med. Diss.
Universität Zürich, Vetsuisse Fakultät.
Volltext: https://www.zora.uzh.ch/id/eprint/54248/1/DM_Dissertation_komplett_110114.pdf
Zusammenfassung:
In der vorliegenden Studie wurden Daten des “International Species Information Systems” verwendet, um die relative Lebenserwartung (rLE;durchschnittliche Lebenserwartung einer Art als Proportion des Altersrekords) von 78 Wiederkäuerartenin Gefangenschaft zu ermitteln. Dieser Wert reflektiert den jeweiligen Haltungserfolg. Die vergleichendeAnalyse der rLE verschiedener Arten ermöglichte es, biologische Merkmale zu identifizieren, die einenEinfluss auf die Lebenserwartung haben. So korrelierte der rLE adulter Weibchen positiv mit dem Anteilan Gras in der natürlichen Äsung einer Art (2 = 8.28, p=0.004). Dies bestätigt die Erfahrung aus derZoohaltung, dass Laubäser im Vergleich zu Gras- und Mischäsern mehr fütterungsbedingte Problemezeigen. Höhere rLE erreichten adulte Männchen monogamer Arten (2 = 9.92, p=0.007). Dies weistdarauf hin, dass Arten, die daran adaptiert sind, ein Harem oder ein Revier zu verteidigen, intrinsischem,physiologischen Stress ausgesetzt sind, selbst wenn sie nicht in Gesellschaft anderer Männchen gehaltenwerden. Zudem war der rLE beider Geschlechter höher bei Arten, für die ein internationales Zuchtbuchgeführt wird (Weibchen: 2 = 8.80, p=0.003, Männchen: 2 = 5.52, p=0.019). Dieses Ergebnis zeigt,dass sich ex-situ Zuchtprogramme auch positiv auf den Haltungserfolg einer Art auswirken. Sollten dieErgebnisse dieser Studie in den Haltungsregimen von Wildwiederkäuern berücksichtigt werden, könntederen Haltungserfolg weiter verbessert werden.
müller-biblio
LAMP, B. (2009)
Entwicklung der Zootiermedizin im deutschsprachigen Raum.
532 Seiten.
Med. vet. Diss. Uni Giessen.
Volltext:
http://geb.uni-giessen.de/geb/volltexte/2009/7307/pdf/LampBenjamin_2009_11_04.pdf
lamp-biblio
DOLLINGER, P. (Hrsg., 2016)
Akzeptanz und Relevanz der Zoologischen Gärten.
Verhandlungsbericht des V. Rigi-Symposiums, gemeinsam organisiert von ZOOSchweiz, OZO und Zoos in Bayern mit Unterstützing von WAZA, Goldau-Rigi, 14.-16. Januar 2016. Zoo Office Bern. 74 Seiten.
Editorial:
Als der Zoologische Garten Basel im Jahr 2014 der Öffentlichkeit seine Absicht kund tat, ausserhalb des aktuellen Zoogeländes ein mit privaten Mitteln finanziertes Ozeanium zu bauen, meldete sich sogleich eine am Genfersee domizilierte Umweltorganisation zu Wort, die bemängelte, das Projekt des Basler Zoos sei ein «Konzept des vergangenen Jahrhunderts», das sie verhindern und mit einem eigenen Projekt ersetzen wolle. Dieses Alternativprojekt unter den Namen «Vision Nemo» wurde in der Folge entwickelt und der Öffentlichkeit vorgestellt. Es handelte sich dabei um eine Art interaktives Kino, einen «revolutionären» Erlebnispark in dem «sinnliche, interaktive Reisen durch bewegte, bewegende und dreidimensionale Bild- und Klangwelten» ermöglicht werden sollen. Die Kosten für dieses Gegenprojekt sollten sich auf 80 Mio. CHF belaufen, welche die Initianten von Basler Mäzenen zu erhalten hofften. Um ihrer Idee zum Erfolg zu verhelfen, wollten sie auch vor demokratischen Mitteln nicht Halt machen und drohten indirekt mit einer Volksabstimmung, sollte sich beim Zoo kein Umdenken einstellen.
Der Zoo Basel liess sich von diesen Aktivitäten, denen sich auch einige lokale Projektkritiker angeschlossen hatten, nicht beirren. Unter dem Vorsitz des ehemaligen Basler Regierungsrats und Präsidenten von Swiss Olympic JÖRG SCHILD wurde ein Patronatskomitee gebildet, dem namhafte Persönlichkeiten aus Politik, Wirtschaft und Gesellschaft angehörten. Binnen zweier Jahre konnten über 50% der veranschlagten Bausumme durch Spenden gesichert werden. Die Teilnahme am World Oceans Day wurde zur festen Einrichtung. Ab 2015 wurde ein Projekt zur nachhaltigen Gewinnung von Badeschwämmen auf Sansibar unterstützt, es folgte die Unterstützung eines Lachs-Forschungsprojekts der Universität Basel [6], und 2016 wurde mit der FONDATION PRINCE ALBERT II DE MONACO eine Partnerschaftskonvention unterzeichnet mit der das gemeinsame strategische Engagement zugunsten der Umwelt mit Fokus auf maritime ökologische Anliegen manifestiert wurde. Im Februar 2016 wurden die Entwürfe für den Bebauungsplan, die Zonenänderung, die Zuweisung der Lärmempfindlichkeitsstufe und die Änderung der Bau- und Strassenlinien öffentlich aufgelegt. Es gab zwei Einsprachen, eine gegen das Projekt an sich – von der eingangs erwähnten Organisation, die ihre Legitimation mit dem Verbandsbeschwerderecht gemäss Natur- und Heimatschutzgesetz begründete – und eine weitere, die sich lediglich gegen die geplante Verkehrsführung im Projektperimeter richtete.
Diese Beispiel zeigt mit aller Deutlichkeit, in welcher Situation sich die Zoos heute befinden: Einerseits können sie sich des ungebrochenen Zuspruchs des allgemeinen Publikums erfreuen und sich auf einen soliden Kreis von Freunden und Förderern verlassen, die sie auch finanziell unterstützen, andererseits sehen sie sich der Kritik zoofeindlicher Organisationen ausgesetzt, die, so unbegründet sie im Einzelfall auch sein mag, ein erhebliches Medieninteresse erzeugt und die Zoos zwingt, sich zu verteidigen.
Dies war der Grund, für das diesjährige Rigi-Symposium das Thema «Akzeptanz und Relevanz der Zoos» zu wählen.
Eingeleitet wurden die Vorträge durch den Religionswissenschafter und Ägyptologen MIKE STOLL, der zum Schluss kam, dass Zoos nicht nur relevant seien, weil sie die Aufgaben erfüllten, die sie sich selbst gestellt hatten oder die ihnen heute von der Zoo-Richtlinie der EU überbunden werden, sondern auch weil sie allein durch ihre Existenz unsere Kultur aktiv mitgestalten und in uns selbst das Verständnis für die Schöpfung insgesamt fördern.
Der frühere und der gegenwärtige Geschäftsführer des Verbands der Zoologischen Gärten (VdZ) gingen der Frage nach, wie sich der VdZ aufstellt, damit seine Zoos auch in Zukunft noch akzeptiert und relevant sind. PETER DOLLINGER analysierte die Situation, wie sie sich in den letzten Jahren präsentiert hatte und zeigte auf, was der VdZ bis anhin unternommen hatte, um den Anforderungen des 21. Jahrhunderts Genüge zu tun, und VOLKER HOMES stellte dar, was in Zukunft geplant ist.
Der Präsident des VdZ, THEO PAGEL, erläuterte, welchen gesetzlichen Auftrag die Zoos in der europäischen Union und namentlich in Deutschland und Österreich haben und unter welchen oftmals einschränkenden Rahmenbedingungen sie arbeiten müssen.
MARKUS GUSSET vom Weltverband der Zoos und Aquarien ging der Frage nach, wohin der «animal welfare» Trend in unserer Gesellschaft führt und erläuterte dies mit Umfrage-Ergebnissen eines schweizerischen Magazins.
PETER SCHMID, ehemaliger Erziehungsdirektor des Kantons Basel-Landschaft diskutierte, ob die Haltung von Wildtieren zu edukativen Zwecken unter ethischen Gesichtspunkten erlaubt sei, eine Frage, die er bejahte, sofern gewisse Rahmenbedingungen erfüllt werden.
CHRISTIAN LAESSER, Professor an der Hochschule St. Gallen, referierte darüber, welche Relevanz Zoos für den Tourismus haben, wobei er einerseits bemängelte, dass es wenig systematische Untersuchungen gebe, andererseits aber auch Vorschläge machte, wie sich Zoos in touristischer Hinsicht weiterentwickeln könnten.
Und schliesslich beendete der jüngste Zoodirektor Deutschlands, DENNIS MÜLLER aus Halle, den Reigen damit, dass er seine Vision vorstellte, wie ein Zoo im Jahr 2050 aussehen sollte.
Die vom Moderator KURT AESCHBACHER des Schweizer Fernsehens exzellent zusammengefassten Präsentationen der Arbeitsgruppen resultierten, trotz sehr unterschiedlicher Vorgehensweisen, in einem Massnahmenkatalog, den wir allen Zoos ans Herz legen.
Inhalt (Downloads)
| Verfasser | Titel | Downloads Links |
| DOLLINGER, P. | Editorial | HTML |
| - | Teilnehmer | |
| - | Medientext | |
| - | Ergebnisse | |
| AESCHBACHER, K. | Ziele und Ablauf des Symposiums | |
| STOLL, M. | Keynote: Ist ein Zoo heute noch von Relevanz? | |
| DOLLINGER, P. | Wie sich der VdZ-aufstellt, damit seine Zoos auch in Zukunft noch akzeptiert und relevant sind. Teil 1: Gegenwart |
|
| HOMES, V. | Wie sich der VdZ-aufstellt, damit seine Zoos auch in Zukunft noch akzeptiert und relevant sind. - Teil 2: Gegenwart |
|
| PAGEL, T. | Der gesetzliche Auftrag der Zoos | |
| GUSSET, M. | Wohin führt der «animal welfare» Trend in unserer Gesellschaft? | |
| SCHMID, P. | Ist Tierhaltung zu edukativen Zwecken erlaubt? | |
| LAESSER, Ch. | Welche Relevanz haben Zoos für den Tourismus? | |
| MÜLLER, D. | Der Zoo im Jahr 2050 | |
| ANHANG | Beitrag zooschweiz an Finanzierung der Biodiversität | |
| ANHANG | Anforderungen an Zoos | |
| ANHANG | Beispiele Artenschutz, Forschung, Umweltpädagogik | |
| ANHANG | Das Leitbild 2016 des VdZ | |
| ANHANG | Das Faktenblatt 2016 des VdZ | |
| Ganzer Band |
PDF |
dollinger-biblio