REMPFLER, T. (2013)
Raum-Zeit-System des Rothirsches im Wildnispark Zürich und dessen Umgebung.
Masterarbeit
55 Seiten
Institut Umwelt und Natürliche Ressourcen der ZHAW, Wädenswil
Betreuung: Prof. Dr. sc. ETH R.E. Graf, Dozent Forschungsgruppe Wildtiermanagement WILMA
in Zusammenarbept mit Wildnispark Zürich / Wildpark Langenberg (Direktor: Ch. Stauffer)
Zusammenfassung:
Der Rothirsch Cervus elaphus L. war im 19. Jahrhundert in der Schweiz weitgehend ausgerottet. Ausgehend von den Alpen und Voralpen breitet er sich heute aus und besiedelt auch das Mitteland wieder. Im Wildnispark Zürich (WPZ) ist er seit ca. 20 Jahren vermehrt anzutreffen. Ziel dieser Studie war es, die Verbteitung des Rothirsches im WPZ und dessen Umgebung zeitlich und räumlich zu beschreiben. Weiter waren Bestandesgrösse, Bestandeszusammensetzung und Wanderrouten aufzuführen.
Das Untersuchungsgebiet umgab den WPZ grossräumig und erstreckte sich von der Stadt Zürich im Osten bis nach Lachen (Kanton Schwyz), und im Süden bis zum Rossberg. Die Datenerhebung erfolgte im gesamten Perimeter über Befragungen von Fachkundigen zu Hirschnachweisen, im Sihlwald zusätzlich über ein Fotofallenmonitoring. Als Nachweise galten jagdliche Abschüsse, Fallwild, eindeutig zuordnungsbare Fegestellen, Losung, Schälschäden, Suhlen, Trittsiegel, Sichtbeobachtungen und Fotos. Das Monitoring generierte mit 19 Fotofallen Daten von Ende November 2012 bis Mitte Mai 2013. Die Kantonalen Jagd- und Fallwildstatistiken aus den Jahren 1999 bis 2012 ergänzten die Datenaufnahme. Ein übernommenes GIS-gestütztes Habitatmodell, das auf Expertenmeinungen beruhte, stellte die erhobenen Informationen in einen räumlichen Bezug.
Im Fotofallenmonitoring waren ein Achtender und zwei Spiesser eindeutig zu identifizieren. Unter Berücksichtigung der Nicht-Identifizierbarkeit weiblicher Individuen und Jungtiere sowie teilweise unzureichender Bildqualität, schätzte ich den Bestand aufgrund der Fotos auf fünf bis zwölf Individuen.
Aus den Befragungen sowie den Jagd- und Fallwildstatistiken ging hervor, dass die Hirschnachweise nach einem Zwischenhoch in den 1980er Jahren wieder abnahmen und erst seit dem Jahr 2010 anhaltend zunehmen. Als Hauptverbreitungsgebiete stellten sich der Kanton Schwyz, der Höhronen, der Morgartenberg, die Gebiete südwestlich des Aegerisees inkl. Hürital, der Zugerberg, die Baarburg und die Albiskette, insbesondere der Sihlwald heraus.
Alle diese Gebiete bewertete das Habitatmodell mit für den Hirsch geeigneten Bedingungen. Folglich liegt die Erwartung nahe, dass auch weitere, gemäss Modell günstige Lebensräume vom Rothirsch besiedelt werden. Diese muss aber nicht zwingend erfüllt werden, da das Modell zwar die Landschaft bewertet, aber z.B. unterbrochene Ausbreitungsachsen nicht berücksichtigt. Hingegen konnten die Befragten intakte Wanderrouten grob bezeichnen und dabei im Wesentlichen die Hauptverbreitungsgebiete untereinander verbinden. Der Rothirsch kommt im Sihlwald ganzjährig vor, wobei die spärlichen Fotofallennachweise in den Monaten Januar, Februar, April und Mai dafür sprechen, dass der Lebensraum der Hirsche zumindest in diesen Monaten über den Sihlwald hinausreicht.
Die Fotofallen lieferten an 11 der 19 Standorte insgesamt 31 Rothirschnachweise. Aufgrund der Empfindlichkeit des Hirschs gegenüber menschlichen Störungen war zu erwarten, dass im Verhältnis zur Anzahl Fallen innerhalb der Kernzone, in der menschliche Aktivitäten durch Besucherlenkungsmassnahmen reguliert sind, mehr Hirschnachweise gelingen würden als ausserhalb. Das Fotofallenmonitoring hat dies tendenziell bestätigt. Weiter lieferte es ausschliesslich Nachweise zwischen 14:00 Uhr und 06:00 Uhr (Europäische Winterzeit), was auf eine recht ausgeprägte Nachtaktivität hindeutet. Auch dieses Verhalten kann als Anpassung an die menschlichen Aktivitäten interpretiert werden.
Für detailliertere Erkenntnisse zum Raum-Zeit-System des Rothirsches im Wildnispark Zürich sind zusätzliche Untersuchungen nötig. Zum einen dürfte das Fortführen des Fotofallenmonitorings während eines weiteren Jahres einen vertieften Einblick in saisonale Unterschiede ermöglichen. Telemetriestudien sind darüber hinaus geeignet, das Verhalten von Wildtieren auf einer feineren Skala zu beschreiben. Weiter werden daraus exakte Wanderrouten sichtbar.
Genetische Methoden werden zur Bestandesschätzung (Minisatelliten), aber auch zur Identifizierung von Populationen eingesetzt (Microsatelliten und mitochondriale DNA), woraus zu schliessen wäre, mit welchen anderen Populationen die Hirsche im Sihlwald in Verbindung stehen oder standen, und wo sie ursprünglich herkamen.
Abstract:
Red deer Cervus elaphus L. were largely extinct in Switzerland by the 19th century. However, the species has been dispersing from the Alps and Alpine foothills in recent times and is currently recolonising the Swiss Midlands. In the Wildnispark Zürich (WPZ), their numbers have been increasing for approximately 20 years. The aim of this study was to describe the temporal and spatial distribution of red deer in the WPZ and its surroundings. In addition, population size, the composition of the population and dispersal routes were investigated.
Though centred around WPZ, the study area extended from Zurich in the west to Lachen in the east (canton Schwyz), and to the Rossberg in the south. Interviews were conducted with experts regarding evidence of deer presence over the whole study area. Shot animals, damage on trees caused by antlers, scats, peeled bark, wallows, tracks, direct observations and photographs were regarded as evidence of presence. In addition I conducted a monitoring program using camera traps in the Sihlwald. Nineteen camera traps provided data from the end of November 2012 until mid May 2013. Cantonal hunting statistics from 1999 to 2012 completed the dataset. An existing habitat model in GIS based on expert opinion enabled extrapolation of spatial information.
The camera traps took pictures of one eightpointer and two male yearlings. Considering that females and calves could not be individually identified, and some images were of insufficient quality, I estimated an absolute abundance of five to twelve individuals.
Interviews and hunting statistics showed a peak in deer presence in the 1980’s. After a decrease in numbers, they have increased continuously since 2010. The main areas of distribution are Canton Schwyz, Höhronen, Morgartenberg, south-western area of Aegerisee including Hürital, Zugerberg, Baarburg and Albis range, particularly the Sihlwald. The habitat model showed suitable conditions for red deer in all these areas. Therefore, it would be expected that other suitable areas indicated by the model will also be colonised by red deer. However, this may not necessarily be the case since the model judges landscapes but does not take into account interrupted dispersal corridors, for example. By contrast, respondents were able to roughly describe intact migration routes and to connect the main areas of distribution.
In the Sihlwald, red deer show a year-round presence. The fact that only few photos were taken by the camera traps in January, February, April and May indicates that homeranges of deer extend beyond the Sihlwald at least during these months. Camera trapping provided 31 photos of red deer in 11 out of 19 locations. Red deer react sensitively to human disturbance. Therefore, it was expected that - in proportion to the number of traps - traps inside the core area would provide more photos of the animals than cameras outside, because human activities are regulated inside this area. Camera trapping has confirmed this trend. Furthermore, photos of red deer were taken exclusively between 02:00 p.m. and 06:00 a.m. (European wintertime), which indicates a typically nocturnal lifestyle.
This behaviour can also be interpreted as an adaptation to human activities. Additional studies are necessary to obtain a more detailed insight into spatial and temporal patterns of red deer activity in the WPZ. Continuing camera trapping for another year might give a better insight into seasonal differences. Furthermore, telemetry studies are suitable to describe behaviour at a finer scale. In addition, exact dispersal routes might become visible.
Genetic methods are used to estimate population size (mini-satellites), but also to identify population structure (micro-satellites and mitochondrial DNA). This might permit inferences about connections between populations in and around Sihlwald, and shed light on where these red deer originally came from.
rempfler-biblio
DEL HOYO, J., COLLAR, N., CHRISTIE, D.A., ELLIOTT, A. & FISHPOOL L.D.C. (2014)
HBW and BirdLife International Illustrated Checklist of the Birds of the World
Volume 1: Non-passerines
ISBN-13: 978-84-96553-94-1
Sprache: Englisch
Format: 31 x 24 cm, gebunden
904 S., 357 Bildtafeln, 8'290 Abbildungen von Vogelarten, 4'428 Verbreitungskarten, 34 ganzseitige Landkarten, 2'126 Literaturstellen.
![]()
HBW and BirdLife International Illustrated Checklist of the Birds of the World
Volume 2: Passerines
ISBN-13: 978-84-96553-98-9
Sprache: Englisch
Format: 31 x 24 cm, gebunden
1,013 S., 446 plates, bird illustrations (including 642 new and 1.208 improved) and distrib Bildtafeln, 12'629 Abbildungen von Vogelarten, 6'649 Verbreitungskarten.
![]()
Lynx Edicions in Zusammenarbeit mit BirdLife International.
Verlagstext:
The first ever Illustrated Checklist of the Birds of the World is really two works in one. It is a complete checklist whose taxonomy incorporates the most up-to-date information and an exhaustive methodology (Tobias et al. 2010) in an entirely systematic and consistent way. At the same time, it contains illustrations and distribution maps for every bird species in the world. This includes the original artwork from the HBW series, as well as hundreds of new illustrations, all in two compact volumes.
del hoyo-biblio
BRITO, J. C., MARTÍNEZ-FREIRIA, F., SIERRA, P., SILLERO, N. & TARROSO, P. (2011)
Crocodiles in the Sahara Desert: An Update of Distribution, Habitats and Population Status for Conservation Planning in Mauritania.
PLoS ONE. 6 (2)
Published: February 25, 2011. DOI: 10.1371/journal.pone.0014734
Background
Relict populations of Crocodylus niloticus persist in Chad, Egypt and Mauritania. Although crocodiles were widespread throughout the Sahara until the early 20th century, increased aridity combined with human persecution led to local extinction. Knowledge on distribution, occupied habitats, population size and prey availability is scarce in most populations. This study evaluates the status of Saharan crocodiles and provides new data for Mauritania to assist conservation planning.
Methodology/Principal Findings
A series of surveys in Mauritania detected crocodile presence in 78 localities dispersed across 10 river basins and most tended to be isolated within river basins. Permanent gueltas and seasonal tâmoûrts were the most common occupied habitats. Crocodile encounters ranged from one to more than 20 individuals, but in most localities less than five crocodiles were observed. Larger numbers were observed after the rainy season and during night sampling. Crocodiles were found dead in between water points along dry river-beds suggesting the occurrence of dispersal.
Conclusion/Significance
Research priorities in Chad and Egypt should focus on quantifying population size and pressures exerted on habitats. The present study increased in by 35% the number of known crocodile localities in Mauritania. Gueltas are crucial for the persistence of mountain populations. Oscillations in water availability throughout the year and the small dimensions of gueltas affect biological traits, including activity and body size. Studies are needed to understand adaptation traits of desert populations. Molecular analyses are needed to quantify genetic variability, population sub-structuring and effective population size, and detect the occurrence of gene flow. Monitoring is needed to detect demographical and genetical trends in completely isolated populations. Crocodiles are apparently vulnerable during dispersal events. Awareness campaigns focusing on the vulnerability and relict value of crocodiles should be implemented. Classification of Mauritanian mountains as protected areas should be prioritised.
SHINE, T., BÖHME, W., NICKEL, H., THIES, D. f. & WILMS, T. (2001)
Rediscovery of relict populations of the Nile crocodile Crocodylus niloticus in south-eastern Mauritania, with observations on their natural history.
ORYX 35 (3): 260–262.
Article first published online: 20 DEC 2001 | DOI: 10.1046/j.1365-3008.2001.00187.x
Abstract:
In 1998 and 1999, relict populations of the Nile crocodile Crocodylus niloticus were rediscovered in south-eastern Mauritania, 70 years after the last reports of their existence and 6 years after the IUCN Species Survival Commission listed them as extirpated in that country. Crocodiles were found in four different types of wetlands, herein described. Preliminary observations on their natural history and their interactions with humans are provided, and the main threats and the prerequisites for their protection are discussed.
shine-biblio
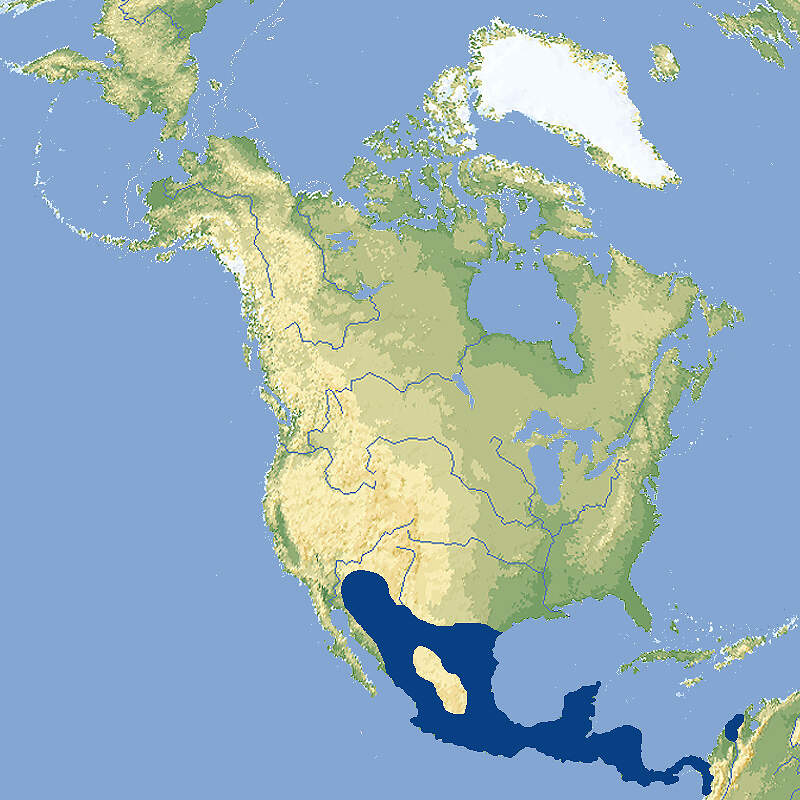
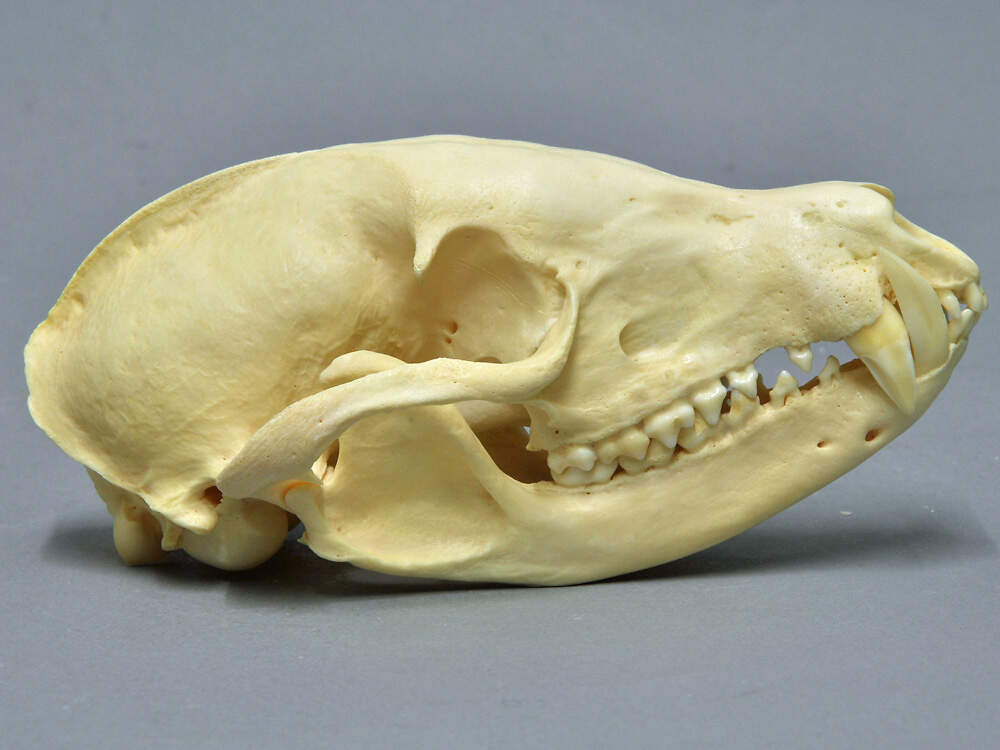
Weissrüsselbär
Überordnung: LAURASIATHERIA
Ordnung: Raubtiere (CARNIVORA)
Taxon ohne Rang: Landraubtiere (FISSIPEDIA)
Unterordnung: Hundeartige (Caniformia)
Familie: Kleinbären (Procyonidae)

Weißrüsselbär
Nasua narica • The Central American Coati • Le coati à nez blanc
- Körperbau und Körperfunktionen
- Verbreitung
- Lebensraum und Lebensweise
- Gefährdung und Schutz
- Bedeutung für den Menschen
- Haltung
- Taxonomie und Nomenklatur
- Literatur und Internetquellen
|
Weitere Bilder bei BioLib.cz |
Der Weißrüsselbär ist selbst nicht bzw. nur regional gefährdet, ist aber als tagaktive, soziale und sehr geschäftige Tierart ein ein ausgezeichneter Botschafter für Naturschutz in Mittelamerika. Gegenwärtig ist er in europäischen Zoos noch viel seltener als der Rote Nasenbär. Dies könnte aber wegen der Invasiv-Verordnung der EU ändern. Körperbau und KörperfunktionenDer Weißrüsselbär erreicht eine Kopf-Rumpflänge von 43-68 cm und eine Schwanzlänge von 42-68 cm. Das Gewicht liegt zwischen 3.5 und 5.6 kg. Männchen sind rund 20% größer und schwerer als Weibchen. Der Körper ist gestreckt und schlank, fast marderähnlich, der Hals kurz, der Kopf lang mit spitzer Schnauze. Der dicht behaarte Schwanz wird oft aufrecht getragen. Die Beine sind kurz und kräftig, mit breiten Tatzen und nackten Sohlen. Das auffälligste Merkmal ist die namengebende Nase. Sie verlängert sich rüsselartig weit über das Maul hinaus und hat scharfkantig aufgeworfene Ränder. Die Ohren sind kurz und abgerundet, die Augen mäßig groß, die fünf fast ganz verwachsenen Zehen mit langen und spitzigen, aber wenig gebogenen Krallen bewehrt. Das Gebiß ähnelt dem der Waschbären; die Zähne sind jedoch etwas schmaler und schmächtiger [2; 6; 9]. Vom Südamerikanischen Nasenbären unterscheidet sich der Weißrüsselbär hauptsächlich durch seine Fellfarbe. Diese ist graubraun, an Schnauze, Kehle und Bauch weißlich und an den Füßen fast schwarz. Der Schwanz ist nur undeutlich geringelt [6; 7]. VerbreitungNord- und Mittelamerika : Belize, Costa Rica, El Salvador, Guatemala, Honduras, Nordwest-Kolumbien, Mexiko (ohne Niederkalifornien), Nikaragua, Panama, südwestliche USA (Arizona, New Mexico, Texas) [3; 9]. Lebensraum und LebensweiseDer Weißrüsselnasenbär besiedelt Feucht- und Trockenwälder, Galeriewälder sowie Savannen (Chapparales) vom Tiefland bis gegen 2'900 m Höhe. In Grasland oder Wüste kommt er nur selten vor. Er ist überwiegend tagaktiv. Ältere Männchen leben solitär, ansonsten findet man Weißrüsselbären in Gruppen von bis zu 30 Tieren, wobei sich Weibchen auf die Geburt hin und während der ersten Phase der Jungenaufzucht absondern. Die Tiere kommunizieren innerhalb der Gruppe durch zirpende Laute. Auch olfaktorische Markierungen dienen der innerartlichen Kommunikation, namentlich während der Paarungszeit. Nasenbären sind gewandte Kletterer, die Baumstämme kopfvoran hinunterklettern können. Sie drehen dabei die Hinterfüße nach außen und rückwärts und klemmen sich mit ihnen fest an den Stamm an [1; 2; 3; 9]. Auf der Insel Barro Colorado in Panama, wo die Weißrüsselbären ausgiebig studiert wurden, stellte man bei einer Dichte von 51.5 Tieren/km² eine mittlere Gruppengröße von 15.3 (6-26) fest. Zur Nahrungssuche waren aber im Mittel nur 7.2 Tiere gemeinsam unterwegs. Die Gruppen hatten sich teilwese überlappende Streifgebiete von 33 ha. Junge Männchen, welche die Gruppe verließen, wanderten nicht gleich ab, sondern hielten sich zumindest zeitweilig immer noch im Streifgebiet der Gruppe auf [5]. Weißrüsselbären sind Allesfresser, die sich vorab von Insekten und Früchten ernähren, aber auch kleine Echsen, Nager und gelegentlich Vögel fangen, die sie durch Kopfbiss töten, und Aas oder Siedlungsabfälle zu sich nehmen. Etwa 90% ihrer Nahrung finden sie auf dem Boden, den sie mit ihren Nasen systematisch absuchen, was den größeren Teil des Tages in Anspruch nimmt. Zur Deckung ihre Nahrungsbedarfs benötigen die Gruppen Streifgebiete von 33 ha im tropischen Regenwald Panamas bis 1'350 ha in den Trockengebieten Arizonas [5; 6; 9]. Weißrüsselbären haben eine kurze Paarungszeit, während der die solitären Männchen die Weibchenrudel aufsuchen. In den USA fällt die Paarungszeit auf April, in Panama auf Januar. Kurz vor der Geburt, die nach einer Tragzeit von 70-77 Tagen stattfindet, sondern sich die trächtigen Weibchen ab und bauen ein Baumnest, in dem sie ihre 3-4 (1-7) etwa 100-180 g schweren Jungen gebären. Diese werden etwa 4 Monate gesäugt. Mit 24 (21-28) Tagen sind sie bereits gut zufuß und verlassen das Nest, mit 4 Wochen können sie klettern. Weibchen paaren sich im Freiland erstmals mit 22 Monaten, Männchen mit 34 Monaten, kommen aber in diesem Alter selten zur Fortpflanzung, weil sie gegen ältere Geschlechtsgenossen keine Chance haben [6; 7; 8; 9]. Gefährdung und SchutzDie Bestandstendenz ist abnehmend, und lokal ist der Weißrüsselbär wegen Bejagung und Habitatverlust gefährdet oder wurde gar ausgerottet. Andererseits kommt er auch in zahlreichen Nationalparks und sonstigen Schutzgebieten vor. Insgesamt wird er aufgrund einer Beurteilung aus dem Jahr 2015 noch nicht als gefährdet eingestuft (Rote Liste: LEAST CONCERN) [3]. Der internationale Handel ist unter CITES nicht geregelt mit Ausnahme der honduranischen Population, die unter Anhang III fällt. Das unsinnige Verbot von Erwerb und Abgabe, Haltung, Zucht, Aufzucht, Transport und Freilassen von Nasenbären nach Verordnung (EU) Nr. 1143/2014 des Europäischen Parlaments und des Rates vom 22. Oktober 2014 betreffend invasive Arten gilt nicht für den Weißrüsselbären. Bedeutung für den MenschenWirtschaftliche Bedeutung: Der Weißrüsselbär wird in fast seinem ganzen Verbreitungsgebiet zur Gewinnung von Fell und Fleisch gejagt [3]. Wie BREHM feststellte, wird das Fleisch "nicht allein von den Eingeborenen, sondern auch von den Europäern gern gegessen. Junge Nasenbären liefern, namentlich wenn sie fett sind, einen vortrefflichen Braten, und auch das Fleisch der Alten ist immer noch wohlschmeckend. Aus dem Fell verfertigen die Indianer kleine Beutel." [2] Haltung im ZooWeißrüsselbären können im Zoo ein Alter von 26-27 Jahren erreichen [8]. Eine Vergesellschaftung mit größeren Säugetieren ist möglich, so wurden im z.B. Tierpark Nordhorn Weißrüsselbären zusammen mit Bisons und Halsbandpekaris gehalten. Haltung in europäischen Zoos: Wie Nasenbären gehalten werden (Beispiele):
Forschung im Zoo (Beispiel): Im Rahmen einer Diplomarbeit wurde das Ruhe- und Schlafverhalten des Weißrüsselbären untersucht und mit dem verwandter Arten verglichen [3]. Mindestanforderungen an Gehege: Nach Säugetiergutachten 2014 des BMEL soll ein Außengehege für ein Paar Weißrüsselbären mindestens eine Fläche von 30 m² aufweisen. Für jedes weitere Adulttier kommen 2 m² zur Basisfläche dazu. Falls oben geschlossen, soll die Höhe mindestens 3 m betragen. Das Innengehege, sofern erforderlich, soll bei einer Höhe von 2.5 m für ein Paar eine Fläche von 6 m² haben und für jedes weitere Adulttier 3 m² mehr. Die Schweizerische Tierschutzverordnung (Stand 01.06.2022) schreibt für 1-2 Tiere ein Außengehege mit einer Grundfläche von 30 m² vor mit einer Höhe von mindestens 3 m. Für das Innengehege ist eine Basisfläche von 20 m² und eine Höhe von 3 m vorgeschrieben. Für jedes weitere Tier kommen außen und innen je 3 m² zur Basisflächen dazu. Nach der 2. Tierhaltungsverordnung Österreichs (Stand 2023) ist für 1-2 Tiere ein Außengehege von 40 m², für jedes weitere Adulttier sind 4 m² zusätzlich erforderlich. Ein Innengehege ist nicht notwendig, wenn ein entsprechender Wetterschutz geboten wird. Taxonomie und NomenklaturDer Weißrüsselbär wurde erstmals 1766 von Carl von LINNÉ unter der Bezeichnung "Viverra narica", also als Schleichkatze, wissenschaftlich beschrieben. Die Gattung Nasua wurde 1780 vom Tübinger Professor Gottlieb Conrad Christian STORR aufgestellt, und Étienne GEOFFROY SAINT-HILAIRE, der Begründer des ersten bürgerlichen Zoos, der Ménagerie im Jardin des Plantes von Paris, stellte narica 1803 in diese Gattung. Über die Verwandtschaftsverhältnisse der Nasenbärarten herrschte lange Unsicherheit. BREHM spricht vom Nasenbären als Nasua narica und vom Weißrüßelbären als Nasua leucorhyncha und gibt als Verbreitung des Einen Ostbrasilien und des Anderen Nordbrasilien an. Heute gelten die südamerikanischen Formen als Nasua nasua und die in Nord- und Mittelamerika als Nasua narica [9]. Es werden vier Unterarten anerkannt:
Der Cozumel-Weißrüsselbär wurde in der Vergangenheit oft als eigene Art angesehen [2; 6; 9]. |
Literatur und Internetquellen
- ALLEN, T. B. (1979)
- BREHM, A. E. (1882-1887)
- CUARÓN, A.D. et al. (2016). Nasua narica. The IUCN Red List of Threatened Species 2016: e.T41683A45216060. http://www.iucnredlist.org/details/41683/0. Downloaded on 21 June 2018.
- DIETERMANN, A. (1996)
- GOMPPER, M. E. (2009)
- GRZIMEK, B. (Hrsg. 1970)
- PUSCHMANN, W., ZSCHEILE, D., & ZSCHEILE, K. (2009)
- WEIGL, R. (2005)
- WILSON, D. E. et al. eds. (2009-2019)
Zurück zu Übersicht Landraubtiere
Weiter zu Nasenbär (Nasua nasua)
Weissrüsselbär, Weissrüssel-Nasenbär
Brillenblattnase
Überordnung: LAURASIATHERIA
Ordnung: Fledertiere (CHIROPTERA)
Unterordnung: Fledermäuse (Microchiroptera)
Überfamilie: Hasenmaulartige (Noctilionoidea)
Familie: Blattnasen (Phyllostomidae)
Unterfamilie: Kurzschwanzblattnasen (Carolliinae)

Brillenblattnase
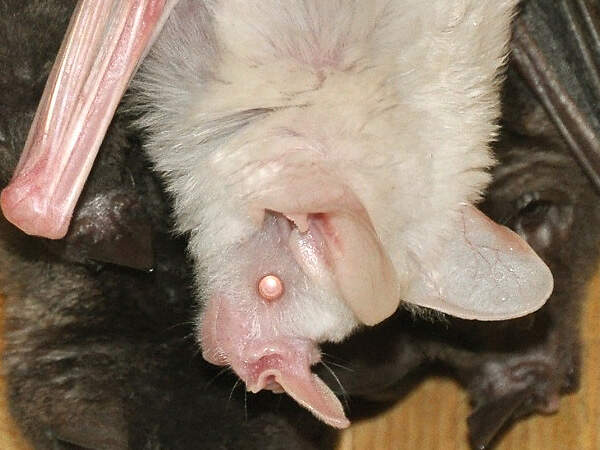
Carollia perspicillata • The Seba's Short-tailed Bat • Le fer-de-lance à lunettes
- Körperbau und Körperfunktionen
- Verbreitung
- Lebensraum und Lebensweise
- Gefährdung und Schutz
- Bedeutung für den Menschen
- Haltung
- Taxonomie und Nomenklatur
- Literatur und Internetquellen
|
Weitere Bilder auf BioLib |
Die neuweltlichen Blattnasen sind die einzige Fledermausfamilie von der mehrere Arten regelmäßig und in größerer Zahl in europäischen Zoos gezeigt werden. Geeignet sind insbesondere Arten, die sich auf den Verzehr von Nektar, Früchten oder Blut spezialisiert haben, wie die harmlose und daher für begehbare Anlagen geeignete, fruchtfressende Brillenblattnase. Körperbau und KörperfunktionenIhren Namen verdanken die Blattnasen dem charakteristischen Nasenaufsatz, der wie ein Blatt aussieht. Die Kopf-Rumplänge beträgt etwa 5.5 cm, der Schwanz ist 1 cm lang, der Unterarm misst im Mittel 41 mm und das mittlere Gewicht beträgt 17 g für Männchen und 16 g für Weibchen [4]. VerbreitungMittel- und Südamerika : Belize, Bolivien, Brasilien, Costa Rica, Ekuador, El Salvador, Französisch Guiana, Guatemala, Guyana, Honduras, Kolumbien, Mexiko, Nikaragua, Panama, Paraguay, Peru, Saint Kitts und Nevis, Surinam, Trinidad und Tobago [1]. Lebensraum und LebensweiseBrillenblattnasen schlafen in kleinen Gruppen oder in Kolonien von mehreren hundert Tieren in Fels- oder Baumhöhlen, Tunnels oder unter dem Dach von Häusern. Sie ernähren sich ausschließlich von Früchten, die sie mit Hilfe ihres ausgezeichneten Geruchssinns finden. Zu ihrer Lieblingsnahrung gehören Beeren und Steinfrüchte von Pfeffergewächsen, daneben nehmen sie Nektar und Pollen oder, wenn pflanzliche Nahrung knapp wird, Insekten. Sie wurden auch schon beim Fressen von Guaven, Bananen und wilden Feigen beobachtet. In einem großen Teil ihres Areals bringen die Weibchen nach einer Tragzeit von 115-120 Tagen im Abstand von 115-173 Tagen jeweils ein Junges zur Welt. Dieses ist schon weit entwickelt. Es hat ein Geburtsgewicht von 5 g und hat die Augen bereits geöffnet. Es bleibt während der ersten zwei Lebenswochen praktisch ständig auf der Mutter [1; 2; 3]. Gefährdung und SchutzDie Brillenblattnase wird aufgrund einer Beurteilung aus dem Jahr 2015 nicht als gefährdet angesehen, da sie weit verbreitet ist, eine große Gesamtpopulation hat, auch in Schutzgebieten vorkommt und vom Menschen modifizierte oder geschaffene Lebensräume nutzen kann. (Rote Liste: LEAST CONCERN) [1]. Der internationale Handel ist durch CITES nicht geregelt. Bedeutung für den MenschenDie Art wird witschaftlich weder genutzt noch richtet sie Schäden an [1]. HaltungFledermäuse können Wirte und potenzielle Überträger von auf den Menschen übertragbaren Viren und anderen Krankheitserregern sein. Bei Brillenblattnasen aus deutschen Haltungen wurden z. B. Chlamydien nachgewiesen. Übertragungen quf den Menschen sind aus Zoos allerdings keine bekannt. Auch sonst sind Brillenblattnasen vollkommen harmlos. Sie sind sehr wendig und können dank ihrem Echoortungssystem im dichten Blattwerk und auf engstem Raum manövrieren. Sie werden deshalb gerne freifliegend in für Besucher begehbaren Tropen-oder Nachttierhallen gehalten. Sie sind unter Zoobedingungen recht langlebig. Den Altersrekord hält ein im Henry Doorley Zoo, Omaha, gborenes Weibchen, das dort nach 17 Jahren immer noch am Leben war [4]. Die Art wird in rund 40 Zoos gehalten, von denen sich etwa ein Viertel im deutschsprachigen Raum befinden. Für Details siehe Zootierliste. Mindestanforderungen an Gehege: Die im Säugetiergutachten 2014 des BMEL vorgegebenen Zahlen entbehren einer wissenschaftlichen Grundlage und sind, zuminderst wenn es um große Kolonien geht, aus der Sicht der tierhalterischen Praxis überzogen. Wie die Tierschutzsachverständigen der Zoos festhielten, zeigt die Erfahrung, dass in einem Gehege von 20m³ problemlos 50 Brillenblattnasen gehalten werden können (laut Gutachten dürften es nur 20 sein), und dass ein Raumvolumen von 160m³ für 700 Brillenblattnasen absolut auseichend ist (das Gutachten gibt 292 m³ vor). Grundsätzlich sollte keine Mindestfläche, sondern nur ein Volumen vorgegeben werden. Das Gutachten’96 gab für kleine Fledermäuse keine Gehegedimensionen an. Es empfiehlt sich, die Beurteilung der Haltung von Kleinfledermäusen darauf abzustellen, ob bei der in einer Haltung gegebenen Besatzdichte Probleme auftreten oder nicht. Die Schweizerische Tierschutzverordnung (Stand 01.06.2022) schreibt für bis zu 20 Tiere eine Grundfläche von 10 m² bei einer Höhe von 2 m vor, für jedes weitere sind 0.2 m² zusätzliche Fläche erforderlich. Nach der 2. Tierhaltungsverordnung Österreichs (Stand 2023) sind für bis zu 20 Tieren eine Grundfläche von 20 m² und eine Höhe von 2.5 m erforderlich, für jedes weitere Tier ist die Grundfläche um 2 m² zu erhöhen. Letzteres ist unsinnig, nachdem für die ersten 20 nur eine Fläche von 1 m² pro Tier verlangt wird. Taxonomie und NomenklaturDie Art wurde 1758 von Carl von LINNÉ als "Vespertilio perspicillata" beschrieben. John Edward GRAY, ein Mitglied der Londoner Zoologischen Gesellschaft stellte sie 1838 in die neue Gattung Carollia [5]. |
Literatur und Internetquellen
- BARQUEZ, R. et al. (2015). Carollia perspicillata. The IUCN Red List of Threatened Species 2015: e.T3905A22133716. http://www.iucnredlist.org/details/3905/0. Downloaded on 15 May 2018.
- EISENBERG, J. F. (1989)
- GRZIMEK, B. (Hrsg. 1970)
- WEIGL, R. (2005)
- WILSON, D. E. & REEDER, D. M. (2005)
- FRITSCHI, J. S. (2020)
Zurück zu Übersicht Insektenfresser und Fledertiere
Weiter zu Gemeiner Vampir (Desmodus rotundus)
LE, Q. K. & ZIEGLER, T (2003)
First record of the Chinese crocodile lizard from outside of China: Report on a population of Shinisaurus crocodilurus Ahl, 1930 from North-eastern Vietnam.
Hamadryad, Tamil Nadu 27(2): 193 – 199.
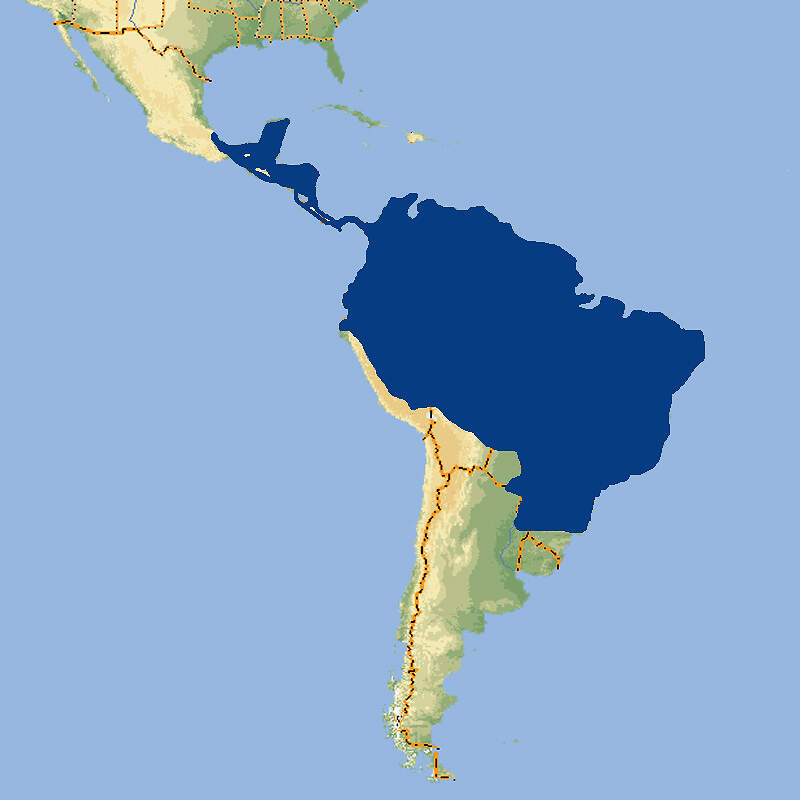
Matschie-Baumkänguru
Unterklasse: Beuteltiere (MARSUPIALIA)
Ordnung: Känguruverwandtschaft (DIPROTODONTIA)
Unterordnung: Känguruartige (Macropodiformes)
Familie: Kängurus (Macropodidae)
Unterfamilie: Eigentliche Kängurus (Macropodinae)
Matschie-Baumkänguru
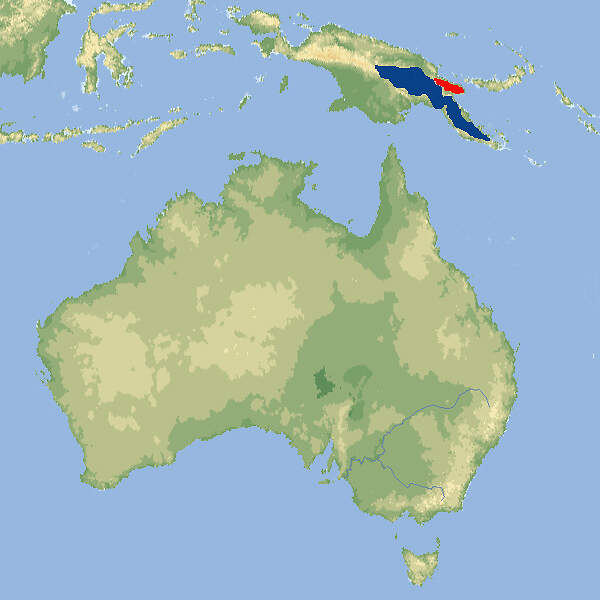
Dendrolagus matschiei • The Matschie's Tree Kangaroo • Le dendrolague de Matschie
- Körperbau und Körperfunktionen
- Verbreitung
- Lebensraum und Lebensweise
- Gefährdung und Schutz
- Bedeutung für den Menschen
- Haltung
- Taxonomie und Nomenklatur
- Literatur und Internetquellen
|
Weitere Bilder auf BioLib.cz |
Das Matschie-Baumkänguru ist eine auffällige Erscheinung und eignet sich daher gut als Botschafter für Natur- und Artenschutz in Neuguinea. In Europa wird die Haltung zugunsten des Goodfellow-Baumkängurus aufgegeben, währenddem in Nordamerika ein koordiniertes Zuchtprogramm weiterläuft. Körperbau und KörperfunktionenDendrolagus matschiei ist eine kleinere Baumkänguru-Art ohne markanten Geschlechtsdimorphismus. Beide Geschlechter sind in etwa gleich groß. Die Kopf-Rumpflänge beträgt etwa 51-66 cm, die Schwanzlänge 45-68 cm, und das Gewicht liegt zwischen 7 und 10.5 kg. Das kontrastreiche Fell ist kurz und wollig. Mitten auf dem Rücken befindet sich ein Paar Haarwirbel. Die Färbung ist ähnlich wie beim Goodfellow-Baumkänguru, jedoch fehlen die hellen Längsstreifen auf dem Rücken [1; 10]. VerbreitungNeuguinea: Papua-Neuguinea, höhere Lagen der Huon-Halbinsel. Ferner gibt es eine vermutlich eingeführte Population auf der Vulkaninsel Umboi. Das Artareal umfasst etwa 14'000 km² [10]. Lebensraum und LebensweiseDas Matschie-Baumkänguru besiedelt Regenwälder in Höhenlagen von 1'000 bis 3'300 m. Über sein Sozialverhalten im Freiland ist wenig bekannt. Vermutlich lebt es einzeln bzw. als Mutter-Kind-Gruppe. Es nutzt Streifgebiete von rund 140 ha, was im Vergleich zu anderen Baumkängurus sehr viel ist. Es ernährt sich am Boden oder auf Bäumen von Blättern verschiedener Bäume und Büsche, Schlingpflanzen und Farnen und bisweilen auch von Blüten oder Früchten [8; 10]. Weibchen werden mit etwa 25 Monaten geschlechtsreif. Paarungen können während des ganzen Jahres stattfinden. Nach einer Tragzeit von rund 44-45 Tagen wird in der Regel ein einzelnes Junges geboren. Kurz vor der Geburt reinigt das Weibchen akribisch seinen Beutel. Das Junge beginnt mit rund 9 Monaten festes Futter zu sich zu nehmen. Es steigt erstmals mit 10 Monaten aus dem Beutel und verlässt ihn mit etwa 13 Monaten definitiv. Danach begleitet es die Mutter für weitere 2-3 Monate [2; 4; 8]. Gefährdung und SchutzDas Matschie-Baumkänguru hat bereits natürlicherweise eine geringe Populationsdichte und ein kleines Verbreitungsgebiet (begrenzt auf höhere Lagen). Durch die Jagd und den Lebensraumverlust werden die Bestände noch weiter dezimiert. Ein weiteres Problem besteht darin, das alle Tiere nur einer einzigen Subpopulation angehören. Deshalb wird die Art (ohne Berücksichtigung der Umboi-Population) als stark gefährdet beurteilt (Rote Liste: ENDANGERED) [10]. Der internationale Handel wird durch CITES nicht geregelt. Zoogestütztes Artenschutzprojekt (Beispiel):
Bedeutung für den MenschenWirtschaftliche Bedeutung: Das Matschie-Baumkänguru wird auf der Huon-Halbinsel Neuguineas traditionell zur Fleischgewinnung bejagt [10]. HaltungMatschie-Baumkängurus sollten in Gehegen mit ausreichend Klettermöglichkeiten und erhöht angebrachten Futterstellen untergebracht werden. Idealerweise sollte die Umgebungstemperatur für diese Tiere tropischer Bergwälder bei 18-22ºC liegen, jedoch ertragen Matschie-Baumkängurus ohne Schaden zu nehmen erhebliche Temperaturschwankungen. Im Zoo von Adelaide, wo sie zusammen mit anderen Känguruarten ganzjährig in einem größeren Außengehege gehalten wurden, schwankten die Temperaturen zwischen 0°C im Winter und 47.6°C im Sommer. Bei hohen Temperaturen lecken sich die Baumkängurus die Unterarme, um abzukühlen [1]. Meist werden sie paarweise oder als Trios gehalten. Eine Vergesellschaftung mit Schnabeligeln, Klein- oder Rattenkängurus, Flughunden oder Vögeln ist möglich. Das älteste, von WEIGL erfasste Matschie-Baumkänguru, ein Weibchen, starb in einer amerikanischen Institution im Alter von 26 Jahren und 11 Monaten [7]. Es gibt seit 1987 ein Internationales Zuchtbuch (ISB), das am Lincoln Children's Zoo, Nebraska, geführt wird. Dieses umfasste im Juni 2014 73 lebende Individuen in 27 Einrichtungen [IZY 52]. Haltung in europäischen Zoos: Die ersten Matschie-Baumkängurus gelangten in den 1930er-Jahren in den Londoner Zoo, wo es 1932 zur Erstzucht kam. 1936 gelangte das erste Tier in den Frankfurter Zoo und damit aufs europäische Festland [6]. Die Art wird gegenwärtig (2023) nur noch in einem einzigen Zoo gehalten. Für Details siehe Zootierliste. Das 1990 ins Leben gerufene, vom Krefelder Zoo koordinierte Europäische Erhaltungszuchtprogramm (EEP) wurde aufgegeben. Es wird versucht, in Europa einen Bestand an goodfellowi aufzubauen, währenddem sich die amerikanischen Zoos auf matschiei konzentrieren. Früher wurde die Art relativ häufig in Europa gehalten. In den 1970er-Jahren war der Zoo Zürich der erste europäische Zoo, der wieder Matschie-Baumkängurus aus Papua-Neuguinea erhielt. Von 1971-1982 wurden dort 16 Jungtiere geboren und aufgezogen [JB und Tierbestandslisten Zoo Zürich]. Die deutsche Erstzucht gelang dem Zoo Berlin im Jahr 1976. Forschung im Zoo: Unter Beteiligung zahlreicher Zoos wurde eine umfangreiche Arbeit über das Ruheverhalten verschiedener Känguru-Arten, darunter Dendrolagus matschiei, durchgeführt [5]. Die Kenntnisse über das Fortpflanzungsverhalten beruhen weitgehend auf einer Dissertation, die Lisa DABEK in Seattle durchgeführt hat [2; 8]. Mindestanforderungen an Gehege: Das Säugetiergutachten 2014 des BMEL gibt ein fakultatives Außengehege mit einer Mindestfläche von 40 m² für ein Paar und 10 m² für jedes weitere Tier an. Das Innengehege soll 16 m² groß und 3 m hoch sein, und für jedes weitere Tier ist die Fläche um 8 m² zu erhöhen. Die Tierschutzverordnung der Schweiz (Stand 01.06.2022) schreibt für 1- 2 Tiere je ein Innen- und ein Außengehege von 16 m²/40m³ vor. Für jedes weitere Tier sind die Grundflächen um jeweils 4 m² zu erhöhen. Die 2. Tierhaltungsverordnung Österreichs (Stand 2023) verlangt für ein Paar ein Außen- und ein Innengehege von je 20 m²/60 m³. Für jedes weitere Tier ist die Fläche außen wie innen um 2 m² zu erhöhen. Nach JACKSON soll für 2 Tiere eine Gehegefläche von 40 m² nicht unterschritten werden [3]. Taxonomie und NomenklaturDas Matschie-Baumkänguru wurde 1907 dem deutschen Naturforscher Friedrich Förster und dem englischen Bankier und Zoologen Lionel Walter Rothschild anhand eines Exemplars aus dem damaligen Deutsch-Neuguinea unter seinem heute noch gültigen Namen beschrieben. Zeitweilig wurden goodfellowi und spadix als Unterarten von matschiei angesehen, aber diese werden jetzt als selbständige Arten anerkannt [8]. Sie sind aber nahe mit dem Matschie-Baumkänguru verwandt. Die Artareale von goodfellowi und matschiei stoßen aneinander und in Menschenobhut hybridisieren die beiden Arten leicht. Eventuell gibt es auch im Freiland eine Übergangszone. |
Literatur und Internetquellen
- CROOK, G. A. & SKIPPER, G. (1987)
- DABEK, L. (1994)
- JACKSON, S. M. (2003)
- OLDS, T. J. & COLLINS, L. R. (1973)
- SCHÜRER, U. (1978)
- SCHÜRER, U. (2019)
- WEIGL, R. (2005)
- WILSON, D. E. et al. eds. (2009-2019)
- WOODLAND PARK ZOO - YUS CONSERVATION AREA
- ZIEMBICKI, M. & POROLAK, G. (2016). Dendrolagus matschiei. The IUCN Red List of Threatened Species 2016: e.T6433A21956650. http://www.iucnredlist.org/details/6433/0. Downloaded on 15 June 2018.
- ROSS, T. & DABEK, L. (2006)
Zurück zu Übersicht Kloaken- und Beuteltiere
BAUNI, V., CAPMOUERTERES, V., HOMBERG, M.A. & ZULETA, G. A. (2013)
Distribution and status of the extant xenarthrans (Mammalia: Xenarthra) in the Southern Cone Mesopotamian savanna, Argentina.
Edentata 14 (2013): 35–50.
Electronic version: ISSN 1852-9208
Print version: ISSN 1413-4411
Abstract:
The Southern Cone Mesopotamian savanna (MS), located in northeastern Argentina, is one of the least protected ecoregions (0.11%) of the country. Five of the seven historically present species of xenarthrans in this region are of conservation concern at the national level. This work reviews, updates and analyzes the current distribution and conservation status of the xenarthrans using a georeferenced database including records from four complementary methods: field surveys, interviews with local stakeholders, participatory monitoring, and bibliography review. Results were then compared with existing distribution maps. In total, 304 occurrence records were documented in 127 localities. Considering their relative presence (number of localities where the species is present divided by the total number of localities), the species with most records were Dasypus novemcinctus (71.7%) and Dasypus hybridus (63%); Euphractus sexcinctus and Tamandua tetradactyla were detected in a lower proportion (48.8 and 35.4%, respectively). Cabassous tatouay and Myrmecophaga tridactyla are rare species in the ecoregion. The extant xenarthrans that inhabit the MS are reviewed and information gaps for certain species are identified. We emphasize the importance of contributions from the local community, who provided 80% of the collected information for this study.
JORDAN, B. (2009)
Die Kleine Wüstenspringmaus Jaculus jaculus.
61 Seiten, mit 55 Abbildungen.
Natur- und Tier-Verlag GmbH, Münster. ISBN 978-3-86659-125-7.
jordan-biblio



























![Matschie-Baumkänguru (Dendrolagus matschei). Illustration zur Originalbeschreibung von FÖRSTER, F. & ROTHSCHILD, L. W. (1907) in Novitates Zoologicae, Pl. IV. Gemeinfrei. Anmerkung: Die helle Gesichtszeichnung ist nicht dargestellt [siehe 6]. 102 012 006 006 dendrolagus matschiei novitates](images/101-Mono-Mars/102-012-006-006_dendrolagus_matschiei_novitates.jpg)