COZZI, G., BROEKHUIS, F., McNUTT, J.W. & SCHMID, B. (2013).
Comparison of the effects of artificial and natural barriers on large African carnivores: Implications for interspecific relationships and connectivity
Journal of Animal Ecology 82: 707-715.
Summary:
1. Physical barriers contribute to habitat fragmentation, influence species distribution and ranging behaviour, and impact long-term population viability. Barrier permeability varies among species and can potentially impact the competitive balance within animal communities by differentially affecting co-occurring species. The influence of barriers on the spatial distribution of species within whole communities has nonetheless received little attention.
2. During a 4 year period, we studied the influence of a fence and rivers, two landscape features that potentially act as barriers on space use and ranging behaviour of lions Panthera leo, spotted hyenas Crocuta crocuta, African wild dogs Lycaon pictus and cheetahs Acinonyx jubatus in Northern Botswana. We compared the tendencies of these species to cross the barriers using data generated from GPS-radio collars fitted to a total of 35 individuals. Barrier permeability was inferred by calculating the number of times animals crossed a barrier vs. the number of times they did not cross. Finally, based on our results, we produced a map of connectivity for the broader landscape system.
3. Permeability varied significantly between fence and rivers and among species. The fence represented an obstacle for lions (permeability = 7.2%), while it was considerably more permeable for hyenas (35.6%) and wild dogs and cheetahs (≥ 50%). In contrast, the rivers and associated floodplains were relatively permeable to lions (14.4%) while they represented a nearly impassable obstacle for the other species (< 2%).
4. The aversion of lions to cross the fence resulted in a relatively lion-free habitat patch on one side of the fence, which might provide a potential refuge for other species. For instance, the competitively inferior wild dogs used this refuge significantly more intensively than the side of the fence with a high presence of lions.
5. We showed that the influence of a barrier on the distribution of animals could potentially result in a broad-scale modification of community structure and ecology within a Influence of barriers on large carnivores guild of co-occurring species. As habitat fragmentation increases, understanding the impact of barriers on species distributions is thus essential for the implementation of landscape-scale management strategies, the development and maintenance of corridors and the enhancement of connectivity.
cozzi-biblio
SCHWITZER, C., SCHWITZER, N, RANDRIATHAHINA G. H. & KAUMANS, W. (2005)
Inventory of the Eulemur macaco flavifrons population in the Sahamalaza protected area, northwest Madagascar, with notes on an unusual colour variant of E. macaco.
Primate Report Special Issue 72 (1): 39-40.
Abstract:
The blue-eyed black lemur (Eulemur macaco flavifrons; Emf), the taxonomic validity of which was recently confirmed, was rediscovered by science only in 1983 and is still one of the least-studied of all lemur taxa.
It is only found in the sub-humid forests of the Sahamalaza peninsula and in a small stretch of forest on the adjacent mainland. In the north-eastern part of its range the subspecies seems to hybridise with the nominate subspecies, E. m. macaco (Emm).
Emf is listed as critically endangered by the IUCN. Its remaining habitat is already substantially fragmented. A protected area, including the Sahamalaza peninsula and thus the probably largest remaining population of blue-eyed black lemurs, is currently in the process of creation. As part of a long-term research and conservation programme we counted the total number of individual Emf in two fragments of the Ankarafa forest in the south-western part of the peninsula to be 37 individuals on 0.61 km2. We extrapolate this count to the total forested area of the national park and compare the figures with earlier population estimates for the subspecies. We moreover provide preliminary data on a population of Eulemur macaco showing an unusual fur colouration different to that of both described subspecies. These animals occur around the village of Kapany, about 12 km north of Maromandia [5] and thus in the western part of the Emf and Emm border region. As they are homogeneous in colouration across groups and forest fragments it is unlikely that they represent subspecies hybrids.
Der Volltext des Artikel s kann heruntergeladen werden von der Internetseite der AEECL: http://www.aeecl.org/documents/17.pdf
22.03.2015
KINGDON, J., HAPPOLD, D., BUTYNSKI, T. HOFFMANN, M., HAPPOLD, M., KALINA, J. (Hrsg. 2013)
Mammals of Africa.
6 Bände, 3500 Seiten. Bloomsbury Publishing. ISBN 9781408122570.
Mammals of Africa (MoA) is a series of six volumes which describes, in detail, every currently recognized species of African land mammal. This is the first time that such extensive coverage has ever been attempted, and the volumes incorporate the very latest information and detailed discussion of the morphology, distribution, biology and evolution (including reference to fossil and molecular data) of Africa's mammals. With 1,160 species and 16 orders, Africa has the greatest diversity and abundance of mammals in the world. The reasons for this and the mechanisms behind their evolution are given special attention in the series.
Each volume follows the same format, with detailed profiles of every species and higher taxa. The series includes some 660 colour illustrations by Jonathan Kingdon and his many drawings highlight details of morphology and behaviour of the species concerned. Diagrams, schematic details and line drawings of skulls and jaws are by Jonathan Kingdon and Meredith Happold. Every species also includes a detailed distribution map. Extensive references alert readers to more detailed information.
Volume I: Introductory Chapters and Afrotheria (352 pages)
Volume II: Primates (560 pages)
Volume III: Rodents, Hares and Rabbits (784 pages)
Volume IV: Hedgehogs, Shrews and Bats (800 pages)
Volume V: Carnivores, Pangolins, Equids and Rhinoceroses (560 pages)
Volume VI: Pigs, Hippopotamuses, Chevrotain, Giraffes, Deer and Bovids (704 pages)
Geflecktes Rüsselhündchen (Rhynchocyon cirnei)
Band I: 285-286.
kingdon-biblio
GOODMAN, S.M. & LANGRAN, O.(1996)
A high mountain population of the ring-tailed lemur Lemur catta on the Andringitra Massif, Madagascar.
Oryx 30 (4) October 1996: 259-268.
ISSV 0030-6053. DOI: http://dx.doi.org/10.1017/S003060530002175X.
Abstract:
The ring-tailed lemur Lemur catta is generally considered to be a species of dry deciduous forest, gallery forest and spiny thorn scrub at relatively low altitudes. During a survey of the summit zone of the Andringitra Massif, one of the most climatically extreme areas on Madagascar, we recorded this species above the tree-line at 2520 m in an area composed mostly of exposed rock, low ericoid bush and subalpine vegetation. Information was collected on food plants consumed by this species. This pelage coloration of the local population of L. catta differed from museum specimens and photographs taken from other areas of this species's range. The taxonomic status of the Andringitra population is in need of further study.
goodman-biblio
SCHALLER, G.B., LIU, W. & WANG, X. (1996)
Status of Tibet red deer.
ORYX 30 (4): 269-274. ISSN 0030-6053
Abstract:
Reports of the Tibet red deer, a subspecies of Cervus elaphus, have been so few in recent years that there were fears that the animal was extinct. A survey in a mountainous region of south-east Tibet in October 1995 found evidence that a few deer survive in one small area and possibly two others in high-altitude valleys of the tributaries of the Subansiri River. The most exciting finding of the survey, however, was an estimated 200-strong population of this deer in high rolling hills near the village of Zhenqi, north of the Yarlung Tsangpo River. This is the only known viable population of the deer and, although some hunting occurs, including by professional poachers from outside Tibet, the fact that it survives is an indication of the tolerance of the local people. The Tibet forest Bureau has agreed to fund guards and to establish a reserve for the deer in co-operation with local people.
schaller-biblio
LAMICHHANE, B., DHAKAL, M. SUBEDI, N. & POKHERAL, C. P.(2014)
Clouded leopard co-exist with other five felids in Chitwan National Park, Nepal.
Cat News No. 61: 30-42. IUCN Cat Specialist Group. ISSN 1027-2992.
Abstract:
Once believed to be regionally extinct in Nepal, the clouded leopard Neofelis nebulosa, was recorded in 1989 and again in recent years with two new photographicevidence from Annapurna Conservation Area and Shivapuri Nagarjun National Park in 2011 and 2012. This year we recorded photographs of three individual clouded leopardsfrom two locations in Chitwan National Park using camera traps. With this record, Chitwan National Park is one of the few parks in the world with six felid species i.e. tiger Panthera tigris, common leopard Panthera pardus, clouded leopard, fishing cat Prionailurus viverrinus, leopard cat Prionailurus bengalensis and jungle cat Felis chaus.
lamichhane-biblio
SPALTON, J. A. & AL HIKMANI, H. M. (2006)
The Leopard in the Arabian Peninsula - Distribution an Subspecies Status
Cat News Special Issue No. 1: 4-8- IUCN Cat Specialist Group. ISSN 1027-2992.
Abstract:
Historically it was considered that there were four subspecies of leopards in the Arabian region. Today P. p.jarvisi no longer occurs and the ranges of P. p. tulliana and P. p. saxicolor have severely contracted north. Only P. p. nimr, the Arabian leopard, remains. Morphological data suggests nimr to be the smallest of the leopards and a distinct subspecies but this has yet to be conclusively confi rmed by genetic evidence. Recent records give a bleak picture of the status of P. p. nimr. A few individuals survive in the Judean Desert and Negev Highlands while in the Arabian Peninsula leopards are known from just one location in the Republic of Yemen and one in the Sultanate of Oman. In Yemen the leopards of the Al Wada’a area are under great pressure from killing and from capture for trade. In Oman the situation is much more hopeful and the leopards of the Dhofar Mountains have benefi ted from comprehensive conservation measures. While the possibility, however remote, of the existence of other relict populations cannot be ruled out the need for urgent conservation action across the region is obvious given the reality that the Arabian leopard may soon be reduced to two, or even just one population in the wild.
spalton-biblio
23.12.2014 - 694
JUTZELER, E., ZHIGANG, W., WEISHI, L. & BREITENMOSER, U. (2010)
Leopard - Panthera pardus.
Cat News Special Issue 5, Autumn 2010: Cats in China: 30-33. IUCN Cat Specialist Group, ISSN 1027-2992.
Abstract:
In Asia, the leopard was originally widely distributed south of about 45°N. Across southwest and central Asia, leopard populations are small, separated and isolated; distribution and present status is however poorly known in most central Asiatic countries. Leopards are believed to be still relatively abundant in the forests of the Indian sub-continent, through Southeast Asia and into China, although they are becoming increasingly rare outside protected areas. In China, they are still present throughout the east, centre and south. In the 1950s, national campaigns to eradicate pest animals – including tigers and leopards – had a considerable impact on the populations, mainly in the south. Based on purchased skins, 2,000–3,000 leopards were killed each year during the mid 1950s. The Critically Endangered Amur leopard has been reduced to a very small population in Russia, China, and possibly North Korea. The 2007 census revealed 25–34 animals remaining in the wild. Although P. p. orientalis is extremely rare compared to the other subspecies, we know much more about leopards in northeastern China than about those in the rest of the country, because the Amur leopard has received much attention and has also profited from field research and conservation activities focussing on Siberian tigers.
jutzeler-biblio
Haarnasenwombat
Unterklasse: Beuteltiere (MARSUPIALIA)
Ordnung: Känguruverwandtschaft (DIPROTODONTIA)
Unterordnung: Wombatartige (Vombatiformes)
Familie: Wombats oder Plumpbeutler (Vombatidae)

Südlicher Haarnasenwombat
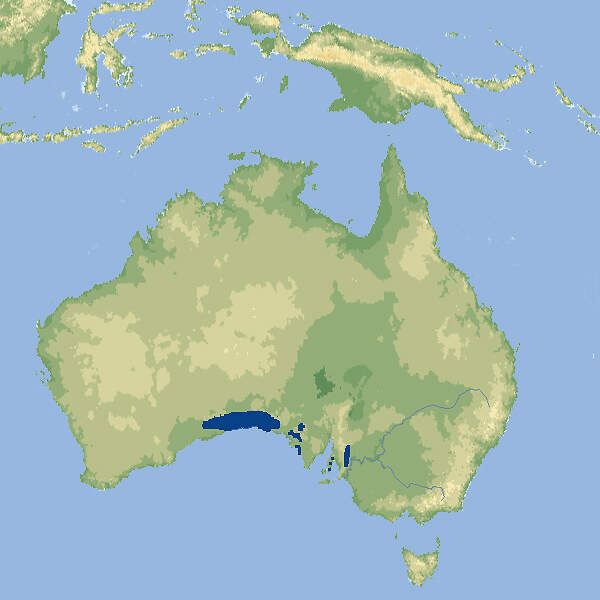
Lasiorhinus latifrons • The Southern Hairy-nosed Wombat • Le wombat à nez poilu du sud
- Körperbau und Körperfunktionen
- Verbreitung
- Lebensraum und Lebensweise
- Gefährdung und Schutz
- Bedeutung für den Menschen
- Haltung
- Taxonomie und Nomenklatur
- Literatur und Internetquellen
|
Weitere Bilder auf BioLib.cz |
Haarnasenwombats waren früher gelegentlich in europäischen Zoos zu sehen. Sie waren zum Teil recht ausdauernde Pfleglinge, es kam aber zu keiner Zucht, und sie werden seit über 40 Jahren nicht mehr gehalten. Körperbau und KörperfunktionenMit ihrem plumpen Körper, den kurzen Extremitäten und dem nur als Stummel ausgebildeten Schwanz ähneln Wombats einem Bären. Die Weibchen haben in ihrem nach hinten offenen Beutel ein Paar Zitzen. Erwachsene Südliche Haarnasenwombats erreichen ein Gewicht von 17.5-36 kg, eine Kopf-Rumpflänge von 84-111 cm und eine Schwanzlänge von 2.5-6 cm. Sie unterscheiden sich vom Nacktnasenwombat durch das Fehlen eines nackten Nasenspiegels, die deutlich größeren, zugespitzten Ohren und das seidige, weiche Fell [1; 5]. VerbreitungAustralien: Im Süden der Bundesstaaten New South Wales, South Australia und Western Australia, besonders häufig in der Salzbuschsteppe der Nullarbor-Ebene [6]. Lebensraum und LebensweiseHaarnasenwombats besiedeln halbtrockenes Grasland, offene Ebenen, Busch, Savanne und offenen Trockenwald. Sie sind sozialer als der Nacktnasenwombat und bilden Kolonien, die in ausgedehnten Bausystemen leben. Sie sind langlebig (über 15 Jahre im Freiland) und haben eine tiefe Fortpflanzungsrate, die auch von der Niederschlagsmenge abhängig ist. Nach der Paarung bildet sich aus dem Prostatatsekret des Männchens ein gelatinöser Zapfen, der den Muttermund verschließt und eine erneute Befruchtung verhindert. Nach einer Tragzeit von 21 Tagen wird aufs Mal ein Junges geboren, das 6-7 Monate im Beutel bleibt und mit etwa einem Jahr entwöhnt wird. Die Geschlechtsreife tritt mit etwa drei Jahren ein [TAGGART et al., 2008, cit. in 3;5]. Wombats können nicht schwitzen. Haarnasenwombats beginnen zu speicheln, wenn es ihnen zu warm wird, sodass Unterkiefer, Hals und Brust durchnässt und durch Verdunstung gekühlt werden [2]. Alfred BREHM [1] hielt von den geistigen Fähigkeiten der Wombats nicht eben viel. Er schreibt dazu: "Der Wombat sieht noch unbehülflicher aus, als er ist. Seine Bewegungen sind langsam, aber stätig und kräftig. Ein so stumpfsinniger und gleichgültiger Gesell, wie er ist, läßt sich nicht leicht aus seiner Ruhe bringen. Er geht seinen Weg gerade und unaufhaltsam fort, ohne vor irgend einem Hindernisse zurückzuschrecken. Die Eingebornen erzählen, daß er bei seinen nächtlichen Streifereien oft wie ein rollender Stein in Flüsse falle, an deren Ufern er trabt, dann aber, ohne sich beirren zu lassen, in der einmal genommenen Richtung auf dem Boden des Flußbettes fortlaufe, bis er irgendwo wieder freies Land gewinne, auf dem er dann mit einer Gleichgültigkeit seinen Weg fortsetze, als hätte es niemals ein Hindernis für ihn gegeben. Gefangene, welche ich beobachtete, lassen mir solche Erzählungen durchaus nicht so unglaublich erscheinen, als man meinen möchte. Es hält wirklich schwer, einen Wombat irgendwie zu erregen, obgleich man ihn unter Umständen erzürnen kann. So viel ist sicher, daß man ihn einen Trotzkopf ohne gleichen nennen muß, falls man es nicht vorziehen will, seine Beharrlichkeit zu rühmen. Was er sich einmal vorgenommen hat, versucht er, aller Schwierigkeit ungeachtet, auszuführen. Eine Höhle, welche er einmal begonnen, gräbt er mit Ruhe eines Weltweisen hundertmal wieder aus, wenn man sie ihm verstopft. Die australischen Ansiedler sagen, daß er höchst friedlich wäre und sich, ohne Unruhe oder Aerger zu verrathen, vom Boden aufnehmen und wegtragen ließe, dagegen ein nicht zu unterschätzender Gegner würde, wenn ihm plötzlich einmal der Gedanke an Abwehr durch seinen Querkopf schösse, weil er dann wüthend und in gefährlicher Weise um sich beiße. Ich kann diese Angabe bestätigen. Gefangene, welche ich pflegte, benahmen sich nicht anders. Namentlich wenn man ihnen die Füße zusammenschnürte oder sie auch nur an den Füßen packte, zeigten sie sich sehr erbost und bissen,wenn ihnen die Sache zu arg wurde, sehr boshaft zu." Gefährdung und SchutzDer Südliche Haarnasenwombat ist relativ weit verbreitet und kommt in zahlreichen Schutzgebieten vor. Er galt daher nicht als gefährdet. Weil aber viele Populationen fragmentiert und möglicherweise längerfristig nicht überlebensfähig sind, wurde er 2016 als potenziell gefährdet eingestuft (Rote Liste: LEAST CONCERN) [6]. Der internationaler Handel ist nicht durch CITES geregelt. Es gelten Ausfuhrbeschränkungen Australiens. Bedeutung für den MenschenDer Haarnasenwombat wird gebietsweise als Schädling für die Landwirtschaft angesehen und seine Bestände werden reduziert [6]. Bei der städtischen Bevölkerung ist die Wahrnehmung eine positivere, wie man aus der Existenz von Kinderbüchern schließen kann. HaltungGehege für Wombats müssen wegen deren Grabtätigkeit mit einem Untergrabschutz versehen sein und können nur minimalistisch gestaltet werden. Haarnasenwombats sind nicht so unverträglich wie Nacktnasenwombats und können paarweise oder in Kleingruppen gehalten werden. In Freianlagen ist auch die Gemeinschaftshaltung mit Kängurus, Emus und anderen Vögeln möglich [3]. Das älteste bekannte Individuum wurde 1975 im Brookfield-Zoo, Chicago, geboren und erreichte ein Alter von 34.5 Jahren. Ein in Queensland gehalteners Tier wurde etwa 30 Jahre alt [4; AZA Regional Studbook]. Haltung in europäischen Zoos: Seit Ende der 1970er Jahre gab es in Europa keine Haarnasenwombats mehr. Erst 2018 konnte der Longleat Sarai Park wieder ein Paar importieren, von dem 2021 noch ein Tier lebte. Nach dem 2. Weltkrieg wurden im deutschsprachigen Raum drei Paare Haarnasenwombats gehalten: im Zoo Berlin (1963-79), in Duisburg (1967- mindestens 1970) (www.zootierliste.de) sowie im Zoo Basel. Letzterer erhielt seine Tiere 1956. Das Weibchen starb 1975 nach 19-jähriger, das Männchen 1976 nach 20-jähriger Haltungsdauer [JB Zoo Basel, Int.Zoo Yearb.]. Das Säugetiergutachten 2014 des BMEL gibt für das Innengehege und ein fakultatives Außengehege eine Mindestfläche von 20 m² vor. Bei der Haltung mehrerer Tiere sollen ebenso viele, möglichst miteinander kombinerbare Gehege vorgesehen werden. Die Schweizerische Tierschutzverordnung (Stand 01.06.2022) schreibt für ein Paar ein Innen- und ein Außengehege von je 20 m² vor. Für weitere Tiere sind zusätzliche Gehege zu stellen. Nach der 2. Tierhaltungsverordnung Österreichs (Stand 2023) ist pro Tier ein Außengehege von 100 und ein Innengehege von 20 m² erforderlich. Nach JACKSON soll für ein Paar Wombats eine Gehegefläche von 45 m² nicht unterschritten werden [6]. Taxonomie und NomenklaturDie Art wurde 1845 von Sir Richard OWEN, einem der hervorragendsten Naturforscher des viktorianischen Zeitalters, aufgrund eines einzelnen Schädels als "Phascolomys latifrons" beschrieben. Sie ist monotypisch. Die Umbenennung der Gattung zu Lasiorhinus erfolgte 1863 durch John Edward GRAY vom Britischen Museum [5]. |
Literatur und Internetquellen
- BREHM, A. E. (1882-1887)
- JACKSON, S. M. (2003)
- PUSCHMANN, W., ZSCHEILE, D., & ZSCHEILE, K. (2009)
- WEIGL, R. (2005)
- WILSON, D. E. et al. eds. (2009-2019)
- WOINARSKI, J. & BURBIDGE, A.A. 2016. Lasiorhinus latifrons. The IUCN Red List of Threatened Species 2016: e.T40555A21959203. http://www.iucnredlist.org/details/40555/0. Downloaded on 07 September 2016.
Zurück zu Übersicht Kloaken- und Beuteltiere
Weiter zu Nacktnasenwombat (Vombatus ursinus)
Beutelteufel
Unterklasse: Beuteltiere (MARSUPIALIA)
Ordnung: Raubbeutlerartige<
(DASYUROMORPHIA)
Familie: Raubbeutler (Dasyuridae)
Unterfamilie: Beutelmarder (Dasyurinae)
 Beutelteufel
Beutelteufel
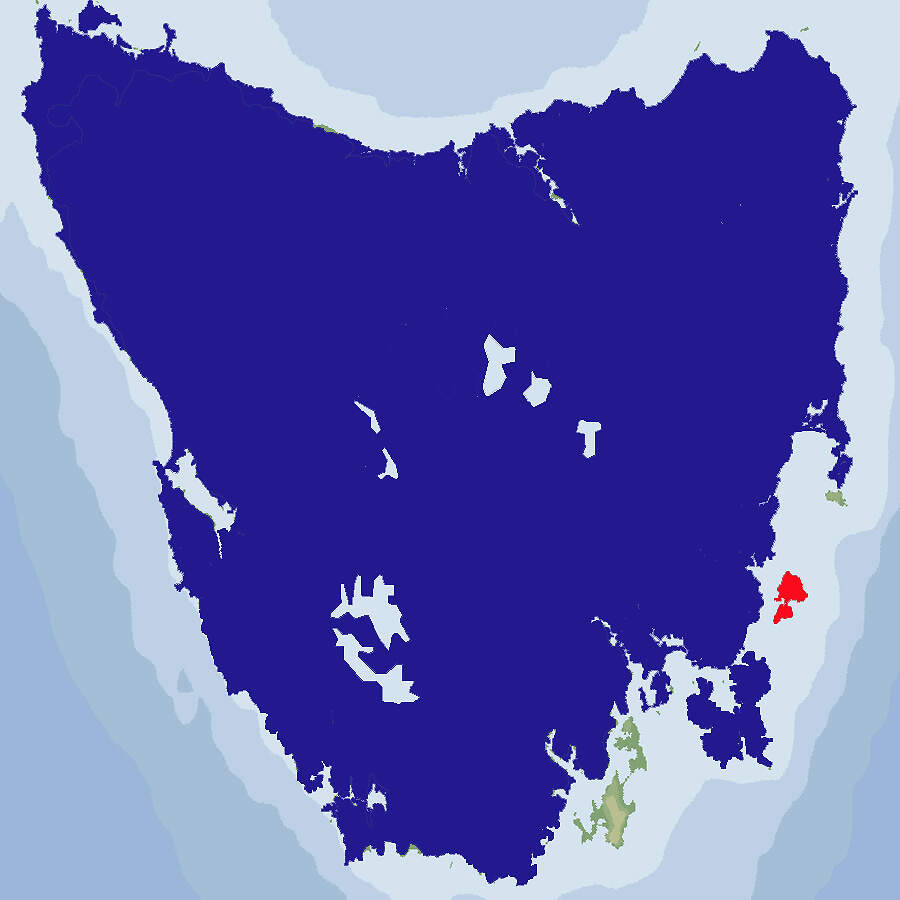
Sarcophilus harrisii • The Tasmanian Devil • Le diable de Tasmanie
- Körperbau und Körperfunktionen
- Verbreitung
- Lebensraum und Lebensweise
- Gefährdung und Schutz
- Bedeutung für den Menschen
- Haltung
- Taxonomie und Nomenklatur
- Literatur und Internetquellen
|
Weitere Bilder auf BioLib.cz |
Der Beutelteufel ist der größte noch lebende Raubbeutler. Er ist in seinem Ursprungsgebiet stark gefährdet und in europäischen Zoos, die sich um den Aufbau eine Erhaltungszuchtprogramms bemühen, nur selten zu sehen. Körperbau und KörperfunktionenMit einer Kopf-Rumpflänge von etwa 50 cm, einer Schwanzlänge von 25 cm und einem Gewicht von 7-9 kg ist der Beutelteufel der größte noch lebende Raubbeutler. Sein Kopf ist breit, der Hals dick und die Ohren sind gerundet. Die Großzehe fehlt oder ist nur rudimentär vorhanden. Er ist schwarz oder schwarzbraun gefärbt mit weißen Abzeichen an Brust, Kruppe und Schwanzwurzel. Bei Aufregung färben sich die Ohren rot. Der Beutel ist ein hufeisenfömiger, nach hinten geöffneter Hautwall. Die Weibchen haben vier Zitzen [3; 5; 13]. VerbreitungAustralien: Auf dem australischen Festland ist die Art bereits vor einigen hundert Jahren ausgestorben, wohl als Folge der Konkurrenz durch den von den Aborigines eingeführten Dingo. Heute nur noch auf der 64'030 km² großen Insel Tasmanien, dem vorgelagerten 99 km² großen Robbins Island sowie, angesiedelt, Maria Island [4]. Lebensraum und LebensweiseMit Ausnahme der höchsten Berggipfel besiedelt der Beutelteufel alle Lebensräume Tasmaniens. Bevorzugt werden offenes Waldland und Wald-Grasland Mosaike. Feuchte Eukalyptuswälder werden eher gemieden [4; 10]. Beutelteufel sind nachtaktiv. Tagsüber ruhen sie in Unterschlüpfen oder Höhlen, die sie sich zum Teil selbst bauen. Erwachsene Beutelteufel halten währen ihrer aktiven Phase eine Individualdistanz ein, suchen aber beim Schlafen und Ruhen Artgenossen zum Kontaktliegen auf. Die Beute, kleine bis mittelgroße Säuger, wie Wombats oder Wallabies, oder Vögel wird durch Bisse in die Kopfregion getötet. Zur Nahrungsaufnahme suchen Beutelteufel einen geschützten Ort auf. Beim Fressen werden sehr stark die Vorderpfoten zu Hilfe genommen. Paarungszeit ist im April-Mai. Nach einer Tragzeit von 31 Tagen werden 2-4 zunächst nur 12 mm lange Junge geboren, die während etwa 105 Tagen im Beutel bleiben. Die Jungen saugen über 8 Monate. Bis zu einem Alter von 21 Wochen werden die Jungen an den Zitzen transportiert, später auf dem Rücken. Bei Gefahr suchen die Jungen bei der Mutter Schutz. Beutelteufel erreichen im Freiland ein Alter von 5-8 Jahren. Im Zoo (Rotterdam) wurden das älteste Tier 13 Jahre alt [5; 6, 12; 13]. Beutelteufel sind weitaus weniger aggressiv und mürrisch, als ihnen zugeschrieben wird. GRZIMEK [3] bricht eine Lanze für sie: "Die kleinen Teufel, die sie (Mary Roberts) aufzog, waren reizend anhänglich, verspielt und lustig. Sogar wildgefangene Erwachsene ließen sich so zähmen, dass man gut mit ihnen umgehen konnte. Die Tiere waren sehr sauber, liebten es zu baden und zu sonnen. Sie brauchten die Vorderpfoten, um das Gesicht zu waschen, legten beide zu einer becherartigen Vertiefung zusammen, leckten sie gründlich und rieben sie dann über den Kopf." Gefährdung und SchutzInnerhalb von zehn Jahren (1997-2006) hat der Bestand des Beutelteufels um 60% abgenommen, Schuld daran ist eine Tumorerkrankung, die Devil Facial Tumour Disease (DFTD), die stets tödlich verläuft. Es ist davon auszugehen, dass sich diese Bestandsabnahme fortsetzt. Zusätzlich fallen bis über 2'200 Teufel pro Jahr dem Straßenverkehr zum Opfer und von Schafzüchtern werden immer noch welche als Schädlinge eliminiert. Die Art ist daher seit 2008 als stark gefährdet (Rote Liste: ENDANGERED) eingestuft [4]. Zwecks Aufbau einer tumorfreien Reservepopulation setzten die tasmanischen Behörden 2012/13 auf dem bislang von Beutelteufeln unbewohnten, 116 km² grossen Maria Island 28 Beutelteufel aus. Die Ansiedlung war erfolgreich: Bis 2016 hatten sich die Tiere bereits auf 100 Stück vermehrt. In anderer Hinsicht lief die Sache aber schief: Die Idee war, dass die Beutelteufel sich von den zahlreichen, schon früher auf der Insel ausgesetzten Rotbauchfilandern (Thylogale billardierii), Forester-Riesenkängurus und Bennettwallabies, deren Zahl bis dahin durch Abschüsse limitiert werden musste, ernähren sollten. Leider entdeckten die Teufel eine einfachere Nahrungsquelle: die rund 3'000 Brutpaare umfassenden Zwergpinguin-Kolonien, die sie bis 2021 vollständig ausrotteten. Auch die in Höhlen brütenden Kurzschwanz-Sturmtaucher (Puffinus tenuirostris) wurden von ihnen dezimiert, und die an sich bodenbrütenden Hühnergänse begannen auf Bäumen zu nisten, um ihre Verluste in Grenzen zu halten [10; 11]. Der internationale Handel ist nicht durch CITES geregelt. Es gelten Ausfuhrbeschränkungen Australiens. Der Beutelteufel ist der einzige Wirt des Bandwurms Dasyurotaenia robusta, der heute als gefährdet gilt und nicht überleben wird, wenn der Beutelteufel aussterben sollte. Zoogestütztes Artenschutzprojekt (Beispiel):
Bedeutung für den MenschenWirtschaftliche Bedeutung: Weil Beutelteufel auch Lämmer töten und fressen, wurden sie in der Vergangenheit intensiv verfolgt, d.h. abgeschossen oder vergiftet, bis in die 1990er-Jahre bisweilen mehr als 5'000 Tiere pro Jahr. Kulturelle Bedeutung: In der Zeichentrickfilm-Serie "Looney Tunes" der WARNER Bros. ist der Tasmanische Teufel "TAZ" der etwas dümmliche Gegenspieler des Hasen "Bugs Bunny". Auf die Kritik der tasmanischen Regierung, dass WARNER Bros mit der Trickfilfigur Millionen scheffle, währenddem die Tierart ihrem Untergang entgegen gehe, reagierte die Firma schließlich dadurch, dass sie begann, Forschungsarbeiten und Schutzmaßnahmen gegen die Devil Facial Tumour Disease (DFTD) finanziell zu unterstützen [Sydney Morning Herald vom 20. Juni 2006]. HaltungEine Vergesellschaftung mit Grauen und Roten Riesenkängurus wurde im Zoo Pairi Daiza praktiziert. Haltung in europäischen Zoos: Früher im deutschen Sprachraum in etwa 10 Zoos, zuletzt in Duisburg und Köln, in ganz Europa gegen 20. 2012 Neuanfang mit Importtieren in Kopenhagen, wo es mehrmals zu Nachzuchten kam, die an andere Zoos verteilt wurden, und weiteren Importen aus Tasmanien. 2023 war die Art wieder mit gegen 20 Tieren in fünf Zoos vertreten. Für Details siehe Zootierliste. Zucht: Im Kölner Zoo wurden Beutelteufel bereits in den 1870er Jahren gehalten und 1883 kam es gar zur Geburt von zwei Jungtieren, über deren Aufzucht und Verbleib allerdings nichts bekannt ist [1]. Im April 1958 wurde im Zoo Basel ein junger Beutelteufel geboren, der aber nur etwa zwei Wochen überlebte [8]. Die Basler Tiere waren 1957 importiert worden. Sie starben 1962 nach rund fünf Jahren Haltungsdauer an tumorartigen Erkrankungen, der Rüde an einem Plattenepithelkarzinom und die Fähe an einem bösartigen Nierenmarkblastom (90. JB Zoo Basel). Erfolgreiche Europäische Erstzucht 1971 im Zoo Neuwied, danach erfolgreiche Zuchten auch in Duisburg, Köln und Kopenhagen [2; 7]. Mindestanforderungen an Gehege: Das Säugetiergutachten 2014 des BMEL gibt vor, dass jedem Tier außen und innen mindestens je 20 m² zur Verfügung zu stellen sind. Als Mindestgehegegröße seien 40 m² vorzuhalten, die bei Bedarf unterteilt werden können. In Österreich (Stand 2023) ist die Haltung eines Paars in einer Außenanlage von ebenfalls 40 m² verpflichtend. Beutelteufel dürfen aber ganzjährig im Freigehege gehalten werden, sofern ein frostfreier und wettergeschützter Unterschlupfraum zur Verfügung steht. Die Schweizerische Tierschutzverordnung (Stand 01.06.2022) schreibt für ein Paar ein unterteilbares Außengehege von mindestens 20 m² und eine unterteilbare Stallfläche von 6 m² vor. Fakt ist, dass Beutelteufel in Tasmanien unter denselben Klimabedingungen leben, wie Bennettkängurus, für die das BMEL-Gutachten lediglich einen Unterstand vorsieht. Die Forderung nach einem Innengehege von 40 m² zusätzlich zum Außengehege ist daher unbegründet. Beim Außengehege ist die Strukturierung wohl wichtiger als die Fläche an sich. Im Kölner Zoo wurden in den 1980er Jahren Beutelteufel in einem räumlich aufgeteilten System von je 4 Innen- und Außenkäfigen zu 250 x 180 x 250 cm, in denen die Tiere frei zirkulieren konnten, erfolgreich gehalten und gezüchtet [7]. Das entsprach einem Gesamt-Raumangebot von 36 m². Taxonomie und Nomenklatur1808 beschrieb der britische Kolonialbeamte George Prideaux Robert HARRIS den Beutelteufel als "Didelphys ursina", wobei dieser Name allerdings bereits durch den Nacktnasenwombat belegt war. Die Gattung Sarcophilus, der auch noch drei fossile Arten angehören, wurde 1837 vom Direktor der Ménagerie von Paris, Georges CUVIER, aufgestellt. 1841 bezeichnete der französische Geologe und Botaniker Pierre BOITARD die Art als "Ursus harrisii". 1912 wurde die Artbezeichnung harrisii mit dem von CUVIER vergebenen Gattungsnamen kombiniert [1; 13]. |
Literatur und Internetquellen:
- BECKER, R. (2016)
- GEWALT, W. (1980)
- GRZIMEK, B. (1966)
- HAWKINS, C.E. et al. (2008). Sarcophilus harrisii. The IUCN Red List of Threatened Species 2008: e.T40540A10331066. http://www.iucnredlist.org/details/40540/0. Downloaded on 14 May 2018.
- JACKSON, S. M. (2003)
- KÄSTNER, K. (1978)
- KÜHME, W. (1983)
- LANG, E. M. (1958)
- PUSCHMANN, W., ZSCHEILE, D., & ZSCHEILE, K. (2009)
- THALMANN, S., PECK, S., WISE, P., POTTS, J. M., CLARKE, J. & RICHLEY, J. (2015)
- THE GUARDIAN vom 21.06.2021
- WEIGL, R. (2005)
- WILSON, D. E. et al. eds. (2009-2019)
- ZOO ZÜRICH - WEBSITE UND PM VOM 06.11.2020
Zurück zu Übersicht Kloaken- und Beuteltiere
Weiter zu Beutelwolf (Thylacinus cynocephalus) †