Schwarzes Löwenäffchen
Überordnung: EUARCHONTOGLIRES
Ordnung: Affen und Halbaffen (PRIMATES)
Unterordnung: Affen (Simiae / Haplorrhini)
Teilordnung: Eigentliche Affen (Simiiformes)
Überfamilie: Neuwelt- oder Breitnasenaffen (Platyrrhini)
Familie: Krallenaffen (Callitrichidae)
 Schwarzes oder Goldsteiß-Löwenäffchen
Schwarzes oder Goldsteiß-Löwenäffchen
Leontopithecus chrysopygus • The Golden-rumped Lion Tamarin • Le tamarin lion à croupe dorée
- Körperbau und Körperfunktionen
- Verbreitung
- Lebensraum und Lebensweise
- Gefährdung und Schutz
- Bedeutung für den Menschen
- Haltung
- Taxonomie und Nomenklatur
- Literatur und Internetquellen
|
Weitere Bilder auf BioLib |
Für das in seinem Ursprungsgebiet stark gefährdete Schwarze Löwenäffchen führen die Zoos ein internationales Zuchtbuch und betreiben ein Europäisches Erhaltungszuchtprogramm, das wegen einer zu schmalen genetischen Basis allerdings in den letzten Zügen liegt. Der stark ingezüchtete Restbestand könnte nur erhalten werden, wenn aus den brasilianischen Zuchtstationen neues Blut zugeführt würde. Körperbau und KörperfunktionenSchwarze Löwenäffchen haben eine Kopf-Rumpflänge von 29 (25-30) cm und eine Schwanzlänge von 38 (36-41) cm. Erwachsene wiegen 540-690 g, wobei Männchen in Mittel etwas schwerer sein sollen als Weibchen. Sie haben längere Hände und Finger als andere Krallenaffen, die es ihnen erlauben, tierische Beute leichter aus Ritzen und Bromelientrichtern herauszuklauben. Die Haut des praktisch nackten Gesichts ist unterschiedlich stark graubraun pigmentiert. Das Gesicht ist von einer schwarzen aufrichtbaren Mähne umgeben. Auch das übrige Fell ist schwarz, ausgenommen die Stirn, der Steiß, die Oberschenkel und die Schwanzwurzel, die gold- bis rötlichbraun sind [5; 7]. VerbreitungTropisches Südamerika: Brasilien (Bundesstaat São Paulo) [3]. Lebensraum und LebensweiseDas Schwarze Löwenäffchen ist die Löwenäffchen-Art, die am weitesten im Landesinneren vorkommt. Sie bewohnt Flussuferwälder, die in ihrer Ausprägung dem atlantischen Küstenwald entsprechen. Sie ist auf primären tropischen Regenwald angewiesen, kommt aber auch im teilweise laubabwerfenden Wald vor. Die Tiere halten sich dort etwa 3-15 m über dem Boden in von dichten Epiphyten und Unterwuchs gekennzeichneten Schichten auf [3; 5]. Die Tiere sind tagaktiv und ziehen kurz nach Sonnenaufgang zur Futtersuche los. Zum Schlafen benutzen sie Baumhöhlen. Sie ernähren sich von Früchten (hauptsächlich von Jerivá-Palmen (Syagrus romanzoffiana) und Myrtaceen), Blüten, Nektar, Baumexsudaten und Kleintieren, zur Hauptsache Wirbellosen. Sie leben typischerweise in Gruppen von 4-8 Tieren, darunter ein erwachsenes Weinchen und 1-2 geschlechtsreife Männchen. Die Streifgebiete sind mit 113-277 ha vergleichsweise groß [3: 5;7]. Über die Fortpflanzung im Freiland ist wenig bekannt. wie bei anderen Löwenäffchen dürfte die Trächtigkeit etwa 125 Tage dauern. Die Jungen, in der Regel Zwillinge, kommen meist im Oktober-November zur Welt [7]. Gefährdung und SchutzDa der Lebensraum der Schwarzen Löwenäffchen größtenteils durch Abholzung zerstört wurde und weiter zerstört wird, sind die wenigen übriggebliebenen Bestände stark isoliert. Diese kleinen Populationen sind außerdem genetisch verarmt und leiden unter Inzucht. Die Wahrscheinlichkeit ist groß, dass sie aussterben würden, wenn nicht ein aktives Metapopulations-Management betrieben würde. Dank intensiven Schutzmaßnahmen seit 1986, letztmals überprüft 2008, gilt die Art zumindest nicht mehr als unmittelbar vom Aussterben bedroht, sondern "nur noch" als stark gefährdet, zumal auch die ex situ-Population in Brasilien zunimmt (Rote Liste: ENDANGERED) [3; 4]. 1979 konnten drei Tiere der zuvor ausgestorben geglaubten Art im Morro do Diabo-Reservat beobachtet werden konnten. 1976 wurde eine weitere Reliktpopulation in einem Waldstück im Bundesstat São Paulo entdeckt. Heute sind elf voneinander isolierte Populationen mit einem Gesamtbestand von etwa 1'000 erwachsenen Tieren bekannt, davon ist allerdings nur der Bestand im im Morro do Diabo-Reservat längerfristig lebensfähig. Ansonsten ist ein aktives Metapopulations-Management erforderlich, das sowohl Umsiedlungen von Tieren zwischen wilden Populationen als auch die Ansiedlung von ex situ-Nachzuchttieren umfasst [4]. Der internationale Handel ist durch CITES-Anhang I eingeschränkt. Bedeutung für den MenschenDie Rote Liste der IUCN enthält keine Angaben über eine lokale Nutzung der Art [3]. Von 1977-2017 bewilligte Brasilien wenig Wissenschaftsmaterial von wildlebenden Individuen zur Ausfuhr und nur im Jahr 1990 sechs lebende Wildfänge. Im selben Zeitraum (effektiv ab 1989) wurden weltweit 75 Nachzuchttiere international abgegeben, wichtigste Ausfuhrländer waren Brasilien und Jersey [2]. Haltung1973 wurde mit sieben Tieren in Brasilien die erste ex-situ-Kolonie gegründet. 1986 erhielt der Zoo von São Paulo 14 Tiere, die aus einem durch einen Staudamm gefluteten Gebiet gerettet werden konnten [11]. Das nach WEIGL älteste bekannte Schwarze Löwenäffchen erreichte im Zuchtzentrum von Rio de Janeiro ein Alter von 17 Jahren und 11 Monaten [6]. Nach den "Best practice"-Leitlinien der EAZA soll Löwenäffchen tagsüber ein Gesamtvolumen (innen / außen) von 32.5 m³ (3+10 m² / 2.5 m hoch) zur Verfügung stehen, wobei das Gehege unterteilbar sein soll [1]. 1991 erhielt der Jersey Zoo als erste europäische Institution 3.3 Tiere. 1992 kam es zur zur erfolgreichen europäischen Erstzucht. Im Zoo Magdeburg, wo 1995 die deutsche Erstzucht gelang, wurden die Schwarzen Löwenäffchen problemlos gemeinsam mit Sakis (Pithecia pithecia) gehalten [10]. Eine Gemeinschaftshaltung gab es auch mit den an sich eher unverträglichen Saguinus bicolor und Saguinus oedipus. Über den Erfolg dieser Vergesellschaftung werden keine Angaben gemacht [1]. Seit 1989 existiert ein Internationales Zuchtbuch (ISB), das am Durrell Wildlife Conservation Trust auf Jersey geführt wird [9]. Dieses umfasste im Februar 2016 insgesamt 48 lebende Individuen in 5 Einrichtungen [IZY 52]. Haltung in europäischen Zoos: Seit 2006 gibt es ein Europäisches Erhaltungszuchtprogramm, das vom Jersey-Zoo als "New Style-EEP" koordiniert wird. Das Programm erreichte im Jahr 2010 die höchste Individuenzahl mit 115 Tieren. Seitdem hat der Bestand in Europa drastisch abgenommen. Gegenwärtig (2023) wird die Art nur noch in Jersey gehalten. Die verbleibenden Tiere sind stark ingezüchtet. Der europäische Bestand könnte deshalb nur erhalten werden, wenn er durch Nachzuchttiere aus dem Zoo von São Paulo Zoo und dem Primatenzentrum Rio de Janeiro gestützt würde. Für Details siehe Zootierliste. Wie Löwenäffchen gehalten werden (Beispiele):
Mindestanforderungen an Gehege: Die auf dem Tierart-Datenblatt für den Rotbauchtamarin gemachten Angaben zum Säugetiergutachten 2014 , zur Stellungnahme der Tierschutzsachverständigen der Zoos und zu den EAZA-Haltungsrichtlinien [1] gelten auch für diese Art. Die Schweizerische Tierschutzverordnung (Stand 01.06.2022) schreibt für bis zu 5 Tieren ein Innengehege mit einer Fläche von 3 m² und 2 m Höhe vor. Für jedes weitere Adulttier ist die Fläche um 0.5 m² zu ergänzen. Nach der 2. Tierhaltungsverordnung Österreichs (Stand 2023) muss die Haltung paarweise oder in kleinen Familiengruppen erfolgen. Dazu ist ein Innengehege mit einer Fläche von 10 m² und einer Höhe von 2.5 m erforderlich. Taxonomie und NomenklaturFür die Wissenschaft entdeckt wurde das Schwarze Löwenäffchen 1822 von dem Wiener Naturforscher Johann Baptist NATTERER, der acht Exemplare in der Nähe von Sorocaba im brasilianischen Bundesstaat São Paulo sammelte [11]. Beschrieben wurde es im folgenden Jahr durch Johann Christian MIKAN aus Teplitz, der an der Prager Universität als Naturkunde-Professor tätig war. 1902 und 1905 gelangten nochmals vier Exemplare in Museen. Danach galt die Art als verschollen bis 1970 zwei weitere Stopfpräpaarte auftauchen und drei Tiere im Morro do Diabo-Reservat beobachtet werden konnten. Zum heute gültigen Gattungsnamen kam die Art durch den französischen Arzt und Naturforscher René Primevère LESSON, der 1840 einen "Leontopithecus marikina" beschrieb, bei dem es sich herausstellte, dass dieser mit dem Goldenen Löwenäffchen identisch war. Als Gattungssynonym war sehr lange "Leontocebus" im Umlauf, ferner der auch in GRZIMEKs Tierleben verwendete Name "Leontideus". Bis 2000 wurden die verschiedenen Löwenäffchen-Formen als Unterarten, seitdem als Arten eingestuft. Sie haben kleine, voneinander deutlich getrennte Verbreitungsgebiete, sodass es im Freiland nicht zu Hybridisierungen kommen kann [3; 5; 8; 9]. |
Literatur und Internetquellen
- CARROLL, B. (ed., 2002) / BARRÃO RUIVO, E. (ed. 2010)
- CITES TRADE DATA BASE
- KIERULFF, M.C.M. et al. (2008). Leontopithecus chrysopygus. The IUCN Red List of Threatened Species 2008: e.T11505A3290864. http://www.iucnredlist.org/details/11505/0. Downloaded on 18 May 2018.
- MAMEDE-COSTA, C. & GOBBI, N. (1998)
- SCHRÖPEL, M. (2010)
- WEIGL, R. (2005)
- WILSON, D. E. et al. eds. (2009-2019)
- WILSON, D. E. & REEDER, D. M. (2005)
- WORMELL, D. (2013)
- ZIEGLER, T. (2002a)
- KLEIMAN, D. G. & RYLANDS, A. B. (eds., 2002)
Zurück zu Übersicht Spitzhörnchen, Halbaffen und Affen
Weiter zu Springtamarin (Callimico goeldii)
Tigerpython
Ordnung: Schuppenkriechtiere (SQUAMATA)
Unterordnung: Schlangen (SERPENTES)
Überfamilie: Wühl- und Riesenschlangenartige (Booidea / Pythonoidea)
Familie: Pythons (Pythonidae)

Tigerpython
Python molurus / bivittatus • The Asiatic Rock Python • Le python molure
- Körperbau und Körperfunktionen
- Verbreitung
- Lebensraum und Lebensweise
- Gefährdung und Schutz
- Bedeutung für den Menschen
- Haltung
- Taxonomie und Nomenklatur
- Literatur und Internetquellen
|
Weitere Bilder auf BioLib.cz |
Tigerpythons sind mit bis zu 7 m Länge wahre Riesen und gehören zu den Prototypen der Würgeschlangen, die selbst mittelgroße Hirsche töten und verschlingen können. Sie werden sehr häufig im Zoo gezeigt Körperbau und KörperfunktionenDie meisten Tiere werden nicht länger als 3.7 m, es gibt jedoch zuverlässige Belege über 6 m lange und Berichte über gegen 8 m lange Individuen. Der Kopf ist ziemlich klein, dreieckig und deutlich vom Hals abgesetzt, der Körper relativ plump, der Schwanz mäßig lang und greiffähig. Das Auge ist mäßig groß und hat eine Schlitzpupille. Grubenorgane zur Ortung von Wärmeunterschieden finden sich nur an den ersten beiden oberen Labialschuppen. Es sind Analsporen vorhanden. Die Grundfärbung ist weißlich bis hellbraun. Sie wird bis auf ein Gittermuster überlagert von hell- oder dunkelbraunen, oft schwärzlich gesäumten Flecken. Auf dem Kopf befindet sich ein Y-förmiger Fleck [3; 5; 6; 8]. VerbreitungSüd- und Südostasien: Bangladesch, Burma, Südchina, Hongkong, Indien, Indonesien (fehlt auf Sumatra und Borneo, kommt in Java, Bali, Sulawesi und den kleinen Sundainseln Lombok und Sumbawa vor), Kambodscha, Laos, Malaysia, Nepal, Pakistan, Sri Lanka, Thailand, Vietnam: Bei den Vorkommen in Indonesien stellt sich Frage, ob es sich um Reliktbestände handelt, oder ob die Populationen auf vom Menschen verschleppte Tiere zurückgehen [1; 9; 10]. Lebensraum und LebensweiseDer tag- wie nachtaktive Tigerpython besiedelt unterschiedliche Lebensräume wie Grasland, Sümpfe, Flussauen, Wälder und felsiges Gelände, aber stets in Wassernähe. Das Nahrungsspektrum umfasst größere Säugetiere (z.B. Hirsche], Vögel sowie Reptilien und Amphibien. Wie alle Arten seiner Familie ist der Tigerpython eierlegend. Die aus 20-50 und bis zu 100 Eiern Gefährdung und SchutzNach einer Beurteilung aus dem Jahr 1996 wurde der Tigerpython als Art molurus als potenziell gefährdet (Rote Liste: NEAR THREATENED) eingestuft. Dies wurde 2019 überprüft und bestätigt. bivittatus, 2009 als eigene Art beschrieben, gilt aufgrund einer Beurteilung aus dem Jahr 2011 als gefährdet (VULNERABLE) [9]. Der internationale Handel mit Exemplaren der Nominatform ist nach CITES Anhang I eingeschränkt, jener mit Exemplaren der Unterart bivittatus ist nach Anhang II geregelt. Bedeutung für den MenschenÜber den Tigerpython gibt es aus dem Altertum phantasievolle Berichte. So soll der seleukidische Diplomat MEGASTHENES (360-290 v. Chr.), der Gesandter am Königskof des indischen Maurya-Reichs war, geschrieben haben, in Indien würden die Schlangen so groß, dass sie Hirsche und Ochsen ganz verschlingen könnten [2]. Von dieser Mär stammt übrigens der Name "Boa", denn Rind heißt auf Altgriechisch "βοῦς". Faktisch machen sich Tigerpythons bestenfalls dadurch unbeliebt, dass sie gelegentlich in Stallungen eindringen und Hühner oder Schweine erbeuten [6]. Die Art befindet sich im Reptilleder- und Heimtierhandel. Von 2001-2016 meldete Vietnam die Ausfuhr von 15'006, Malaysia jene von 3 Wildfängen von P. m. bivittatus. Im selben Zeitraum wurde von den südostasiatischen Ländern die Ausfuhr von 72'289 Häuten sowie zahlreicher anderer Teile und Erzeugnisse gemeldet. P. m. molurus wurden weder lebend noch tot mit CITES-Dokumenten aus den Ursprungsländenr ausgeführt. Ebenfalls von 2001-2016 wurden weltweit 92 Nachzuchttiere von P. m. molurus und 140'785 von P. m. bivittatus international verschoben. Wichtigste Ausfuhrländer waren Vietnam mit über 110'000 und Tschechien mit über 26'000 Tieren [4]. HaltungDer Tigerpython gehört zu den "Gefahrtieren", deren Haltung in manchen deutschen Bundesländern unter sicherheitspolizeilichen Aspekten eingeschränkt oder geregelt ist. Die Deutsche Gesellschaft für Herpetologie und Terrarienkunde (DGHT) und der Verband Deutscher Verein für Aquarien- und Terrarienkunde (DVA) haben zu dieser Thematik einen Leitfaden herausgegeben [12]. Für die Haltung wird ein sehr geräumiges, beheiztes, mit UV-Lampen ausgestattetes Feuchtterrarium mit fest eingebautem Wasserbecken empfohlen, das ein Drittel bis die Hälfte der Grundfläche einnehmen soll. Ein Kletterbaum ist nicht unbedingt erforderlich. Als Bodensubstrat eignen sich z.B. Torf oder Rindenmulch. Die Lufttemperatur soll tagsüber 24-30ºC betragen, nachts etwa 6ºC weniger. Die Wassertemperatur soll bei 22-28ºC liegen. Eine angemessene Temperatur wird durch eine teilweise unter dem Badebecken befindliche Bodenheizung in Kombination mit Wärmelampen erreicht. Die Beleuchtung soll 12-14 Stunden in Betrieb sein [5; 6; 9]. Von dem etwas größeren bivittatus werden häufig Albinos und andere Farbmutationen gehalten. Die sogenannten "Golden Thai Pythons" gehen alle auf ein einziges Männchen zurück, das 1979 in Nordost-Thailand gefunden wurde und im Pata-Zoo in Bangkok, der sich im 6./7. Stock des Pata-Kaufhauses befindet, mit einem normalfarbigen und einem ebenfalls teilalbinotischen Weibchen verpaart wurde. Die Nachzucht wurde anfänglich zu Phantasiepreisen von 5'000 USD / Stück gehandelt [11]. In den USA, wo die private Wildtierhaltung wenig reguliert ist, wurden Tigerpythons in Florida von überforderten Haltern freigelassen und haben in den Everglades und anderswo auf dem Festland, auf den Florida Keys und auf Puerto Rico umfangreiche Populationen gebildet, die mittlerweile bekämpft werden [9]. Haltung in europäischen Zoos: Wildfarbene Tigerpythons werden in etwa 290 Institutionen gezeigt, von denen sich etwa 50 im deutschsprachigen Raum befinden. Mit Abstand am häufigsten zu sehen ist der Dunkle Tigerpython (Python (molurus) bivittatus). Etwa 80 Zoos halten nur oder zusätzlich Farbmutanten. Für Details siehe Zootierliste. Mindestanforderungen an Gehege: Nach Reptiliengutachten 1997 des BMELF soll ein Terrarium für zwei über 2.5 m lange Tiere mindestens 0.75x so lang und 0.5x so breit sein wie die Gesamtlänge eines Tieres. Die Höhe soll die Hälfte der Gesamtlänge betragen. Für jedes weitere Tier ist das Terrarienvolumen unter Beibehaltung der Proportionen um 20% zu erhöhen.Die Schweizerische Tierschutzverordnung (Stand 01.06.2022) schreibt für 1-2 Tiere ein Gehege vor, dessen Grundfläche dem 1.0x0.5-fachen und dessen Höhe dem 0.75-fachen der Gesamtlänge eines Tiers entsprechen. Die 2. Tierhaltungsverordnung Österreichs (Stand 2023) verlangt für 1-2 erwachsene Tiere eine Grundfläche von 2 m² bei einer Höhe von 180 cm. Für jedes weitere Adulttier ist die Grundfläche um 0.8 m² zu erhöhen. Taxonomie und NomenklaturDer Tigerpython wurde 1758 von Carl von LINNÉ als "Coluber molurus" beschrieben. Der Name Python molurus geht auf John Edward GRAY (1842)von der Londoner zoologischen Gesellschaft zurück. In der Regel werden zwei Unterarten (bzw. seit 2009 zwei Arten) anerkannt: Python molurus molurus aus dem vorderindischen und Python molurus bivittatus aus dem hinterindischen Raum. Eine dritte Unterart (pimbura ) wurde aus Sri Lanka beschrieben, aber die Unterschiede zu molurus wurden schon bald einmal als nicht ausreichend betrachtet, um eine Unterart zu rechtfertigen. Der Tigerpython ist nahe mit dem Afrikanischen Felsenpython (Python sebae) verwandt [1; 5; 10]. |
Literatur und Internetquellen
- BELLOSA, H., DIRKSEN, L. & AULIYA M. (2007)
- BREHM, A. E. (1882-1887)
- CITES IDENTIFICATION MANUAL
- CITES TRADE DATA BASE
- MATTISON, C. (2007)
- MEHRTENS, J. M. (1993)
- NIETZKE, G. (1969)
- O'SHEA, M. & HALLIDAY, T. (2002)
- STUART, B., NGUYEN, T.Q.et al. (2012). Python bivittatus. The IUCN Red List of Threatened Species 2012: e.T193451A2237271. http://www.iucnredlist.org/details/193451/0. Downloaded on 14 October 2017 und
AENGALS, A., DAS, A., MOHAPATRA, P. et al. 2021. Python molurus. The IUCN Red List of Threatened Species (2021): e.T58894358A1945283. https://dx.doi.org/10.2305/IUCN.UK.2021-2.RLTS.T58894358A1945283.en. Accessed on 23 July 2023. - THE REPTILE DATA BASE (P. bivittatus)
- TRUTNAU, L. (2002)
- DGHT/DVA (Hrsg. 2014)
Zurück zu Übersicht Schlangen
Weiter zu Königspython (Python regius)
Rote Elefantenspitzmaus
Überordnung: AFROTHERIA
Taxon ohne Rang: AFROINSECTIPHILIA
Ordnung: Rüsselspringer (MACROSCELIDEA)
Familie: Rüsselspringer (Macroscelididae)

Rote Elefantenspitzmaus
Elephantulus rufescens • The Rufous Elephant-shrew or Rufous Sengi • Le macroscélide roux
- Körperbau und Körperfunktionen
- Verbreitung
- Lebensraum und Lebensweise
- Gefährdung und Schutz
- Bedeutung für den Menschen
- Haltung
- Taxonomie und Nomenklatur
- Literatur und Internetquellen
|
Weitere Bilder auf BioLib |
Die Rote Elefantenspitzmaus ist ein wenig bekannter Kleinsäuger, der durch seine Gestalt fasziniert und als tagaktives Tier das Zoopublikum zu interessieren vermag. Auffällig sind ihre namengebende, lange und bewegliche Schnauze, mit der sie nach Insekten sucht, sowie die verlängerten Fersen, die ihr Sprungvermögen erhöhen und ihr eine schnelle Flucht ermöglicht. Leider ist die als Botschafter für Naturschutz in Ostafrika bestens geeignete Art in europäischen Zoos noch nicht häufig zu sehen. Körperbau und KörperfunktionenRote Elefantenspitzmäuse erreichen eine Kopf-Rumpflänge von 10-20 cm, eine Schwanzlänge von etwa 11-16 cm und ein Gewicht von 57 205 (47-70) g. Das Fell ist lang und weich, seine Farbe ziemlich variabel, sandfarben, graubraun oder braunorange, auf der Unterseite weiß oder hellgrau. Es sind weiße Ringe um die großen Augen und ein dunkler Wangenfleck vorhanden. Bei Erwachsenen sind Hände und Füße weiß, bei Jungtieren braun. Die Schnauze ist mäßig verlängert. Die Hinterbeine sind länger als die vorderen, an allen Füßen befinden sich 5 Zehen. Der Schwanz ist dünn und nur spärlich behaart. Im Bereich des Brustbeins befindet sich eine Duftdrüse, die zur Territoriumsmarkierung eingesetzt wird. Die Weibchen haben drei Paar Zitzen. Die Hoden befinden sich in der Bauchhöhle [1; 2; 3; 7]. VerbreitungOstafrika : Äthiopien, Kenia, Somalia, Sudan, Tansania, Uganda [4]. Lebensraum und LebensweiseDie Rote Elefantenspitzmaus besiedelt unterschiedlichste Lebensräume wie Regenwald, Trockensvannen, Dornbusch, Grassteppen, Dünen und Wüsten. Die Tiere sind überwiegend tag- und dämmerungsaktiv. Zum Schlafen benützen sie aufgegebene Nagetierbaue, Termitenbaue, natürliche Felshöhlen und -spalten sowie Hohlräume unter umgefallenen Baumstämmen. Manche Tiere bauen auch Nester. Sie leben einzeln oder in lockeren monogamen Paarbeziehungen, in der die Weibchen dominieren, sind territorial und patrouillieren ihre etwa ein Drittel ha großen Territorien auf einem festen System von Wechseln. Die Territoriumsmarkierung erfolgt mittels Duftmarken der Sternaldrüse und vermutlich mit Urin und Kot. Die Tiere ernähren sich von Wirbellosen wie Erntetermiten (Odontotermes), Ameisen, Käfern, Grillen und Heuschrecken, nehmen aber auch Pflanzenmaterial, etwa Früchte der Lippenblütler-Art Premna resinosa zu sich. Die weibchen können mehrmals im Jahr trächtig werden. Nach einer Tragzeit von 57-65 Tagen wird meist ein einzelnes Junges geboren, bisweilen zwei. Die bei der Geburt etwa 10 g schweren Jungen sind weit entwickelt und verlassen das Nest bereits nach 1-2 Tagen. Mit 25-30 (18-36) Tagen werden sie entwöhnt. Mit 50 Tagen sind die jungen Weibchen bereits geschlechtsreif. Die Weibchen können bereits einen Tag nach einer Geburt wieder erfolgreich gedeckt werden [1; 2; 4]. Gefährdung und SchutzDie Art hat eine sehr weite Verbreitung, nutzt unterschiedliche Lebensräume und kommt in zahlreichen Schutzgebieten vor. Aufgrund einer Beurteilung aus dem Jahr 2013 wurde sie deshalb als nicht-gefährdet eingestuft, obwohl es keine Angaben über die Bestandsentwicklung gibt [4]. Der internationale Handel ist durch CITES nicht geregelt. Bedeutung für den MenschenDie Rote Elefantenspitzmaus wird in der Malariaforschung eingesetzt [1]. HaltungIm Frankfurter Zoo wurden Rote Elefantenspitzmäuse mit Buschschliefern vergesellschaftet. 1976 erhielt der National Zoo in Washington D.C. 22 Rote Elefantenspitzmäuse. Die Tiere wurden in Behältern von 0.55, 1.40 und 6.58 m² gehalten. Von den meisten Tieren gab es Nachzuchten, allein 1977-78 wurden von 25 Weibchen 106 Junge in 77 Würfen geboren, die zum Teil an andere Zoos abgegeben wurden. Trotz erfolgreicher Zucht über mehrere Generationen erlosch der Bestand 1985 aus unbekannten Gründen [8; 9]. Nach WEIGL erreichten mehrere in Nordamerika gehaltene Individuen ein Alter von über 7 Jahren [5]. Die mittlere Lebensdauer gehaltener Tiere wird mit 3.5 Jahren angegeben, bei wildlebenden Tiere wird von 1-1.5 Jahren ausgegangen [1]. Haltung in europäischen Zoos: In Europa wird die Art nur in sehr wenigen Zoos gehalten, gegenwärtig (Ende 2022) nur noch in Frankfurt und Düsseldorf. Die Tiere gehen auf die Zucht des Kölner Zoos zurück. Für Details siehe Zootierliste. 2008 bezog der Kölner Zoo von einem Privathalter in Tansania 2.2 Wildfänge. Nach einer Totgeburt kam es am 12. Dezember 2009 zur europäischen Erstzucht. Auch ein Paar bestehend aus einem Wildfang-Weibchen und einem in Köln geborenen Männchen hat erfolgreich gezüchtet. Bis 2014 kamen in Köln 28 Jungtiere zur Welt, von denen ein Teil an verschiedene Zoos abgegeben wurde, wo manchenorts auch die Nachzucht gelang [3; 8]. Mindestanforderungen an Gehege: Weder im Säugetiergutachten 2014 des BMEL noch in den Verordnungen Österreichs und der Schweiz wird auf die Art Bezug genommen. Im Säugetiergutachten heißt es lediglich, dass andere Elefantenspitzmäuse mehr Platz brauchten als der Kurzohr-Rüsselspringer. Taxonomie und NomenklaturDie Rote Elefantenspitzmaus wurde 1878 von Wilhelm Karl Hartwig PETERS, dem zweiten Direktor des Zoologischen Gartens Berlin als "Macroscelides rufescens" beschrieben. Später kam sie in die von dem englischen Zoologen Michael Rogers Oldfield THOMAS und seinem deutschen Berufskollegen Harold SCHWANN 1906 aufgestellte Gattung Elephantulus, welche gegenwärtig 10 Arten umfasst Es werden meist 6 verschiedene Unterarten unterschieden [2; 6]. |
Literatur und Internetquellen
- ANIMAL DIVERSITY WEB
- KINGDON, J., HAPPOLD, D., BUTYNSKI, T. HOFFMANN, M., HAPPOLD, M., KALINA, J. (Hrsg. 2013)
- OLBRICHT, G. & SLIWA, A. (2010)
- RATHBUN, G.B. (2015). Elephantulus rufescens. The IUCN Red List of Threatened Species 2015: e.T42664A21289073. http://www.iucnredlist.org/details/42664/0. Downloaded on 23 May 2018.
- WEIGL, R. (2005)
- WILSON, D. E. & REEDER, D. M. (2005)
- WILSON, D. E. et al. eds. (2009-2019)
- OLBRICHT, G. & SLIWA, A. (2014)
- RATHBUN, G.B., BEAMAN, P. & MALINIAK, E. (1981)
Zurück zu Afrotheria
Weiter zu Kurzohr-Rüsselspringer (Macroscelides proboscideus)
Blütenfledermaus
Überordnung: LAURASIATHERIA
Ordnung: Fledertiere (CHIROPTERA)
Unterordnung: Fledermäuse (Microchiroptera)
Überfamilie: Hasenmaulartige (Noctilionoidea)
Familie: Blattnasen (Phyllostomidae)
Unterfamilie: Blütenfledermäuse (Glossophaginae)

Blütenfledermaus
Glossophaga soricina • The Pallas's Long-tongued Bat • Le glossophage de Pallas
- Körperbau und Körperfunktionen
- Verbreitung
- Lebensraum und Lebensweise
- Gefährdung und Schutz
- Bedeutung für den Menschen
- Haltung
- Taxonomie und Nomenklatur
- Literatur und Internetquellen
|
Weitere Bilder auf BioLib |
Die neuweltlichen Blattnasen sind die einzige Fledermausfamilie, von der mehrere Arten regelmäßig und in größerer Zahl in europäischen Zoos gezeigt werden. Geeignet sind insbesondere Arten, die sich auf den Verzehr von Nektar, Früchten oder Blut spezialisiert haben, wie die harmlose und daher für begehbare Anlagen geeignete Blütenfledermaus, deren Nahrung hauptsächlich aus Nektar und Pollen besteht. Körperbau und KörperfunktionenDie Kopf-Rumpflänge der Blüten- (oder Blumen-)fledermaus beträgt 54-55 mm, der Schwanz ist 7-8 mm lang, das mittlere Gewicht liegt bei etwa 9.5 g. Die Zunge ist sehr lang und vorne mit bürstenartigen Papillen versehen [2; 3]. VerbreitungMittel- und Südamerika, von Mexiko im Norden bis nach Nordargentinien im Süden: Argentinien, Belize, Bolivien, Brasilien, Costa Rica, El Salvador, Französisch Guyana, Grenada, Guyana, Honduras, Jamaika, Kolumbien, Mexiko (Sonora, Tamaulipas), Nikaragua, Panama, Paraguay, Peru, Surinam, Trinidad und Tobago, Venezuela [1]. Lebensraum und LebensweiseDie hauptsächlich Nektar fressende Blütenfledermaus sucht ihre Nahrung in Wäldern, auf Landwirtschaftsland und in Gärten und Parks. Sie schläft in natürlichen Höhlen, Tunnels oder Gebäuden, zumeist in großen Kolonien - in einem verlassenen Haus in Brasilien wurden über 2'000 Individuen gezählt - und oft in Gesellschaft von Brillenblattnasen (Carollia perspicillata). Bestimmte Pflanzen haben sich im Laufe der Zeit speziell an die Bestäubung durch Fledermäuse angepasst. Ihre großen Blüten öffnen sich nachts und können von den Tieren leicht angeflogen werden, die im Schwirrflug den süßen Nektar aus den Blüten lecken und diese dabei Bestäuben. Weil Blüten mittels Echoortung nur schwer aufzuspüren sind, orientieren sich die Fledermäuse bei der nächtlichen Nahrungssuche an ultraviolettem Licht, das von den Blüten reflektiert wird und von den an sich farbenblinden Fledermäusen wahrgenommen werden kann. Wenn Nektar knapp ist, werden auch Insekten gefressen. Die Weibchen können pro Jahr 2-3mal ein einzelnes Junges zur Welt bringen [1; 2; 3; 4]. Gefährdung und SchutzDie Blütenfledermaus wird aufgrund einer Beurteilung aus dem Jahr 2015 nicht als gefährdet angesehen, da sie weit verbreitet ist, eine große Gesamtpopulation hat, auch in Schutzgebieten vorkommt und bis zu einem gewissen Grad auch veränderte Lebensräume nutzen kann. (Rote Liste: LEAST CONCERN) [1]. Der internationale Handel ist durch CITES nicht geregelt. Bedeutung für den MenschenDie Art wird weder genutzt noch richtet sie Schäden an [1]. HaltungBlütenfledermäuse werden gerne freifliegend in für Besucher begehbaren Tropen-oder Nachttierhallen gehalten. Eine Vergesellschaftung mit vielen anderen Tieren ist möglich. Sie sind unter Zoobedingungen recht langlebig. Den Altersrekord hält ein im Henry Doorley Zoo, Omaha, geborenes Weibchen, das dort nach 17 Jahren immer noch am Leben war [5]. Haltung in europäischen Zoos: Die Art wird in rund 10 Zoos gehalten, die sich überwiegend im deutschsprachigen Raum befinden. Für Details siehe Zootierliste. Mindestanforderungen an Gehege: Die im Säugetiergutachten 2014 des BMEL vorgegebenen Zahlen entbehren einer wissenschaftlichen Grundlage und sind, zumindest wenn es um große Kolonien geht, aus der Sicht der tierhalterischen Praxis überzogen. Grundsätzlich sollte keine Mindestfläche, sondern nur ein Volumen vorgegeben werden. Das Gutachten’96 gab für kleine Fledermäuse keine Gehegedimensionen an. Es empfiehlt sich, die Beurteilung der Haltung von Kleinfledermäusen darauf abzustellen, ob bei der in einer Haltung gegebenen Besatzdichte Probleme auftreten oder nicht. Die Schweizerische Tierschutzverordnung (Stand 01.06.2022) schreibt für bis zu 20 Tiere eine Grundfläche von 10 m² bei einer Höhe von 2 m vor, für jedes weitere sind 0.2 m² zusätzliche Fläche erforderlich. Nach der 2. Tierhaltungsverordnung Österreichs (Stand 2023) sind für bis zu 20 Tieren eine Grundfläche von 20 m² und eine Höhe von 2.5 m erforderlich, für jedes weitere Tier ist die Grundfläche um 2 m² zu erhöhen. Letzteres ist unsinnig, nachdem für die ersten 20 nur eine Fläche von 1 m² pro Tier verlangt wird. Taxonomie und NomenklaturDie Blütenfledermaus wurde 1766 vom Berliner Naturforscher Peter Simon PALLAS, den Katharina die Große als Professor nach Petersburg berufen hatte, als "Vespertilio soricinus" beschrieben. Étienne GEOFFROY SAINT-HILAIRE, der Begründer des ersten bürgerlichen Zoos, der Ménagerie im Jardin des Plantes von Paris, stellte sie als Typusart in die von ihm neugeschaffene Gattung Glossophaga. Die Gattung umfasst vier Arten, von G. soricina werden gegenwärtig fünf Unterarten anerkannt [6; 7]. |
Literatur und Internetquellen
- BARQUEZ, R. et al. (2015). Glossophaga soricina. The IUCN Red List of Threatened Species 2015: e.T9277A22107768. http://www.iucnredlist.org/details/9277/0. Downloaded on 20 July 2018.
- EISENBERG, J. F. (1989)
- GRZIMEK, B. (Hrsg. 1970)
- PM TIERGARTEN NÜRNBERG
- WEIGL, R. (2005)
- WILSON, D. E. & REEDER, D. M. (2005)
- WILSON, D. E. et al. eds. (2009-2019)
Zurück zu Übersicht Insektenfresser und Fledertiere
Weiter zu Kleines Hasenmaul (Noctilio albiventris)
Europäischer Maulwurf
Überordnung: Insektenfresser (INSECTIVORA / EULIPOTYPHLA)
Ordnung: Spitzmausverwandte (SORICOMORPHA)
Familie: Maulwürfe (Talpidae)
Unterfamilie: Altweltmaulwürfe (Talpinae)

Europäischer Maulwurf
Talpa europaea • The European Mole • La taupe d'Europe
- Körperbau und Körperfunktionen
- Verbreitung
- Lebensraum und Lebensweise
- Gefährdung und Schutz
- Bedeutung für den Menschen
- Haltung
- Taxonomie und Nomenklatur
- Literatur und Internetquellen
|
Weitere Bilder auf BioLib |
Der Maulwurf ist eine Tierart, die Alle kennen, aber nur Wenige schon lebens gesehen haben. In Zoos hat es bislang kaum eine nachhaltige Haltung oder gar Zucht gegeben. Meistens wurden Einzeltiere gehalten, die nach einigen Monaten verstarben. Körperbau und KörperfunktionenDer Europäische Maulwurf erreicht eine Kopf-Rumpflänge von 10-16 cm, eine Schwanzlänge von 14-45 mm und ein Gewicht von 36-130 g. Männchen sind größer als Weibchen, im Mittel wiegen sie 85 g, gegenüber 75 g bei den Weibchen. Der gedrungene Leib ist walzenförmig und geht ohne abgesetzten Hals in den kleinen Kopf über, welcher sich seinerseits zu einem Rüssel verlängert und zuspitzt, während Augen und Ohren äußerlich kaum oder nicht sichtbar sind. Unter den Sinnen sind Geruch, Gehör und Tastsinn besonders ausgebildet, während der Gesichtssinn sehr verkümmert ist. Die Augen haben einen Durchmesser von nur etwa 1 mm und sind meist unter einer Hautfalte verborgen. Der dünn behaarte Schwanz dient als Tastorgan, auch die Vordergliedmaßen und die Schnauze sind mit Vibrissen versehen. Auffällig sind die breiten Grabhände, deren Innenflächen nach außen gedreht sind. Nase und Füße sind fast nackt. Die Farbe des kurzen, samtartigen Fells kann variieren, ist jedoch meistens schwarz [3; 4; 5; 6; 9]. VerbreitungEuropa: Albanien, Andorra, Austria, Belgien, Bosnien und Herzegowina, Bulgarien, Dänemark, Deutschland, Estland, Finnland, Frankreich, Griechenland, Großbritannien, Italien, Kroatien, Lettland, Liechtenstein, Litauen, Luxemburg, Mazedonien ehem Jug. Rep., Moldawien, Monaco, Montenegro, Niederlande, Österreich, Polen, Rumänien, Russland bis Mittelsibirien, Süd-Schweden, Schweiz, Serbien, Slowakei, Slowenien, Spanien, Tschechien, Türkei, Ukraine, Ungarn, Weißrussland [1; 4]. Lebensraum und LebensweiseUrsprünglich war der Maulwurf in Laubwäldern zuhause, bevölkerte jedoch schnell Ackerland und Weiden. Er kommt in Miteleuropa bis auf eine Höhe von 1'900 m überall dort vor, wo die Böden fruchtbar und tief genug sind, um Gänge zu graben. Er fehlt mangels Beutetieren in Sanddünen, Mooren und Nadelwäldern [6]. In der Natur bekommt man Maulwürfe selten zu Gesicht. Nur die zahlreichen Erdhügel, die so manchen Gärtner zur Verzweiflung treiben, verraten ihre Anwesenheit. Allerdings sollte man die Maulwurfshügel nicht mit den etwas kleineren der Schermäuse (Arvicola terrestris) verwechseln. Währenddem die Schermaus sich von Wurzeln, Knollen etc. ernährt, vergreift sich der Maulwurf niemals an Pflanzenmaterial. Ganz im Gegenteil, er verzehrt nebst Regenwürmern Unmengen von unterirdisch lebenden Pflanzenschädlingen. Die meisten Maulwurfgänge dienen dabei als raffinierte Fallen, denn sie liegen quer zu den Gängen von Würmern und Insektenlarven. Bei Ihren Auf- und Abwärtsbewegungen geraten diese Bodentiere in die Gänge und werden vom Maulwurf eingesammelt [2]. Ein- oder zweimal im Jahre wirft der weibliche Maulwurf zwischen drei bis fünf Junge. Die Kleinen wachsen ziemlich rasch heran und bleiben ungefähr einen oder zwei Monate bei ihrer Mutter [3]. Gefährdung und SchutzDer Europäische Maulwurf ist eine Art der westlichen Paläarktis, wo er weit verbreitet und häufig ist. Er gilt daher aufgrund einer Beurteilung aus dem Jahr 2017 als nicht gefährdet (Rote Liste: LEAST CONCERN) [1]. Der internationale Handel ist durch CITES nicht geregelt. In Deutschland ist der Maulwurf eine geschützte Art nach Anlage 1 zur Bundesartenschutzverordnung. In der Schweiz ist er nicht geschützt (anderslautenden Behauptungen in diversen Maulwurfs-Internetseiten sind falsch) und kann im Bedarfsfall bekämpft werden. Früher wurden in diesem Zusammenhang auch Fangprämien ausgerichtet. Bedeutung für den MenschenWirtschaftliche Bedeutung: Früher wurden Maulwurfsfelle in großer Zahl zu Pelzwaren verarbeitet, obwohl sie wenig dauerhaft waren. In den 1920/30er Jahren waren sie groß in Mode. Im Jahr 1930 gelangten 20 Millionen Fellchen auf den Markt [5]. Kulturelle Bedeutung: 1957 erfand der tschechische Zeichner Zdeněk Miler die Trickfilmfigur "Der kleine Maulwurf", im Original "Krtek" oder "Krteček", der die Hauptrolle in 63 Episoden einer Fernsehserie spielte, die im deutschsprachigen Raum vor allem im Rahmen der vom WDR produzierten "Sendung mit der Maus" oder des "Sandmännchens" des Fernsehens der DDR bekannt wurde. Mehrere Episoden wurden zu einem Kinofilm zusammengefasst, und die Figur wurde zum Thema zahlreiche Kinderbücher, Malbücher und Plüschfiguren. Kinderbücher gibt es auch von anderen Autoren, so z.B. "Der Maulwurf Grabowski" von Luis Murschetz [diverse Internetquellen]. HaltungEs liegt vermutlich an seiner versteckten Lebensweise, dass der Maulwurf zu den am wenigsten erforschten europäischen Säugetieren gehört. Die Tiere sind sehr stressempfindlich und es ist kaum möglich, sie außerhalb ihres natürlichen Lebensraumes zu halten. Das Haltungssystem im Zoo Osnabrück hatten die Zoomitarbeiter gemeinsam mit Prof. Dr. Günter R. Witte von der Universität Kassel entwickelt. Als Einzelgänger bewohnten die Maulwürfe auch im "Unterirdischen Zoo" in Osnabrück getrennte Gangsysteme. Außerdem stand ihnen ein Bereich zur Verfügung, in dem sie in der Erde graben und eine Nestkammer, in der sie ruhen und Nahrung einlagern konnten [PM Zoo Osnabrück]. Als Höchstalter unter Zoobedingungen werden 11 Monate angegeben, die ein Maulwurf im Zoo von Helsinki erreichte [7], eine andere Angabe lautet auf 5 Jahre [4]. Haltung in europäischen Zoos: Maulwürfe waren in Zoos stets selten. Meist wurden Einzeltiere gehalten, die nie sehr alt wurden. Vor ein paar Jahren waren Maulwürfe z.B. Im Zoo Dresden oder im Zoo Osnabrück zu sehen, gegenwärtig (2023) gibt es keine mehr. Für Details siehe Zootierliste. Mindestanforderungen an Gehege: In Deutschland, Österreich und der Schweiz gibt es keine konkreten Mindestanforderungen für die Haltung von Maulwürfen. Taxonomie und NomenklaturDer Europäische Maulwurf wurde 1758 von Carl von LINNÉ unter seinem heute noch gültigen Namen beschrieben. Damals war er die einzige bekannte Art, mittlerweile werden 12 Arten unterschieden, von denen eine, der Blindmaulwurf (Talpa caeca SAVI, 1822), auch in der Südschweiz (Tessin und Bergell) vorkommt. Das Auftreten von Talpa caeca, die nur 34 Chromosomen aufweist, überlappt sich dort mit jenem von Talpa europaea, die ein Chromomenpaar mehr hat. Talpa europaea gilt als monotypisch, nachdem mehrere frühere Unterarten als eigene Arten verselbständigt wurden [1; 6; 8]. |
Literatur und Internetquellen
- AMORI, G. et al. (2017). Talpa europaea. The IUCN Red List of Threatened Species 2017: e.T41481A22320754. http://www.iucnredlist.org/details/41481/0. Downloaded on 15 May 2018.
- BARKHAUSEN, A. (2003)
- BREHM, A. E. (1882-1887)
- GRIMMBERGER, E. & RUDLOFF, K. (2009)
- GRZIMEK, B. (Hrsg. 1970)
- HAUSSER, J. et al. (Hrsg., 1995)
- WEIGL, R. (2005)
- WILSON, D. E. & REEDER, D. M. (2005)
- WILSON, D. E. et al. eds. (2009-2019)
Zurück zu Übersicht Insektenfresser und Fledertiere
Weiter zu Fledertiere - Allgemeines
Afrikanischer Weissbauchigel
Überordnung: Insektenfresser (INSECTIVORA / EULIPOTYPHLA)
Ordnung: Igelverwandte (ERINACEOMORPHA)
Unterfamilie: Stacheligel (Erinaceinae)

Afrikanischer Weißbauchigel
Atelerix albiventris • The Four-toed Hedgehog • Le hérisson à ventre blanc
- Körperbau und Körperfunktionen
- Verbreitung
- Lebensraum und Lebensweise
- Gefährdung und Schutz
- Bedeutung für den Menschen
- Haltung
- Taxonomie und Nomenklatur
- Literatur und Internetquellen
|
Weitere Bilder auf BioLib |
Der Afrikanische Weißbauchigel wird häufig von Privatpersonen gehalten und in mehreren Farbvarianten gezüchtet. Er ist für eine nachtaktive Art auch relativ oft in Zoos zu sehen. Körperbau und KörperfunktionenMit einer Kopf-Rumpflänge von 21 (15-25) cm und einem Gewicht von 250-600(-1000) g ist der Afrikanische Weißbauchigel kleiner als unser einheimischer Igel. Sein Schwanz ist 25 mm lang. Gesicht, Hals, Bauch und Beine sind mit weißen Haaren bedeckt, wobei das Gesicht eine schwarze Maske tragen kann. Die Stacheln sind schwarz mit weißen oder cremefarbenen Spitzen [2; 3]. VerbreitungWest-, Zentral- und Ostafrika: Von Senegal im Westen über den Sudan, Eritrea und Äthiopien südlich bis nach Malawi, Sambia und Mosambik [1]. Lebensraum und LebensweiseDer Afrikanische Weißbauchigel ist solitär, dämmerungs- und nachtaktiv. Als Lebensraum bevorzugt er Grasland und lockeren Busch in Höhenlagen bis zu 2'000 m. Er besiedelt auch Agrarland, Parks und Gärten. Dichter Wald, Wüsten und Feuchtgebiete werden gemieden. Gerne hält er sich in Gebieten mit einem hohem Bestand an Huftieren auf, da deren herumliegender Dung Insekten anzieht. Seine Hauptnahrung besteht aus Insekten und anderen Arthropoden wie Tausendfüßern, Schnecken und Krebstieren, ferner fängt er kleine Schlangen, Echse und Frösche, plündert Vogelnester und frisst herabgefallene Früchte, Erdnüsse, Wurzeln und Pilze. Selbst fällt er oft Kaffernadlern (Aquila verreauxi) oder Uhus (Bubo africanus, Bubo lacteus) zum Opfer. Tagsüber ruht er unter Steinen, Grasmatten, Laubhaufen oder Baumstämmen, in Erdlöchern, Felsspalten oder Termitenhügeln, wobei er seine Verstecke täglich zu wechseln scheint. Bei kühlem und trockenem Wetter kann er eine bis 6 Wochen dauernde Torporphase, eventuell mit Unterbrüchen durchmachen, dies ist jedoch nicht überall der Fall [3; 4; 6]. Weißbauchigel erreichen Geschlechtsreife mit etwa 8 Wochen. In Nord- und Ostafrika gibt es keine saisonale Einschränkung der Fortpflanzung, in südlichen Teil des Artareals dagegen schon. Nach einer Tragzeit von 35 (30-40) Tagen werden in der Regel 3-6 Junge geboren. Die Lebenserwartung liegt bei 4-6 Jahren [2; 6]. Gefährdung und SchutzDer Afrikanische Weißbauchigel wird aufgrund einer Beurteilung aus dem Jahr 2016 nicht als gefährdet beurteilt, weil er ein großes Verbreitungsgebiet und einen großen Gesamtbestand hat, in Schutzgebieten vorkommt und auch veränderte Lebensräume toleriert (Rote Liste: LEAST CONCERN) [1]. Der internationale Handel ist unter CITES nicht geregelt. Bedeutung für den MenschenDer Afrikanische Weißbauchigel wird häufig als Heimtier gehalten. Es wurden zahlreiche Farbschläge herausgezüchtet, von schwarz über grau, verschiedenen Brauntönen, zimt- und aprikosenfarben bis weißlich, leuzistisch und albinotisch. Die verschiedenen Farben gibt es auch als Schecken und mit unterschiedlicher Gesichtszeichnung [2]. HaltungDas Höchstalter im Zoo wird mit 11 Jahren und 5 Monaten angegeben [5]. Es wurde von einem Weibchen erreicht, das in amerikanischen Zoos geboren und gehalten worden war. Haltung in europäischen Zoos: Die Art wird in über 80 Zoos gehalten, von denen sich ein paar wenige (kleinere) im deutschsprachigen Raum befinden. Schwerpunkte der Haltung sind Großbritannien und Russland. Für Details siehe Zootierliste. Mindestanforderungen an Gehege: Nach Säugetiergutachten 2014 des BMEL soll für 1-2 Afrikanische Weißbauchigel ein Innengehege von 2 m² vorhanden sein und für jedes weitere Tier 1.5 m² mehr. Ein Außengehege für die Haltung während des Sommers wird als wünschenswert bezeichnet. Die Schweizerischen Tierschutzverordnung (Stand 01.06.2022) schreibt für ein Tier ein Innengehege mit einer Fläche von 2 m² vor, für jedes weitere 1 m² zusätzlich. Die 2. Tierhaltungsverordnung Österreichs (stand 2022) fordert für ein Tier ein Gehege mit einer Fläche von 2 m² und für jedes weitere 0.2 m² zusätzlich, was bei einer solitär lebenden Tierart nicht viel Sinn macht. Taxonomie und NomenklaturDer Afrikanische Weißbauchigel wurde 1841 vom Konservator der Zoologischen Staatssammlung München, Johann Andreas WAGNER, als "Erinaceus albivetris" beschrieben und kam dann als Typusart in die vom in Nordafrika tätigen, französischen Naturforscher Nicolas Auguste POMEL 1848 aufgestellte Gattung Atelerix. Später wurde er zeitweilig wieder Erinaceus zugeordnet. Die Art ist monotypisch, Die Gattung umfasst vier sich ziemlich ähnlich sehende Arten [1; 3; 6]. |
Literatur und Internetquellen:
- CASSOLA, F. 2016. Atelerix albiventris (errata version published in 2017). The IUCN Red List of Threatened Species 2016: e.T40602A115174097. http://www.iucnredlist.org/details/40602/0. Downloaded on 15 May 2018.
- DEIN WEISSBAUCHIGEL
- HAPPOLD, D.C.D. (1987)
- UNTAMED SCIENCE
- WEIGL, R. (2005)
- WILSON, D. E. et al. eds. (2009-2019)
Zurück zu Übersicht Insektenfresser und Fledertiere
Weiter zu Braunbrustigel (Erinaceus europaeus)
Giraffe
Überordnung: LAURASIATHERIA
Taxon ohne Rang: CETARTIODACTYLA
Ordnung: Paarzeher (ARTIODACTYLA)
Unterordnung: Schwielensohler (Tylopoda)
Familie: Giraffenartige (Giraffidae)
Unterfamilie: Steppengiraffen (Giraffinae)

 Giraffe
Giraffe
Giraffa camelopardalis • The Giraffe • La girafe
- Körperbau und Körperfunktionen
- Verbreitung
- Lebensraum und Lebensweise
- Gefährdung und Schutz
- Bedeutung für den Menschen
- Haltung
- Taxonomie und Nomenklatur
- Literatur und Internetquellen
|
Weitere Bilder auf BioLib.cz |
Die Giraffe als am höchsten werdendes Landsäugetier ist unverkennbar und beim Publikum ausgesprochen populär. Sie ist daher ein idealer Botschafter für den Natur- und Artenschutz im Savannengürtel Afrikas und wird entsprechend häufig gehalten. Aufgrund ihrer anatomischen Besonderheiten hat sie auch zoopädagogisch viel zu bieten. Als Art ist sie gefährdet, zwei Unterarten gelten als vom Aussterben bedroht, eine als stark gefährdet, zwei als gefährdet und eine als potenziell gefährdet. Die europäischen Zoos haben deshalb ein Erhaltungszuchtprogramm eingerichtet. Körperbau und KörperfunktionenGiraffen erreichen eine Kopf-Rumpflänge von rund (300-)350-480 cm, eine Schwanzlänge von (76-)90-110 cm und eine Scheitelhöhe von 450-580(-600) cm. Es besteht ein Geschlechtsdimorphismus. Bullen werden größer als Kühe und erreichen Körpergewichte von 1'800-1'930 kg, die Kühe nur von 450-1'180 kg. Der Kopf ist schwer und kompakt. Um ihn zu halten, ist das Sehnenband im Genick besonders stark entwickelt. Auf dem Kopf befinden sich 2-5 knöcherne, von Haut bedeckte Hörnchen. Es handelt sich dabei um ein Paar Scheitelbeinhörner und allenfalls um ein unpaares Stirnhorn und ein Paar Hinterhauptshörner. Alte Bullen können viele weitere knöcherne Auswüchse am Kopf haben. Die mit Haaren bedeckten Lippen sind groß, weich und beweglich und dienen zusammen mit der langen blauen Zunge dazu, Blätter von den oft dornenbewehrten Zweigen der Bäume abzupflücken. Die Augen sind groß und mit langen Wimpern versehen. Der Hals weist wie bei fast allen Säugetieren trotz seiner Länge nur 7 Wirbel auf. Es ist eine Halsmähne vorhanden. Die Rückenlinie ist abschüssig. Bei den Extremitäten sind nur der 3. und 4. Strahl voll entwickelt, Afterklauen fehlen. Der Schwanz trägt eine lange Endquaste. Das Euter der Kühe hat 4 Zitzen. Das Muster des Haarkleids besteht aus gelbbraunen bis schwarzbraunen, der Tarnung und Thermoregulation dienenden Flecken auf hellem Grund, die je nach Unterart in Größe, Form und Farbe unterschiedlich sind. Der Bauch und teilweise die Beine sind ungefleckt [5; 8; 11]. VerbreitungSavannengürtel Afrikas: Angola, Äthiopien, Botswana, Burkina Faso, Demokratische Republik Kongo (Zaire), Eritrea, Kamerun, Kenia, Namibia, Niger, Nigeria, Sambia, Simbabwe, Somalia, Südafrika, Südsudan, Tansania, Tschad, Uganda, Zentralafrikanische Republik. Ab 1986 angesiedelt in Ruanda. Ausgestorben oder vermutlich ausgestorben in Guinea, Mali, Mauretanien, wieder angesiedelt in Mosambik, Senegal und Swasiland (ab 1965), wobei umstritten ist, ob die Giraffe ursprünglich in Swasiland vorkam oder erst um 1896 bei einem Rinderpest-Seuchenzug ausstarb [11; 13; 17]. Lebensraum und LebensweiseDie tagaktiven Giraffen sind hauptsächlich Tiere der Savannen und Trockenwälder, finden sich aber auch in Trockensavannen und Hochländern, und erschließen sich den Rivieren folgend sogar Wüsten wie den Namib. Ihre Fortbewegung erfolgt im Passgang oder im Galopp. Sie sind "Browser", die Blätter, Zweige, Knospen, Rinde, Früchte und Samen von Bäumen und Büschen abweiden. Akazien und Buschweiden (Combretum) sind die wichtigsten Futterpflanzen. Auch Anabäume (Faidherbia), Witgat (Boscia), Sternbüsche (Grewia) und Leberwurstbäume (Kigelia) werden bevorzugt angenommen. Die Tiere kommen ohne tägliche Tränke aus [13; 17]. Giraffen leben in wenig stabilen Rudeln, die erwachsene Tiere beiderlei Geschlechts umfassen können. Sie haben Streifgebiete von 25-160 km² und sind nicht territorial. Es gibt keine feste Fortpflanzungsperiode. Nach einer Tragzeit von 450-488 Tagen wird ein einzelnes Kalb mit einer Scheitelhöhe von 165-175 cm geboren, das etwa 12 Monate gesäugt wird. Die Geburt erfolgt im Stehen. Bullen werden mit 2.5-4 Jahren, Kühe mit 4.5 Jahren geschlechtsreif [17]. Löwen sind die Beutegreifer, die am erfolgreichsten Giraffen jagen und zwar sowohl Junge wie Erwachsene. Letztere sind für den Löwen nicht ganz risikolos, da sie ihn mit Hufschlägen vorübergehend außer Gefecht setzen oder gar töten können. Mehr als die Hälfte aller im Freiland geborenen Giraffen stirbt noch im Jugendalter, dabei sind Löwenangriffe eine der wichtigsten Todesursachen [2]. Wenn also ein Zoo eine für die Zucht nicht verwendbare junge Giraffe rasch und schmerzlos tötet und an die Löwen im eigenen Bestand verfüttert, macht er sich damit zwar unbeliebt, aber er setzt etwas tierschutzkonform um, was in der Wildbahn regelmäßig stattfindet. Gefährdung und SchutzObwohl einzelne Unterarten stark bedroht sind, galt die Giraffe als Art lange als nicht-gefährdet. Erst 2016 wurde sie in die Kategorie "gefährdet" hochgestuft (Rote Liste: VULNERABLE). Die Bestandsentwicklung ist jedoch regional sehr unterschiedlich: Bei drei Unterarten nehmen die Bestände zu (G. c. angolensis, G. c. giraffa, G. c. peralta), bei fünf nehmen sie ab (G. c. antiquorum, G. c. camelopardalis, G. c. reticulata, G. c. rothschildi, G. c. tippelskirchi) und bei einer ist der Bestand stabil (G. c. thornicrofti). Im Ganzen gibt es noch rund 70'000 erwachsene Tiere, die jedoch sehr ungleich auf die einzelnen Unterarten verteilt sind. Am seltensten sind peralta, thornicrofti und camelopardalis amhäufigsten tippelskirchi und angolensis [4; 11; 12; 13]. Der internationale Handel seit September 2019 nach Anhang II CITES geregelt, die Einfuhr lebender Exemplare aus Afrika ist aber aus tierseuchenrechtlichen Gründen kaum noch möglich. Ferner fällt die Art unter Anhang I des Bonner Übereinkommens über wandernde Tierarten. Zoogestützte Artenschutzprojekte (Beispiele):
Bedeutung für den MenschenTraditionell wurden Giraffen gejagt um Fleisch für den Eigenbedarf oder den lokalen Markt, Häute und die gebietsweise als Brautgeschenke oder Fliegenwedel verwendeten Schwänze zu gewinnen. Die Tiere wurden zu Pferde oder auf dem Dromedar gehetzt, bis sie nicht mehr weiter konnten, und dann soll ihnen mit dem Schwert die Achillessehrne durchtrennt worden sein, um sie bewegungsunfähig zu machen [1; 13]. Im südlichen Afrika ist eine kontrollierte Jagd nach wie vor zulässig, wobei für Jagdtouristen nebst den übrigen Safari-Kosten eine Abschussgebühr von etwa 1'800-2'600 USD fällig wird (Online-Inserate 2019). Im übrigen Areal werden die Tiere vielfach illegal bejagt. Im Restaurant "The Carnivore" in Nairobi z.B. waren bis vor wenigen Jahren noch regelmäßig Giraffensteaks zu haben, obwohl die Art in Kenia vollständig geschützt ist. Giraffen sind gleichermaßen wichtig für den Jagd- wir für den Fototourismus. In Südafrika existiert daher ein beachtlicher nationaler Handel mit lebenden Tieren für private Naturschutzgebiete oder Jagdfarmen [3; 5]. HaltungDie erste lebende Giraffe wurde im Jahr 46 v. Chr. von GAIUS JULIUS CAESAR nach Europa gebracht [6]. Gegen Ende des 2. Jahrhunderts tötete Kaiser Commodus eine Giraffe im Kolosseum. Weitere Giraffentransporte nach Rom sind aus dem 3. Jhdt. dokumentiert, als unter verschiedenen Kaisern mehrere Tiere in Schau"kämpfen" ihr Leben lassen mussten [8]. Auch Giraffenfleisch war schon damals ins Römische Reich importiert worden: US-Archäologen fanden in Abfallhalden der damals beliebten Einkaufsmeile am Stabiae-Tor in Pompeji Giraffenknochen. Dort ballten sich seit dem vierten Jahrhundert vor Christus eine Menge Geschäfte, Schnellimbisse und Restaurants, und dort entdeckten die Forscher von heute die Reste einer metzgerisch tadellos aufbereiteten Giraffenkeule Auch Giraffenfleisch war schon damals ins Römische Reich importiert worden: US-Archäologen fanden in Abfallhalden der damals beliebten Einkaufsmeile am Stabiae-Tor in Pompeji Giraffenknochen. Dort ballten sich seit dem vierten Jahrhundert vor Christus eine Menge Geschäfte, Schnellimbisse und Restaurants, und dort entdeckten die Forscher von heute die Reste einer metzgerisch tadellos aufbereiteten Giraffenkeule [20]. In nachrömischer Zeit wurde im 11. Jahrhundert eine Giraffe in Byzanz gezeigt. Kaiser Friedrich II. von Hohenstaufen erhielt aus Babylon, wo damals eine menagerieartige Haltung bestanden haben muss, eine Giraffe als Geschenk, die er in seiner Menagerie mitführte, als er 1235 nach Deutschland kam. 1487 bekam Lorenzo di Medici für seine Menagerie in Florenz vom ägyptischen Sultan al-Kamil aus Damaskus eine Giraffe, die allerdings nur kurze Zeit zur Schau gestellt wurde, weil sie sich ein Jahr nach Ihrer Ankunft das Genick brach. Ein Aquarell aus dem Jahr 1559 von Melchior LURIG (LORCH) zeigt eine Giraffe in der Menagerie des Sultans Süleyman I. in Konstantinopel. In Mitteleuropa gab es damals keine Giraffen. Der Zürcher Stadtarzt Conrad GESSNER, war für seine "Historia animalium" auf Literaturquellen angewiesen. Währenddem die Abbildung in der ersten Ausgabe aus dem Jahr 1551 noch wenig Ähnlichkeit mit einer Giraffe hatte, konnte er bei späteren Ausgaben und namentlich dem deutschsprachigen Thierbuoch (1563) auf LURIGs realistischere Darstellung zurückgreifen [21]. Die im 18./19. Jahrhundert in Europa gezeigten Giraffen stammten vorab aus dem Sudan. Giraffen gelangten in die Menagerien von Wien (1742) und Paris (1794). Carl von LINNÉ hatte für seine Erstbeschreibung (1758) ein komplettes Exemplar vorliegen. 1824 sandte der Vizekönig der osmanischen Provinz Ägypten, Mehmed Ali Pascha, ein Exemplar nach Konstantinopel und ein weiteres als Geschenk an den englischen König George V. [8]. Die im Jahr 1828 vom Vizekönig der Wiener Menagerie geschenkte Giraffe war im Darfur gefangen worden, war also eine Kordofangiraffe (G. c. antiquorum). Das Tier war am 30. März 1828 in Alexandria verladen worden und traf am 27. April in Venedig ein, wo eine 40-tägige Quarantäne durchgeführt wurde. Dann ging es abermals per Schiff weiter nach Fiume (heute Rijeka), wo die Giraffe am 15. Juni eintraf und von dort zu Fuß - mit Schnürschuhen an den empfindlichen Hufen - bis Karlovac, wo sie auf einen eigens konstruierten Wagen verladen und über Zagreb, Varazdin, Szombathely, und Sopron nach Wien gekarrt wurde. Am 7. August 1828 kam das Tier wohlbehalten in Schönbrunn an. Der Tiergarten konnte die Menschenmassen kaum aufnehmen und alles musste plötzlich "à la Giraffe" sein: Mode, Frisuren, Aschenbecher, Trinkgefäße. Ein eigenes Gebäck, die "Giraffeln" wurden erfunden; man spielte das Giraffen-Klavier und tanzte den Giraffen-Galopp. Das dazu passende Theaterstück fiel bei den Wienern allerdings durch und wurde "ausgezischt" [9]. Ähnliches Aufsehen hatte ein Jahr zuvor eine Giraffe in Frankreich erregt, die von Ägypten bis Marseille mit dem Schiff transportiert wurde und danach den Landweg nach Paris zu Fuß zurücklegen musste. Das "Zarafa" geannte Tier lebte war während 18 Jahren die Hauptattraktion der Menagerie [6; 22]. Der ersten Wiener Giraffe war übrigens kein langes Leben vergönnt. Sie starb 10 Monate nach ihrer Ankunft an Knochentuberkulose. Im Gegensatz dazu gediehen drei Bullen und eine Kuh, die der Londoner Zoo 1836 erhielt, gut und brachten 1839 das erste Giraffenkalb in einem Zoo zur Welt. Weitere Giraffen erhielten die Zoos von Antwerpen, Berlin, Frankfurt, Köln, Dresden, Hamburg, Hannover und Leipzig. 1873 kam die erste Giraffe in Nordamerika für den Bronx Zoo an [8; 23]. Später wurden hauptsächlich Nubische Giraffen (G. c. camelopardalis) aus dem Ostsudan und Äthiopien importiert, so durch die Firmen Hagenbeck und Ruhe. Danach folgten Kapgiraffen aus Südafrika. In der Mitte des 20. Jahrhunderts war die Massai-Giraffe (G.c. tippelskirchi) die im deutschsprachigen Raum dominierende Unterart. 1969 wurde sie in Basel, Berlin-Zoo, Dresden, Frankfurt, Hamburg, Hannover, Karlsruhe, Leipzig und München gehalten [8]. Die Tiere stammten hauptsächlich aus dem heutigen Tansania, wo sie z.B. im Auftrag des Schweizer Tierhändlers August Künzler gefangen wurden [10]. 2011 wurde auch die letzte Gruppe von Massaigiraffen in Europa, nämlich jene im Zoo Basel aufgegeben, weil für die weitere Zucht keine blutfremden Tiere zur Verfügung standen. Dominierende Unterarten sind jetzt die Rothschild- und die Netzgiraffe. In vielen Zoos werden Giraffen mit anderen Arten vergesellschaftet, so z.B. mit Zebras, Watussirindern, verschiedenen Antilopen, Afrikanischen Straußen, Marabus, Kranichen, Trappen, Perlhühnern oder Sporenschildkröten [14]. Vorsicht ist geboten beim Vergesellschaften von Giraffen und größeren Hornträgern (z.B. Elenantilopen) , da sich die Bullen eventuell Kämpfe liefern, die, auch wenn sie nicht unbedingt ernst gemeint sind, wegen der unterschiedlichen Kampftechniken zu Verletzungen führen können [5]. WEIGL gibt als Höchstalter 39 Jahre und 6 Monate für einen in amerikanischen Zoos gehaltenen weiblichen Wildfang an [16]. Haltung in europäischen Zoos: Die Art wird in gegen 240 Zoos gehalten, von denen sich etwa 30 im deutschsprachigen Raum befinden. Mit Abstand am häufigsten ist die Rothschildgiraffe. Ferner werden wenige Angola- und Kapgiraffen, zahlreiche Netzgiraffen sowie eine zunehmende Anzahl Kordofangiraffen gehalten, letztere hauptsächlich in Frankreich. Daneben gibt es noch eine abnehmende Anzahl Unterart-Hybriden. Die Haltung der in der Wildbahn noch häufigen Massaigiraffen haben die Zoos auslaufen lassen. Für Details siehe Zootierliste. Seit 1991 besteht ein Europäisches Erhaltungszuchtprogramm (EEP), das 2023 in ein vom Opel-Zoo koordiniertes "New Style"-EEP umgewandelt wurde [7]. In diesem Rahmen wurden Haltungsempfehlungen herausgegeben [3]. Forschung im Zoo: Giraffen sind beliebte Studienobjekte für Doktor-, Diplom- und Examensarbeiten. Dabei kann es um Grundlagenforschung gehen, etwa zur Anatomie, Ontogenese, Physiologie oder Ethologie, aber auch um die Prüfung und gegebenenfalls Optimierung der Haltungsbedingungen und somit zur Erhöhung des Tierwohls, wie etwa zur Gruppenzusammensetzung, Umweltanreicherung, Neugestaltung von Anlagen, Fütterung oder Krankheitsgeschehen und tierärztliche Maßnahmen. Manche Arbeiten fokussieren auch darauf, die Tiere besser für die Zoopädagogik nutzbar zu machen. Liste siehe unten. Wie Giraffen gehalten werden (Beispiele):
Mindestanforderungen an Gehege: Das Säugetiergutachten 2014 des BMEL fordert für vier Giraffen Einzelboxen von 30 m² pro Tier und einen gemeinsamen Innenlaufbereich von 200 m². Können die Einzelboxen miteinander verbunden werden, kann deren Fläche auf den Innenlaufbereich angerechnet werden. Gegenwärtig ergibt sich aus der Kombination von Einzelboxen und Gemeinschaftsstall nur bei wenigen Giraffenhaltungen in Deutschland eine Innenlauffläche von 200 m². Es sind jedoch als Folge der aktuell angebotenen Flächen keine tierschutzrelevanten Sachverhalte bekannt. Die im vorliegenden Gutachten vorgegebenen Flächen entbehren somit nicht nur einer Grundlage, sondern liegen auch noch deutlich über den „Best Practice“-Leitlinien der EAZA [3], die für 4 Giraffen einen Gemeinschaftsstall von 64-100 m² sowie drei Absperrboxen von 16-25 m² empfehlen. Nicht berücksichtigt wurde ferner im ersten Absatz, dass nicht nur durch einen Innenlaufbereich, sondern auch durch eine gedeckte Außenveranda ein für die Tiere bei Schnee- oder Eisglätte nutzbarer Laufbereich geschaffen werden kann, was in verschiedenen Zoos der Fall ist und worauf im dritten Absatz hingewiesen wird. Die räumlichen Vorgaben des Gutachtens wurden deshalb von den Tierschutzsachverständigen der Zoos als unbegründet abgelehnt, dagegen hielten sie eine Angleichung der Gehegeabmessungen an jene der Schweizerischen Tierschutzverordnung für vertretbar. Auch die Anforderung an das Außengehege wurde mehr als verdoppelt (von 500 m²/6 Tiere auf 1000 m²/4 Tiere, obwohl bereits aufgrund einer Arbeit aus dem Jahr 1998 hervorgeht, dass dies nicht erforderlich ist [20]. Auch eine chronoethologische Untersuchung bei sechs Giraffen in der ZOOM-Erlebniswelt Gelsenkirchen hat ergeben, dass sich die Tagesaktivität bei artgemäßer Fütterung (hoher Laubanteil) zu 48% aus Fressen, zu 24% aus Wiederkäuen, zu 9 % aus dem Beobachten der Umgebung und zu 6% aus sozialen Interaktionen zusammensetzt. Laufaktivitäten machten nur 10 % des Zeitbudgets aus. Laufstereotypien ("Pacing") wurden nur abends bei drei Tieren beobachtet, wenn die Giraffen darauf warteten, in den Stall gelassen zu werden [15]. Die Schweizerische Tierschutzverordnung (Stand 01.06.2022) schreibt für 4 Giraffen ein Gehege von 500 m² und für jedes weitere Adulttier 100 m² zusätzlich vor. Für den Bullen muss innerhalb dieser Fläche ein Bereich von 100 m² vorgesehen werden, der im Bedarfsfall abgetrennt werden kann. Pro Tier ist eine Stallfläche von 25 m² erforderlich, zusätzlich eine Veranda oder ein Innen-Laufbereich von 80 m². Die 2. Tierhaltungsverordnung Österreichs (Stand 2023) verlangt für 5 Giraffen eine Mindestgehegefläche von 1'000 m² und für jedes weitere 100 m² zusätzlich. Im Innenbereich sind pro Tier 30 m² anzubieten. Um wieviel diese Fläche zu erhöhen ist, wenn mehr als 5 Tiere gehalten werden, ist nicht klar. Taxonomie und NomenklaturDie Giraffe wurde 1758 von Carl von LINNÉ anhand eines Exemplars aus dem Sudan unter dem Namen "Cervus camelopardalis" erstmals wissenschaftlich beschrieben. 1772 wurde sie von dem französischen Zoologen Mathurin Jacques BRISSON in die neue und heute noch zutreffende Gattung Giraffa gestellt [17]. Gattung und Unterfamilie umfassen nur eine rezente Art. Nach einer 2016 veröffentlichten molekulargenetischen Untersuchung wird diese allerdings in vier Arten aufgesplittet, je eine davon mit 2 bzw. 3 Unterarten [4; 18], was aber in der Roten Liste der IUCN, im Giraffen-EEP und von CITES bislang nicht übernommen wurde. Diese basieren nach wie vor auf einer einzigen Art mit neun Unterarten: Unterarten und Bestände (Verbreitung siehe Karte):
Nach einer Untersuchung aus dem Jahr 2020, bei der historisches Material berücksichtigt wurde, soll es 3 Arten und 10 Unterarten geben [19]:
|
Literatur und Internetquellen
- BREHM, A. E. (1882-1887)
- BROWN, D. (2014)
- EAZA Giraffe EEPs (2006)
- GIRAFFE CONSERVATION FOUNDATION
- GRZIMEK, B. (1956)
- HEDIGER, H. (1938)
- JEBRAM, J. (2012)
- KRUMBIEGEL, I. (1971)
- KUNZE, G. (2000)
- LANG, E. M. (1994)
- MARAIS, A., FENNESSY, S. & FENNESSY, J. (2014)
- MARTIN, L. (2013)
- MULLER, Z. et al. ( 2016). Giraffa camelopardalis. The IUCN Red List of Threatened Species 2016: e.T9194A51140239. Downloaded on 07 December 2016.
- PUSCHMANN, W., ZSCHEILE, D., & ZSCHEILE, K. (2009)
- SCHÜSSLER, D., GÜRTLER, W.-D. & GREVEN, A. (2015)
- WEIGL, R. (2005)
- WILSON, D. E. et al. eds. (2009-2019)
- FENNESSY, J., BIDON, T., REUSS, F., KUMAR, V., ELKAN, P., NILSSON, M.A., VAMBERGER, M., FRITZ, U. AND JANKE, A. (2016)
- PETZOLD, A., MAGNANT, A.-S., EDDERAI; D., CHARDONNET, B., RIGOULET, J., SAINT-JALME, M. & HASSANIN, A. (2020)
- DiePresse.com vom 08.01.2014
- BUQUET, T. (2019)
- MNHN - HISTORY OF THE MÉNAGERIE, THE ZOO OF THE JARDIN DES PLANTES
- GRZIMEK, B. (Hrsg. 1970)
Doktor-, Diplom- und Examensarbeiten:
Zurück zu Übersicht Paarzeher
Weiter zu Schutz der Rothschildgiraffe im Kidepo-Nationalpark
Weiter zu Gabelbock (Antilocapra americana)
Vikunja
Überordnung: LAURASIATHERIA
Taxon ohne Rang: CETARTIODACTYLA
Ordnung: Paarzeher (ARTIODACTYLA)
Unterordnung: Schwielensohler (Tylopoda)
Familie: Kamele(Camelidae)
Tribus: Neuweltkamele (Lamini)

 Vikunja
Vikunja
Lama vicugna • The Vicuna • La vigogne
- Körperbau und Körperfunktionen
- Verbreitung
- Lebensraum und Lebensweise
- Gefährdung und Schutz
- Bedeutung für den Menschen
- Haltung
- Taxonomie und Nomenklatur
- Literatur und Internetquellen
|
Weitere Bilder auf BioLib |
Das Vikunja ist nicht nur eine höchst ansprechende Tierart, die sich mit anderen Arten vergesellschaften und somit attraktiv präsentieren lässt. Vielmehr ist es ein Beispiel dafür, wie sich die Nutzungskonzepte für Wildtierarten im Lauf der Zeit gewandelt haben, und daher aus zoopädagogischer Sicht sehr interessant. Dank einem internationalen Zuchtbucht und einem Europäischen Erhaltungszuchtprogramm ist die Zoopopulation in stetem Wachstum begriffen. Körperbau und KörperfunktionenVikunjas erreichen eine Kopf-Rumpflänge von rund 125 -190 cm, eine Schwanzlänge von 15-25 cm, eine Schulterhöhe von 85-90 (70-110) cm und ein Gewicht von 38-45(-50) kg. Tiere aus dem Süden des Artareals sind im Mittel 15% größer und schwerer als solche aus dem Norden. Wie alle Kamelartigen haben die Vikunjas eine gespaltene und sehr bewegliche Oberlippe, einen langen, dünnen Hals, lange schlanke Beine, an den Füßen jeweils nur zwei Zehen, die nicht in Hufen, sondern in gebogenen Nägeln enden, und bindegewebige Sohlenpolster. Der Kopf ist kürzer als beim Guanako. Die unteren Schneidezähne wachsen, wie bei den Nagetieren ständig nach. An Halsansatz und Vorderbrust haben die Tiere eine 20-35 cm lange Mähne. Das oberseits hellbraune, an Brust, Bauch und Innenseite der Beine weiße Fell ist sehr fein und dicht. Die Wollhaare haben einen Durchmesser von nur 11-14 μm [3; 8; 12]. Als Anpassung an das Leben in großer Höhe verfügt das Vikunja über ein sehr leistungsfähiges Herz-Kreislaufsystem. Das Herz ist, im Verhältnis zur Körpermasse sehr groß und sehr stark durchblutet. Zudem hat das Blut ein hohes Sauerstoff-Bindungsvermögen [12]. VerbreitungAnden Südamerikas: Argentinien, Bolivien, Chile, Peru, wiedereingeführt in Ekuador [5]. Lebensraum und LebensweiseLebensraum des Vikunjas sind die Puna und der Altiplano in Höhenlagen von 3'200-5'000 m. Wichtige Nahrungsgründe sind die "Bofedales" oder "Vegas" genannten hochgelegenen Moorlandschaften. Je nach Region beweiden Vikunjas praktisch ausschließlich Wiesen mit Gräsern wie z.B. Panicum, Distichlis, Festuca oder Calamagrostis und Riedgräsern, oder sie verbeißen Sträucher. Sie benötigen Zugang zu offenem Wasser. Sie leben in Familiengruppen, meist bestehend aus einem Hengst und 3-4 Stuten mit ihrem Nachwuchs, in Junggesellenherden oder als Einzelhengste. Sie sind recht standorttreu. Eine Familie benötigt ein Streifgebiet von rund 18 (2-54) ha, das vom Hengst als Territorium überwacht und verteidigt wird [5; 12]. Nach einer Tragzeit von im Mittel 345 (310-365) Tagen wird in der Regel ein einzelnes Fohlen mit einem Geburtsgewicht von 6 (5-8) kg geworfen. Die meisten Geburten fallen im natürlichen Areal in die Monate Juli-Oktober. Die Fohlen werden etwa 6 Monate gesäugt. Die Geschlechtsreife tritt bei Stuten meist mit rund 2 Jahren ein, bei Hengsten mit 3-5 Jahren [8; 12]. Gefährdung und SchutzBis 1996 galt das Vikunja als gefährdete Tierart, seitdem wird es, letztmals überprüft 2018, als nicht gefährdet eingestuft. Heute umfasst sein Bestand über eine halbe Million Individuen in fünf Ländern und ist damit gesichert (Rote Liste: LEAST CONCERN) [5]. Die Art fällt unter CITES-Anhang I mit Ausnahmen für bestimmte Wollprodukte. Die Art ist nach Anhang II und mit Ausnahme der Peruanischen Population auch nach Anhang I des Bonner Übereinkommens über wandernde Tierarten geschützt. Bedeutung für den MenschenWirtschaftliche Bedeutung: Die Inkas nutzten und schützen die Vikunjas. Dem einfachen Volk war die Jagd verboten. Zu bestimmten Zeiten wurden offizielle Treibjagden veranstaltet, bei denen die Tiere gefangen, geschoren und die meisten danach wieder freigelassen wurden. Geschlachtet wurden in der Regel nur überzählige Hengste. Nach der Landnahme durch die Konquistadoren wurden die Vikunjas stark verfolgt und die Bestände brachen während der 300 Jahre dauernden spanischen Herrschaft zusammen. Dies veranlasste Simon BOLIVAR 1825, d.h. schon bald nach ihrer Unabhängigkeit, für Peru und Bolivien ein Gesetz zum Schutz der Vikunjas zu erlassen, das allerdings nicht sehr wirksam war. In der ersten Hälfte des 20. Jahrhunderts wurde die traditionelle Methode der Inkas zur Wollgewinnung wiederbelebt, bei der die Tiere nicht getötet, sondern eingefangen und lebend geschoren wurden. Im Jahr 1969 unterzeichneten die Andenstaaten einen Staatsvertrag zum Schutz des Vikunjas, der 1979 durch die heute noch gültige Regelung (Convenio sobre la Conservación y Manejo de la Vicuña) ersetzt wurde. Heute werden in Peru etwa 60% der Vikunjas nachhaltig bewirtschaftet, was einen Wollertrag von rund 5 Tonnen und einen Verkaufserlös von etwa 2.3 Millionen USD pro Jahr bringt. Bolivien exportierte 2017 2.5 Tonnen Wolle nach Italien und nahm dadurch 900'000 USD ein. Die Erlöse kommen überwiegend der indigenen Bevölkerung zugute [3; 5]. Nebst Rohwolle exportierten die Ursprungsländer auch Stoffe, Kleider und andere verarbeitete Erzeugnisse sowie Wissenschaftsmaterial. Von 1977-2017 wurden zwecks Wiederansiedlung gegen 200 lebende Wildfänge innerhalb Südamerikas verschoben. Ein Verweis auf die Ausfuhr von 4 Tieren im Jahr 1980 nach Deutschland ist falsch, die letzte Ausfuhr nach Europa erfolgte 1971 [2]. HaltungSeit 1969 gibt es ein Internationales Zuchtbuch (ISB), das am Zoo Zürich geführt wird und 274 lebende Tiere in 78 Institutionen außerhalb der Ursprungsländer umfasst [Daten bis 01.01.2018 nach Zuchtbuchführer]. Von 1946 bis 1971 wurden aus den Heimatländern in die Zoos der Welt 69 Vikunjas exportiert. Vor allem diese Importe steigerten den Bestand von 11 Vikunjas im Jahre 1945 auf 59 im Jahre 1985. Nur 4 Hengste und 8 Stuten (darunter ein besonders wichtiges Paar, das 1949 von Argentinien in den Zoo Zürich kam), die zwischen 1949 und 1971 aus Südamerika importiert wurden, begründeten die heutige gesunde Zoopopulation, die 88% der genetischen Vielfalt der Art repräsentiert und einen durchschnittlichen Inzuchtkoeffizient von 0,12 aufweist. Von 1946-2018 wurden 1'095 Vikunjas ausserhalb der vier (bzw. fünf) Heimatländer geboren. Das jährliche Populationswachstum durch Geburten betrug bis 1985 0,2%, steigerte sich seit Beginn des EEPs aber auf 5,9%! In manchen Zoos werden Vikunjas mit anderen Arten vergesellschaftet, so z.B. mit Großem Ameisenbär, Viscacha, Capybara, Tapir, Nandus, Halsband-Wehrvogel, Seriema oder Waldstorch [8]. WEIGL gibt als Höchstalter ungefähr 21 Jahre für eine im Londoner Zoo gehaltene Wildfang-Stute an [10], effektiv sind es aber 31 Jahre und 7 Monate für einen in Antwerpen geborenen und in Paris gestorbenen Hengst. Haltung in europäischen Zoos: Die Art wird in rund 80 Zoos gehalten, von denen sich über ein Viertel im deutschsprachigen Raum befinden. Für Details siehe Zootierliste. Das seit 1985 bestehende Europäische Erhaltungszuchtprogramm (EEP) wird vom Zoo Zürich koordiniert. Dieser hat mit weit über 100 Jungtieren die weltweit erfolgreichste Vikunjazucht. Interessant ist, dass die hauptsächliche Geburtssaison in der Nordhemisphäre von August bis Oktober sich gegenüber derjenigen in der Südhemisphäre um genau sechs Monate verschoben hat. Sogar in der 6. Zoogeneration werden 79% aller Jungtiere vormittags geboren – genau wie im Freiland, wo diese Geburtszeit überlebenswichtig ist [9]. Wie Flachlandtapire gehalten werden (Beispiele): Forschung im Zoo: Vikunjas sind gelegentlich Gegenstand von Forschung oder forschendem Lernen im Zoo, etwa von Arbeiten, die darauf abzielen, die Haltungsbedingungen zu optimieren [6; 7]. Mindestanforderungen an Gehege: Nach dem Säugetiergutachten 2014 des BMEL soll für 6 Vikunjas ein Außengehege von 300 m² vorhanden sein und soll für jedes weitere Tier die Fläche um 25 m² erweitert werden. Sofern ein Stall angeboten wird, soll die Fläche mindestens 2 m² pro Tier betragen.> Das Säugetiergutachten gibt vor, dass Kameliden in kleinen Gruppen zu halten sind. Um Aggressionen und Kämpfe zu vermeiden, dürfe nur 1 erwachsenes Männchen pro Gruppe (Einmännchen-Vielweibchen-Gruppe) gehalten werden. Tatsächlich gibt es aber beim Vikunja nebst Haremsgruppen die aus einem Hengst und meist 3-5 Stuten und deren Nachwuchs bestehen auch Junggesellenverbände von bis zu 155 Tieren sowie solitär lebende Hengste. Im Rahmen des EEP werden mehrere kleine Junggesellengruppen gehalten. Die Vorgabe des Gutachtens ist also falsch. Die Schweizerische Tierschutzverordnung (Stand 01.06.2022) schreibt für 6 Vikunjas ein Gehege von 300 m² und für jedes weitere je 50 m² zusätzlich, sowie pro Tier einen Unterstand oder einen Stallplatz von 2 m² vor. Die 2. Tierhaltungsverordnung Österreichs (Stand 2023) verlangt für 5 Vikunjas eine Mindestgehegefläche von 800 m² und für jedes weitere 80 m² zusätzlich. Es ist ein Unterstand mit einer Fläche von 2 m² pro Tier anzubieten. Taxonomie und NomenklaturDas Vikunja wurde 1782 von dem italienischen Jesuiten und Naturforscher Giovanni Ignazio MOLINA unter der Bezeichnung "Camelus vicugna" erstmals wissenschaftlich beschrieben. Später kam es in die 1800 vom französischen Naturforscher und Direktor der Ménagerie von Paris, Georges CUVIER, aufgestellte Gattung Lama. 1842 stellte es der französische Arzt und Naturforscher René Primevère LESSON in die monotypischen Gattung Vicugna. Dies war jedoch nicht unumstritten, viele Autoren führten es in derselben Gattung wie das Guanako, also Lama und zeitweilig Auchenia, was in Anbetracht, dass die beiden Arten fruchtbare Hybriden hervorbringen, nachvollziehbar ist. Im Handbuch der Säugetiere läuft es wieder unter Vicugna [1; 3, 4; 12]. Aufgrund molekulargenetischer Untersuchungen kamen Taxonomen 2006 zum Schluss, dass das Nördliche Vikunja (Vicugna vicugna mensalis) die Stammform des Alpakas sei. Allerdings waren im Genmaterial der untersuchten Alpakas häufig auch vom Guanako stammende Elemente zu finden, was auf eine bedeutende Hybridisierung von Alpaka und Lama hinweist. Diese war in jüngster Zeit besonders stark, hat sicher aber auch schon früher stattgefunden [11]. |
Literatur und Internetquellen
- BREHM, A. E. (1882-1887)
- CITES TRADE DATA BASE
- GRZIMEK, B. (Hrsg. 1970)
- HONACKI, J.H., KINMAN, K.E. & KOEPPL, J.W. (1982)
- ACEBES, P., WHEELER, J., BALDO, J. et al. (2018). Vicugna vicugna (errata version published in 2019). The IUCN Red List of Threatened Species 2018: e.T22956A145360542. https://dx.doi.org/10.2305/IUCN.UK.2018-2.RLTS.T22956A145360542.en. Accessed on 23 January 2023.
- MÜNCHAU, B. (1980)
- PICHLER, C. (2009)
- PUSCHMANN, W., ZSCHEILE, D., & ZSCHEILE, K. (2009)
- SCHMIDT, C.R. (2008)
- WEIGL, R. (2005)
- WHEELER, J. C., CHIKHI, L. & BRUFORD, M. W. (2006)
- WILSON, D. E. et al. eds. (2009-2019)

Vikunjas in ihrem natürlichen Lebensraum. San Guillermo-Nationalpark © P.Vogt
Zurück zu Paarzeher
Weiter zu Allgemeines zu den Hirschferkeln, Moschustieren und Hirschen
Trampeltier
Überordnung: LAURASIATHERIA
Taxon ohne Rang: CETARTIODACTYLA
Ordnung: Paarzeher (ARTIODACTYLA)
Unterordnung: Schwielensohler (Tylopoda)
Familie: Kamele(Camelidae)
Tribus: Altweltkamele (Camelini)
Trampeltier
Camelus bactrianus • The Bactrian Camel • Le chameau à deux bosses
- Körperbau und Körperfunktionen
- Verbreitung
- Lebensraum und Lebensweise
- Gefährdung und Schutz
- Bedeutung für den Menschen
- Haltung
- Taxonomie und Nomenklatur
- Literatur und Internetquellen
|
Weitere Bilder auf BioLib |
Trampeltiere sind nicht nur äußerst populäre Zootiere, sondern wegen ihrer anatomischen und physiologischen Besonderheiten, ihrer Lebensweise und kulturellen Bedeutung auch von hohem zoopädagogischem Wert. Obwohl Haustiere, können sie als Botschafterarten für den Schutz von Grasländern und anderen ariden Lebensräumen dienen. Körperbau und KörperfunktionenDas zweihöckerige Trampeltier gehört mit einer Kopf-Rumpflänge von bis zu 345 cm, einer Höhe (mit Höcker) von bis zu 230 cm und einem Gewicht von bis zu 1000 kg zu den größten Huftieren. Neben den aus Fettgewebe bestehenden Höckern weisen sie noch eine Reihe weiterer anatomischer Besonderheiten auf: die Oberlippe ist gespalten und dient als Greiforgan, die Nasenlöcher sind verschliessbar, im Oberkiefer fehlen die mittleren Schneidezähne, die 2. und 3. Schneidezähne sind nach hinten verlagert, am Hinterkopf befinden sich bei Stuten und Hengsten ein Paar Brunstdrüsen, beim Hengst ist das Gaumensegel als "Brüllsack" ausgebildet, der Magen ist, anders als bei den "echten" Wiederkäuern, dreihöhlig (der Psalter fehlt), am Oberschenkel hat es keine Spannhaut (Kniefalte), die Zehenknochen verlaufen nicht in einer geraden, sondern einer gebrochenen Linie. Das Nagelendglied trägt einen kleinen Nagel mit gekrümmter Hornwand, der Fuss ist mit einem hochelastischen Sohlenpolster aus Binde- und Fettgewebe versehen und weist eine breite Auftrittsfläche auf. Das Euter der Stuten hat 4 Zitzen mit je 3 Strichkanälen [5; 6; 7; 10]. Zu den physiologischen Besonderheiten gehört der geringe Wasserbedarf, der u.a. darauf beruht, dass die Tiere ihre Körpertemperatur von 34 °C auf über 40 °C erhöhen können. So wird die extreme Hitze im Körper gespeichert und während der Nacht bei kühleren Temperaturen abgegeben, ohne dass die Tiere Wasser verlieren. Erst nach Erreichen der maximalen Körpertemperatur beginnt ein Kamel zu schwitzen. Auch wird er Harn in extrem konzentrierter Form ausgeschieden und der Kot ist relativ trocken, wodurch Wasser eingespart wird [5; 6; 7; 10]. VerbreitungDas Trampeltier wird hauptsächlich in Iran, Afghanistan, Pakistan, Kasachstan, der Mongolei und China gehalten, kommt aber bis in die Türkei und Ostsibirien vor. Lebensraum und LebensweiseHistorischer Lebensraum des Trampeltiers sind die Grasländer, Halbwüsten und winterkalten Wüsten Zentrasiens. Die Nahrung setzt sich aus Gräsern, Kräutern und Blättern und Zweigen von Sträuchern zusammen. Eine der wichtigsten Futterpflanzen ist der Saxaul (Haloxylon ammodendron), ein Strauch bzw. niedriger Baum aus der Familie der Fuchsschwanzgewächse (Amaranthaceae). Trampeltiere können längere Durstphasen dadurch überstehen, dass sie körpereigenes Wasser abbauen, ohne dass das Blut eingedickt wird, und dadurch massiv an Gewicht verlieren. Sie können auch Brackwasser aufnehmen und, wenn Süßwasser verfügbar wird, durch die Aufnahme großer Mengen ihre Wasservorräte wieder auffüllen [5; 10]. Nach einer Tragzeit von im Mittel 406 (365-440) Tagen wird in der Regel ein einzelnes Fohlen mit einem Geburtsgewicht von 44 (30-60) kg geworfen. Zwillinge sind selten. Die meisten Geburten fallen in die Monate März und April. Die Fohlen werden etwa 11-12 Monate gesäugt, nehmen aber bereits mit 14 Tagen erstmals feste Nahrung auf [5; 7]. Bedeutung für den MenschenWirtschaftliche Bedeutung: Kamele sind für das Leben der Nomaden der asiatischen Wüsten und Trockensteppen lebenswichtig. Sie werden als Reit- und Lasttiere eingesetzt und liefern Fleisch, Milch, Wolle, Leder und Dung als Brennstoff. Die Milch hat nicht nur einen großen Nährwert, sondern auch einen Vitamin-C-Gehalt, der vier- bis sechsmal so hoch ist, wie der von Kuhmilch, weshalb sie oft die wichtigste Vitamin-C-Quelle für die Bevölkerung darstellt [5]. Vereinzelt gibt es auch bei uns Kamelhöfe, auf denen Wolle und Kamelmilch, zum Teil auch Fleisch, gewonnen und verarbeitet wird, die aber primär touristisch ausgerichtet sind, indem sie Kamelprodukte ab Hof verkaufen sowie Kamelreiten und -trekking anbieten. BREHM schreibt über die Nutzung des Trampeltiers, von dessen geistigen Fähigkeiten er wenig hält, dessen Nützlichkeit er aber sehr rühmt: "Es leistet viel nach jeder Richtung hin und kann durch kein anderes Hausthier ersetzt werden. Man nutzt Haar und Milch, Fell und Fleisch, spannt es an den Wagen und verwendet es als Lastthier. Seinem Nacken bürdet man Lasten auf, welche man auf vier Pferde vertheilen müßte; mit ihm durchzieht man die wasserlosen wüstenhaften Steppen, in denen Pferde ihre Dienste versagen würden; auf ihm erklimmt man Gebirge bis zu zweitausend Meter unbedingter Höhe, in denen nur der Jack noch aushält." "Im zweiten Jahre wird dem Füllen die Nase durchstochen und der Zaumpflock in die so gebildete Oeffnung gesteckt; denn von jetzt an beginnt seine Abrichtung. Im dritten Jahre seines Alters wird es kurzen Ritten, im vierten zum Tragen leichter Lasten benutzt; im fünften Jahre gilt es als erwachsen und arbeitsfähig. Bei guter Behandlung kann es bis zum fünfundzwanzigsten Jahre Dienste leisten." [2] Kulturelle Bedeutung: Haltung im ZooKamele lassen sich mit anderen Huftierarten vergesellschaften, etwa mit Przewalskipferden, Kulanen, Yaks oder Kropfgazellen. Allerdings kann es bisweilen Probleme zwischen männlichen Tieren geben [7]. WEIGL gibt als Höchstalter 35 Jahre und 5 Monate für eine im Kopenhagener Zoo geborene Stute an [9]. Haltung in europäischen Zoos: Die Art wird in rund 410 Zoos gehalten, von denen sich über ein Viertel im deutschsprachigen Raum befinden. Für Details siehe Zootierliste. Wildkamele wurden noch nie nach Europa eingeführt. Domestizierte Trampeltiere werden nicht nur in Zoos, sondern auch von vielen kleineren Tierparks, Zirkussen und Privatpersonen gehalten. Forschung im Zoo: Trampeltiere sind gelegentlich Gegenstand von Forschung oder forschendem Lernen im Zoo. Die Arbeiten dienen entweder dazu, unser Grundlagenwissen zu erweitern, wie z.B. Untersuchungen zur Hämatologie [3, 8] oder zielen darauf ab, die Zucht und Haltungsbedingungen zu optimieren [4; 6]. Mindestanforderungen an Gehege: Nach dem Säugetiergutachten 2014 des BMEL soll für 3 Trampeltiere ein Außengehege von 300 m² vorhanden sein und soll für jedes weitere Tier die Fläche um 50 m² erweitert werden. Sofern ein Stall angeboten wird, soll die Fläche mindestens 8 m² pro Tier betragen. Die Schweizerische Tierschutzverordnung (Stand 01.06.2022) schreibt für 3 Kamele ein Gehege von 300 m² und für jedes weitere 50 m² mehr sowie pro Tier einen Stallplatz von 8 m² vor. Die 2. Tierhaltungsverordnung Österreichs (Stand 2023) fordert für 5 Kamele ein Gehege von 800 m², für jedes weitere 80 m². Taxonomie und NomenklaturDas Trampeltier ist eine Haustierform, die vor etwa 4'500 Jahren domestiziert wurde. Als seine Wildform wird das Wildkamel (Camelus ferus), angesehen, was neuerdings aufgrund molekulargenetischer Untersuchungen jedoch angezweifelt wird [13]. Das Wildkamel ist in Kasachstan bereits ausgestorben und mit einem kontinuierlich abnehmenden Totalbestand von gegenwärtig weniger als erwachsenen 1'000 Tieren in China und der Mongolei, wo es in den Wüsten Gobi und Gashun Gobi vorkommt, vom Aussterben bedroht (Rote Liste: CRITICALLY ENDANGERED). Die Hauptgefahren sind Hybridisierung mit Hauskamelen und Konkurrenzierung durch die Haustierherden der Nomaden. Es ist nach Anhang I des Bonner Übereinkommens über wandernde Tierarten geschützt. Die in Großbritannien registrierte Stiftung zum Schutz des Wildkamels (Wild Camel Protection Foundation, WCPF) wurde 1997 gegründet. Sie betreibt seit 2003 in der Mongolei ein Erhaltungszuchtprogramm für Wildkamele wozu 12 Kamele gefangen und in eine in Zakhyn Us, innerhalb der Pufferzone des Great Gobi Strictly Protected Area ‘A’, gelegene Zuchtstation verbracht wurden [7; 10; 11; 12]. Wissenschaftlich beschrieben wurden zuerst die Haustierformen der Altwelt-Kamele, nämlich 1758 durch Carl von LINNÉ, der dem Trampeltier den Namen Camelus bactrianus gab, obwohl in Baktrien, der Gegend um Buchara, nicht Trampeltiere sondern Dromedare gehalten wurden. Das Wildkamel wurde von Nikolaj Michajlowitsch PRZEWALSKI 1878 in der Lop-Nor-Wüste entdeckt und mit dem Namen Camelus ferus versehen [5; 10]. Da das Trampeltier vermutlich vom Wildkamel abstammt, müsste es nach BOHLKEN [1] Camelus ferus forma bactriana heissen. Die auch vom HANDBOOK [10] übernommene Praxis, Wild- und Haustierform als Unterarten anzusehen, ist abzulehnen Trampeltier und Dromedar lassen sich kreuzen. Die Nachkommen werden Tulus genannt. Sie sind größer und stärker als ihre Eltern und haben nur einen eingedellten Höcker und sind fruchtbar. Tuluhengste der F1-Generation werden in Teilen Anatoliens zu den dort traditionellen Kamel-Ringkämpfen (Camel wrestling) eingesetzt. Diese Kämpfe gibt es seit rund 2'400 Jahren. Sie finden jeweils während der Brunftzeit der Kamele statt, hauptsächlich von Januar bis März. Die Tiere werden geschmückt und ähnlich wie bei den Eringer Kuhkämpfen im Wallis paarweise in eine Arena geführt. Der Verlierer wird beim Kampf nicht beschädigt, sondern lediglich verdrängt oder niedergerungen. In der seit 1923 bestehenden türkischen Republik wurden die Kamelkämpfe anfänglich diskreditiert, da sie nicht dem vom Staat angestrebten Image eines modernen Landes entsprachen, wurden aber ab 1983 als Attraktion für Touristen wiederbelebt. Seitdem ist die Zahl der Tulubesitzer von 200 auf über 2'000 gestiegen [14]. |
Literatur und Internetquellen
- BOHLKEN , H. (1958)
- BREHM, A. E. (1882-1887)
- EICHNER, M. (1999)
- FRANCKE, R. (1989)
- GRZIMEK, B. (Hrsg. 1970)
- MÜNCHAU, B. (1980)
- PUSCHMANN, W., ZSCHEILE, D., & ZSCHEILE, K. (2009)
- WEDDING, S. (1979)
- WEIGL, R. (2005)
- WILSON, D. E. et al. eds. (2009-2019)
- HARE, J. (2008). Camelus ferus. The IUCN Red List of Threatened Species 2008: e.T63543A12689285. https://dx.doi.org/10.2305/IUCN.UK.2008.RLTS.T63543A12689285.en . Downloaded on 10 February 2020.
- WILD CAMEL PROTEXTION FOUNDATION.
- YI L., MING, L., HAI, L., HE, J., GUO, F-.C., QIAO, X.-Y.; JI, R. (2017)
- CHRISTIE-MILLER, A. in EURASIANET vom 27.01.2011
Zurück zu Übersicht Paarzeher
Weiter zu Dromedar (Camelus dromedarius)
Schabrackentapir
Überordnung: LAURASIATHERiA
Ordnung: Unpaarzeher (PERISSODACTYLA)
Familie: Tapire (Tapiridae)

 Schabrackentapir
Schabrackentapir
Tapirus indicus • The Malayan Tapir • Le tapir de l'Inde, ou tapir chabraque
- Körperbau und Körperfunktionen
- Verbreitung
- Lebensraum und Lebensweise
- Gefährdung und Schutz
- Bedeutung für den Menschen
- Haltung
- Taxonomie und Nomenklatur
- Literatur und Internetquellen
|
Weitere Bilder auf BioLib |
Der in seinem Ursprungsgebiet stark gefährdete Flachlandtapir ist die in europäischen Zoos mit Abstand am häufigsten gehaltene Tapirart und wurde so für viele Menschen zum Prototyp der Gattung. Seine Verwandtschaft mit den Pferdeartigen kann dazu dienen, im Zooschulunterricht Taxonomie und Evolution zu thematisieren, und als auffällige Großtierart ist er ein ausgezeichneter Botschafter für den Schutz der durch Holzeinschlag, Brandrodung und Umwandlung in Palmölplantagen gefährdeten Wälder Südostasiens Wälder. Körperbau und KörperfunktionenDer Schabrackentapir ist deutlich größer als seine neotropischen Vettern und schon aufgrund seiner Zeichnung unverwechselbar. Er erreicht eine Kopf-Rumpflänge von 250-300 cm, eine Schwanzlänge von unter 10 cm, eine Schulterhöhe von 100-130 cm und ein Gewicht von 280-400 kg. Er hat weder eine Mähne noch einen Nackenkamm. Die im Zoo auffällige, vom Kopf bis zu den Schultern schwarze, am Rumpf weiße und an den Hinterteil und Hinterbeinen wiederum schwarze Färbung hilft im natürlichen Waldlebensraum, die Körperkonturen zu verwischen. Wie bei allen Tapirarten tragen junge Schabrackentapire ein längsgestreiftes Jugendkleid. Die Schabrackenzeichnung beginnt sich erst im Alter von zehn Wochen abzuzeichnen und mit 22 Wochen sind die Streifen bis auf wenige Reste verschwunden [2; 7]. VerbreitungSüdostasien: Indonesien (Sumatra), Malaysia, Myanmar, Thailand. Ausgestorben in Kambodscha, Laos und Vietnam [5]. Lebensraum und LebensweiseDer Schabrackentapir lebt in tropischen, feuchten Primär- und Sekundärwäldern sowie in Sumpfgebieten vom Tiefland bis auf eine Höhe von 2'150 m. Er ist ein Einzelgänger, der hauptsächlich nachtaktiv ist. Als "Browser" nimmt er Blätter (über 80%) , Zweige und Früchte von über 380 Pflanzenarten zu sich. Er bricht häufig 8-10 m dicke Stämme ab, um an seine Nahrung zu gelangen. In Sumatra sind heidekrautartige Pflanzen der Gattung Symplocos die wichtigsten Futterpflanzen. Ebenfalls von Bedeutung sind Streifenfarne (Asplenium spp.), Brotfrucht- (Artocarpus spp.) und Durianbäume (Durio spp.) Der Schabrackentapirist ein schlechter Samenverbreiter, weil er Früchte und damit die Samen gründlich zerkaut. Nach einer Tragszeit von 11-13 Monaten wird in der Regel ein einzelnes Kalb geboren, das gegen zwei Jahre bei der Mutter bleibt. Die einzige bekannte Zwillingsgeburt ereignete sich im Sungai Dusun Tapirschutzzentrum in Malaysia, das gemeinsam vom Zoo Kopenhagen und dem Department of Wildlife and National Parks betrieben wird. Bei der ersten Geburt sind die Weibchen etwa 4 Jahre alt. Rund vier Monate nach einer Geburt sind sie wieder empfängnisbereit [2; 3; 8]. Gefährdung und SchutzDer Schabrackentapir ist eine stark gefährdete Tierart (Rote Liste: ENDANGERED), da seine Lebensräume oft in Palmölplantagen und andere Landnutzungen umgewandelt werden und die Bestände dadurch um mehr als 50% in den letzten 3 Generationen (36 Jahre) zurückgegangen sind. Das verbleibende Areal ist zerstückelt und die Tiere werden zusätzlich durch die Jagd bedroht [5]. Der internationale Handel ist durch CITES-Anhang I eingeschränkt. Zoogestützte Artenschutzprojekte (Beispiele):
Bedeutung für den MenschenWirtschaftliche Bedeutung: Gebietsweise wird das Fleisch des Schabrackentapirs gegessen. In Thailand wird es unter der Bezeichnung "Mu-nam" vermarktet, es ist aber nicht sonderlich populär. Sportjagd ist verboten, kommt aber vor [2; 5]. Kulturelle Bedeutung: Bei den Moslems gelten Schabrackentapire als Schweine und werden deshalb nicht bejagt. Die Bestände leiden natürlich aber trotzdem unter der fortschreitenden Waldzerstörung. Der Schabrackentapir wird auf einer Reihe von Briefmarken dargestellt. Interessanterweise auch auf einer aus britischer Kolonialzeit stammenden Briefmarke für "Nordborneo" (heute: Sabah und Sarawak), obwohl die Art auf Borneo gar nicht vorkommt. HaltungFür den Schabrackentapir gibt es seit 1984 ein Internationales Zuchtbuch, das am Taman Safari Indonesia in Bogor geführt wird. Dieses umfasste im Juni 2916 271 lebende Tiere in 90 Einrichtungen [IZY 52]. Den veröffentlichten Altersrekord in Menschenobhut hält ein im Tiergarten Nürnberg geborener weibliche Schabrackentapir, der im Alter von 36 Jahren und 6 Monaten in der Wilhelma Stuttgart starb [6]. Haltung in europäischen Zoos: Die Art wird in über 20 Zoos gehalten, von denen sich ein paar wenige im deutschsprachigen Raum befinden. Für Details siehe Zootierliste. Seit 1992 gibt es ein Europäisches Erhaltungszuchtprogramm (EEP), das 2021 58 lebende Tiere umfasste und in ein "New Style"-EEP umgewandelt wurde. Das Programm wird vom Tiergarten Nürnberg koordiniert. Forschung im Zoo: Von 1997-2000 wurde eine vergleichende Untersuchungen zu Verhalten und Schauwert von Tapiren in Zoologischen Gärten durchgeführt, die von den Zoos Berlin, Dortmund, Heidelberg, München, Nürnberg, Wuppertal und Zürich gefördert wurde und auch zwei amerikanische Zoos miteinschloss [5]. Eine andere Dissertation befasste sich mit der innerartlichen Kommunikation [9] und eine weitere mit der Gewinnung, Beurteilung und Konservierung von Sperma [1]. Mindestanforderungen an Gehege: Im Säugetiergutachten 2014 des BMEL wird für die Haltung von Tapiren generell ein Innengehege von 15 m² pro Tier vorgegeben, ohne den Artunterschieden und den unterschiedlichen Haltungssystemen Rechnung zu tragen. Es besteht aber ein erheblicher Größenunterschied zwischen Süd- und Mittelamerikanischen Tapiren einerseits und Schabrackentapir andererseits. Die Tierschutz-Sachverständigen der Zoos hielten daher folgende Vorgabe für angemessen: Da die Tiere im Winter nur beschränkt Zugang zum Außengehege haben, wird in der Regel auch innen ein Gemeinschaftsgehege angeboten. Die Möglichkeit der Einzelaufstallung ist aber zu gewährleisten. Für Mittelamerikanische Tapire müssen Boxen in Verbindung mit einem zusätzlichen, größeren Gemeinschaftsstall (ab ca. 30, besser 40 m²) eine Fläche von 12 m² haben. Nur wenn kein Gemeinschaftsstall angeboten wid, müssen Boxen mindestens 15 m² groß sein, wie im Gutachten und in der Schweizerischen Tierschutzverordnung sowie approximativ in den AZA-Haltungsstandards [5] vorgegeben. Die Schweizerische Tierschutzverordnung (Stand 01.06.2022) schreibt für bis zu zwei Tapire ein Außengehege mit einer Mindestfläche von 200 m², für jedes weitere Tier 50 m² mehr vor. Pro Tier ist eine Innenbox von 15 m² erforderlich. Außen und innen muss ein Badebecken mit einer Fläche von 10 m² und einer mittleren Tiefe von 80 cm vorhanden sein. Die 2. Tierhaltungsverordnung Österreichs (Stand 2023 fordert für ein Paar ein Außengehege von 200 m², für jedes weitere Tier 20 m² mehr. Pro Tier ist eine Stallfläche von 20 m² notwendig und es ist außen wie innen eine Bademöglichkeit einzurichten. Taxonomie und NomenklaturDer Schabrackentapir wurde 1819 vom französischen Zoologen Anselme Gaëtan DESMAREST unter seinem heite noch gültigen Namen beschrieben. Die Existenz einer rein schwarz gefärbten Unterart brevetianus aus Sumatra ist zweifelhaft. Manche Autoren wollen die Art in einer eigenen Gattung unterbringen, wozu der Name Acrocodia aus dem Jahr 1913 ausgegraben wurde [7; 8]. |
Literatur und Internetquellen
- FRANCKE, R. (1989)
- GRZIMEK, B. (Hrsg. 1970)
- SHOEMAKER A. H., BARONGI R., FLANAGAN J. & JANSSEN D. (2004)
- SEITZ, S. (2001)
- TRAEHOLT, C. et al. (2016). Tapirus indicus. The IUCN Red List of Threatened Species 2016: e.T21472A45173636. http://www.iucnredlist.org/details/21472/0. Downloaded on 24 May 2018.
- WEIGL, R. (2005)
- WILSON, D. E. et al. eds. (2009-2019)
- WILSON, D. E. & REEDER, D. M. (2005)
- ZENZINGER, S. (2008)
- EAZA REGIONAL COLLECTION PLAN - Tapir and Suiform Taxon Advisory Group - July 2021
Zurück zu Übersicht Unpaarzeher
Weiter zu Flachlandtapir (Tapirus terrestris)


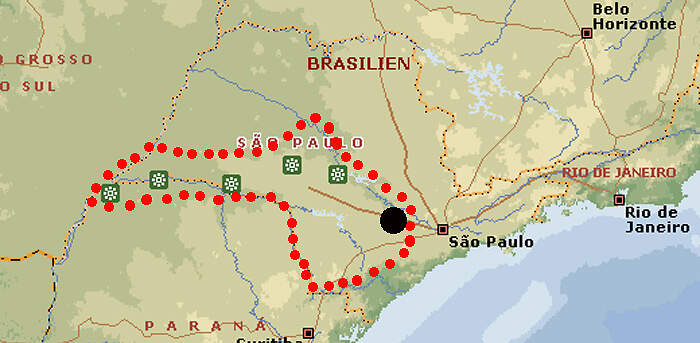







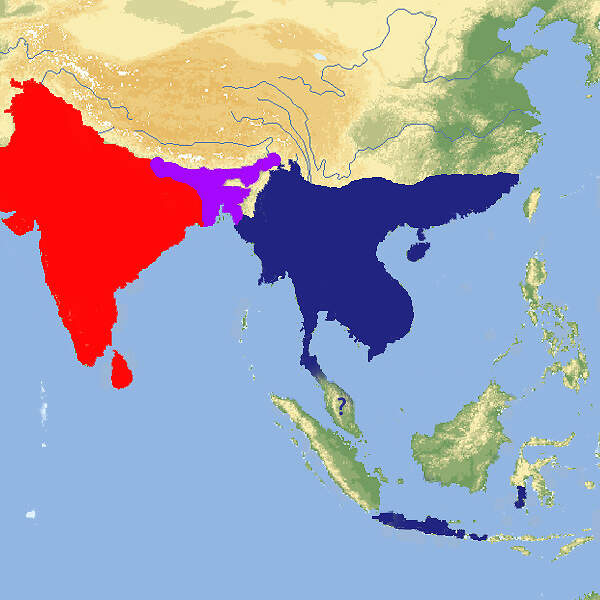











.jpg)




.jpg)
.jpg)



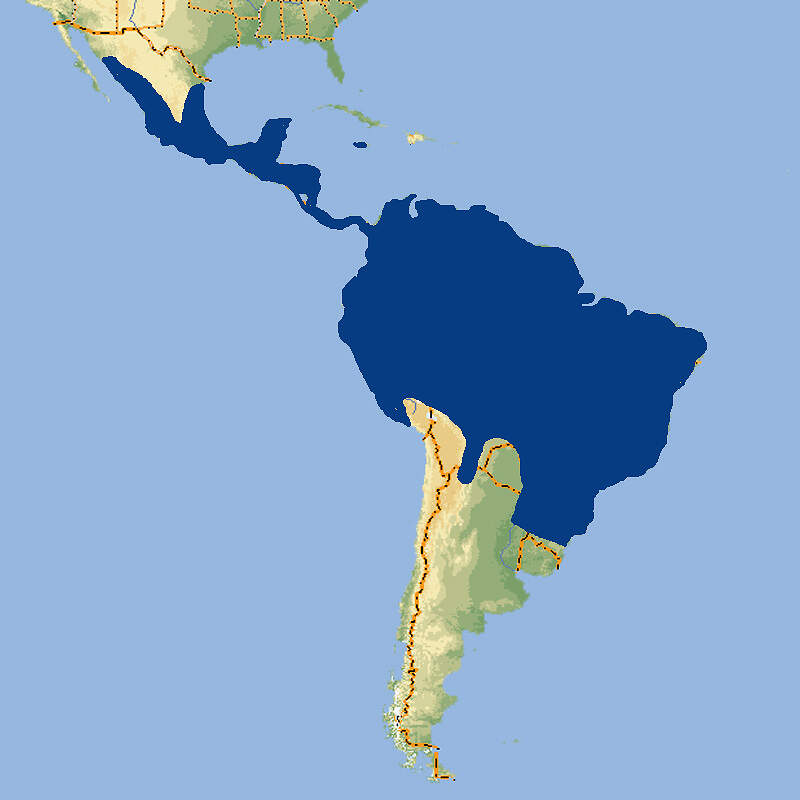





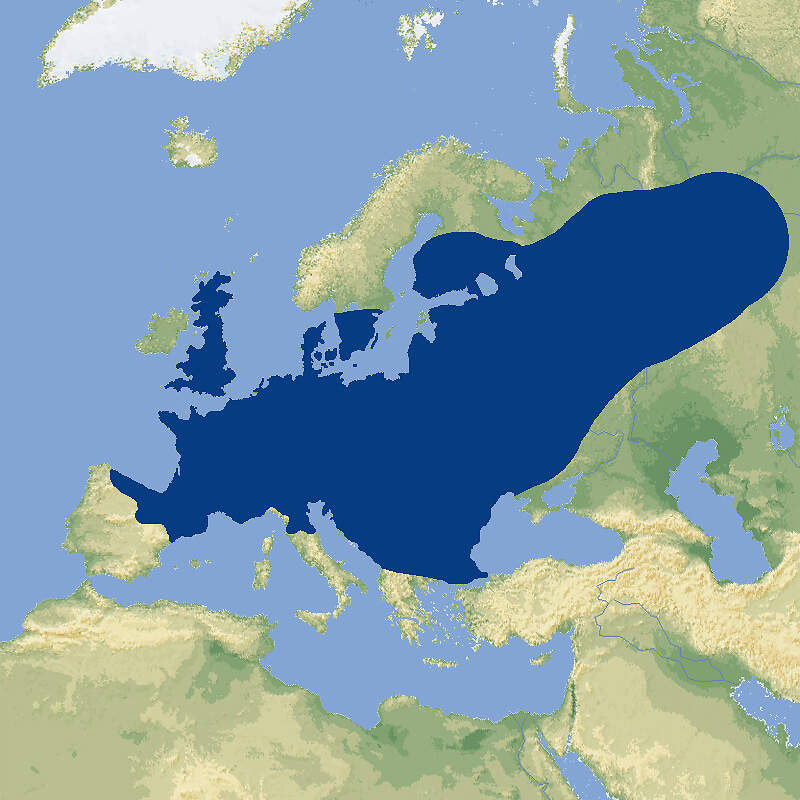



.jpeg)
.jpeg)




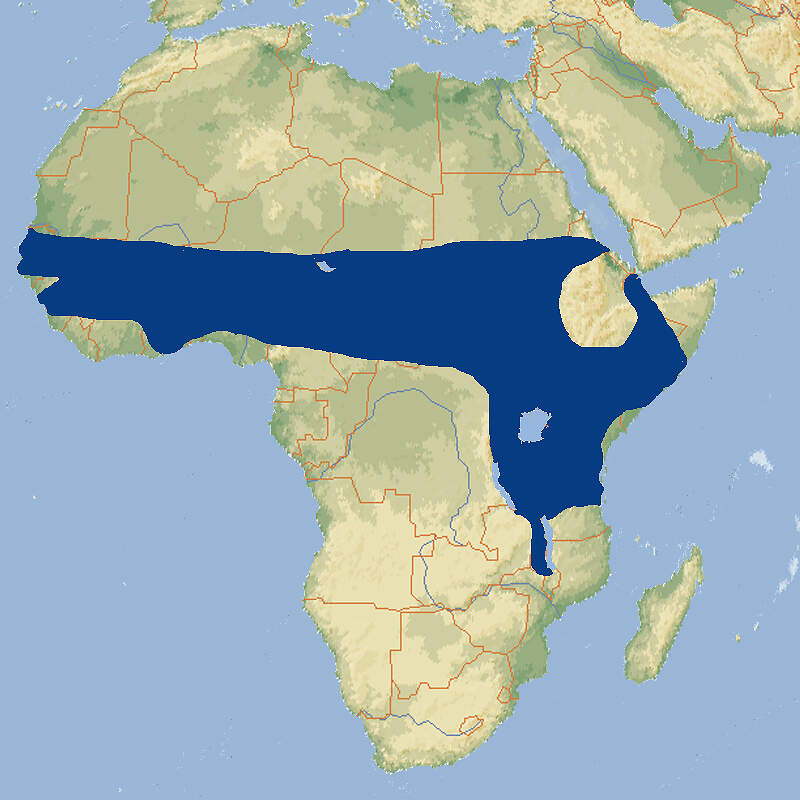







.jpg)


























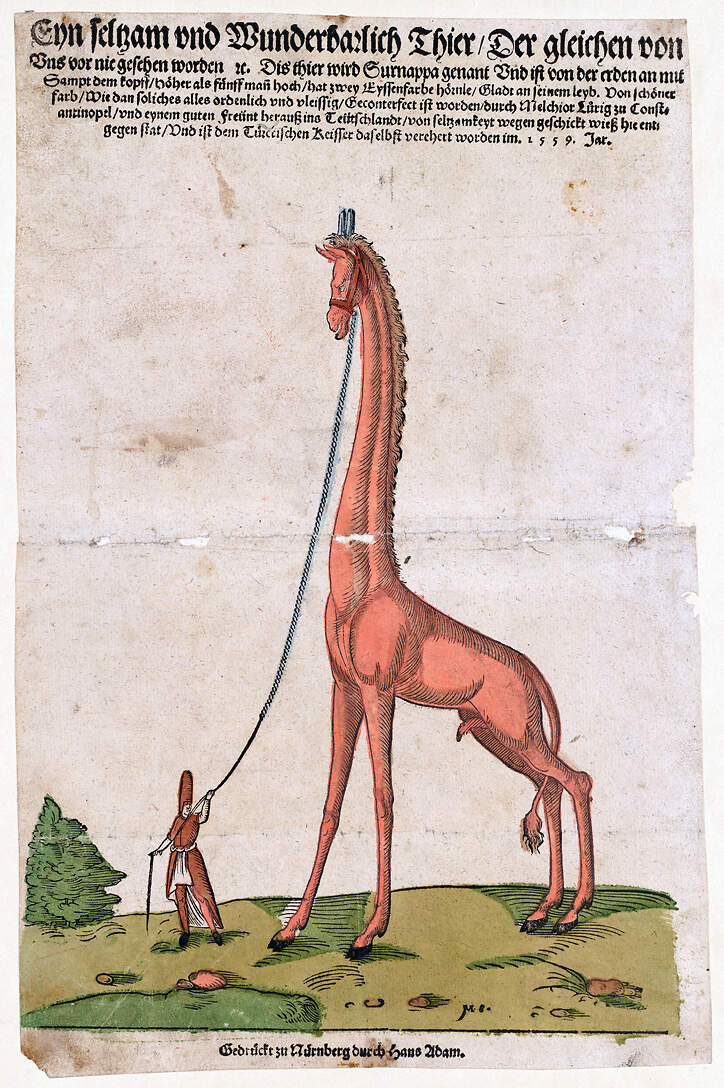














.jpg)



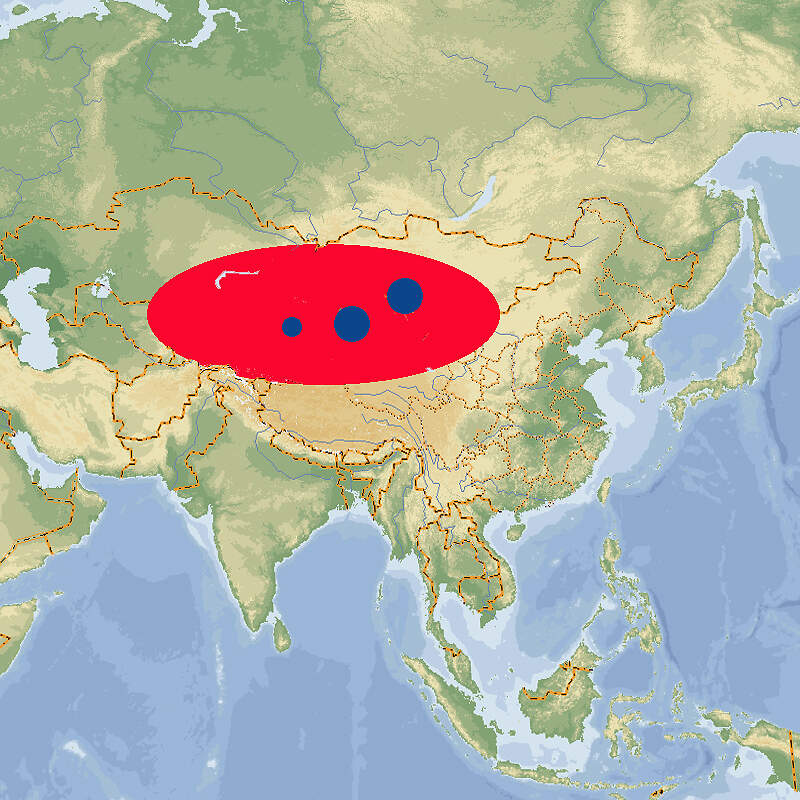
















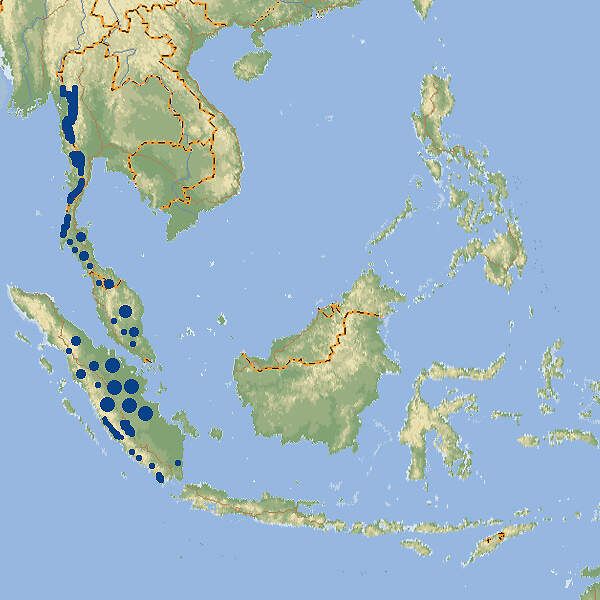






.jpg)

