Grosser Streifenbeutler
 |
Neue Tierart
|
Unterklasse: Beuteltiere (MARSUPIALIA)
Ordnung: Känguruverwandtschaft (DIPROTODONTIA)
Unterordnung: Kuskusse und Gleitbeutler (Phalangeriformes)
Familie: Gleitbeutler (Petauridae)

Großer Streifenbeutler
Datylopsila trivirgata • The Striped Possum • Le phalanger au pelage rayé
- Körperbau und Körperfunktionen
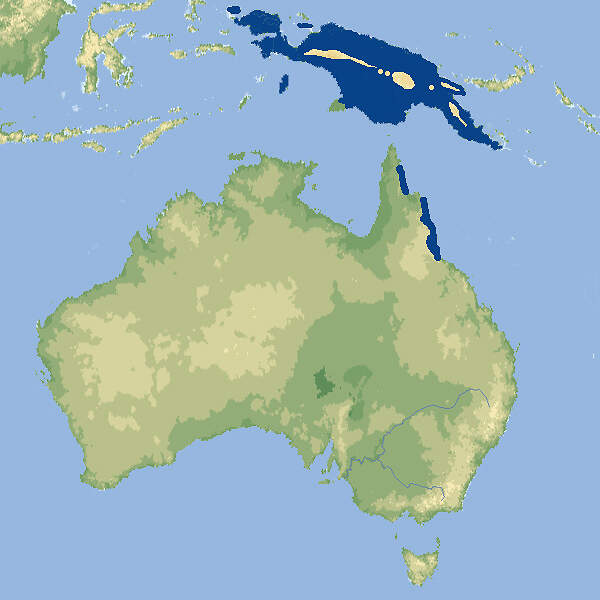
- Verbreitung
- Lebensraum und Lebensweise
- Gefährdung und Schutz
- Bedeutung für den Menschen
- Haltung
- Taxonomie und Nomenklatur
- Literatur und Internetquellen
|
Weitere Bilder auf BioLib |
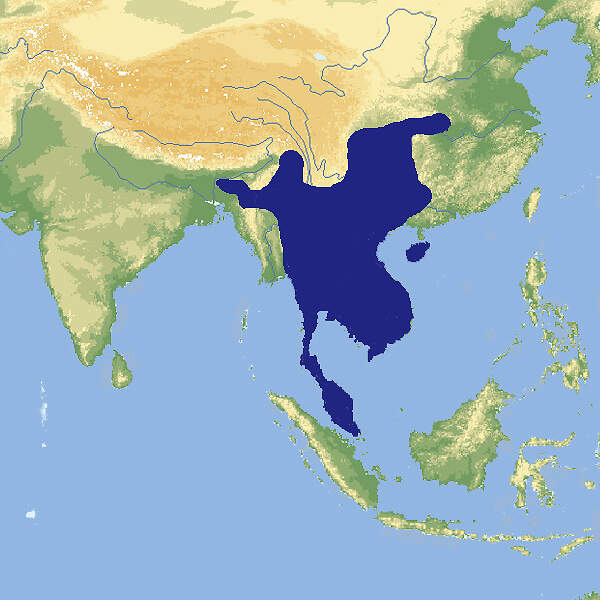
Der Große Streifenbeutler gehört zu den mittelgroßen Arten der Gleitbeutler-Familie. Es handelt sich um eine nicht-gefährdete, nachtaktive Art, die in europäischen Zoos stets selten war und seit einigen Jahren nicht mehr gehalten wird, obwohl sie wegen ihrer Konvergenz zum Aye-Aye von zoopädagogischem Interesse ist Körperbau und KörperfunktionenGroße Streifenbeutler haben eine Kopf-Rumpfläng von 24-28 cm, der Schwanz ist mit 32.39 cm deutlich länger. Männchen wiegen 428-545 g und Weibchen 310-475 g. Das Fell weist eine schwarz-weiße oder schwarz-graue Längsstreifung auf. Der Schwanz ist grau-schwarz und längst nicht so buschig wie bei dem in etwa gleichgroßen Buschschwanz-Streifenbeutler (D. megalura). Die Weibchen haben in ihrem Beutel zwei Zitzen. Die Tiere haben einen äußerst unangenehmen Eigengeruch. Verschiedene Merkmale stellen eine konvergente Entwicklung zum Fingertier dar: Die Schneidezähne sind vergrößert, die oberen nach vorn gerichtet und die unteren stark verlängert, die Finger sind praktisch unbehaart, und der vierte Finger ist verlängert. Dies ermöglicht den Tieren, Löcher in die Baumrinde zu bohren und die darunter befindlichen Insektenlarven herauszuangeln [1; 6]. VerbreitungAustralasien: Indonesien (West-Papua, Aru-, Waigeo- und Yapen-Inseln), Papua-Neuguinea und Australien (Queensland) [3]. Lebensraum und LebensweiseGroße Streifenbeutler sind Baumbewohner, die primäre und sekundäre Feuchtwälder sowie angrenzende Eukalyptus- und Teebaum-Savannen (Melaleuca alternifolia) vom Meersspeigel bis auf eine Höhe von 2'300 m besiedeln. Sie sind nachtaktiv und schlafen tagsüber in Nestern aus Blättern, die in Baumhöhlen oder in Gewirren von Lianen angelegt werden. Sie leben außerhalb der Paarungszeit solitär bzw. in Mutterfamilien. Die Tiere können weite Sprünge von Baum zu Baum durchführen [1; 4; 6]. Große Streifenbeutler ernähren sich in erster Linie von Insekten, wie Ameisen, Termiten, Käfern, Grillen oder Schmetterlingen, daneben nehmen sie in geringem Umfang Baumsäfte, Pollen, Blütennektar und Früchte zu sich. Es gibt keine eigentliche Fortpflanzungsperiode, jedoch kommt es von März-Juni gehäuft zu Geburten. In Neuguinea wurden Paarungen von Januar-Oktober beobachtet. Die Weibchen bringen in der Regel einen Wurf mit (1-)2 Jungen pro Jahr zur Welt [1; 2]. Gefährdung und SchutzDer Große Streifenbeutler gilt trotz negativem Bestandstrend aufgrund einer Beurteilung aus dem Jahr 1996, letztmals überprüft 2016, nicht als gefährdet (Rote Liste: LEAST CONCERN), weil er weitverbreitet ist, mutmaßlich eine große Gesamtpopulation hat, in etlichen Schutzgebieten vorkommt, unterschiedliche Lebensräume nutzen kann und auch in veränderten, degradierten Lebensräumen leben kann [4]. Der internationale Handel ist nicht unter CITES geregelt. Für lebende Tiere gelten Ausfuhrbeschränkungen Australiens. Die nach Europa eingeführten Tiere stammten, soweit bekannt, aus Neuguinea (West-Papua). Bedeutung für den MenschenGroße Streifenbeutler werden von der indigenen Bevölkerung Neuguineas zur Fleisch- und Pelzgewinnung gejagt. Die Pelze werden für kulturelle Rituale verwendet [1; 4]. HaltungNach JACKSON soll für ein Paar Tiere eine Gehegefläche von 9 m² bei einer Höhe von 3 m nicht unterschritten werden, für jedes weitere Tier soll 4 m² Bodenfläche zusätzlich angeboten werden [2]. Der älteste bekannte Große Streifenbeutler in einem Zoo wurde im Londoner Zoo geboren und starb ebendort im Alter von 9 Jahren und 7 Monaten [5]. Haltung in europäischen Zoos: Die Art war in Zoos stets selten, Nachzuchten waren die Ausnahme, und 2020 starben die beiden letzten Tiere im Zoo von Jihlava / Iglau. Für Details siehe Zootierliste. Mindestanforderungen an Gehege: Nach Säugetiergutachten 2014 des BMEL soll das Gehege für 1 -2 Tiere eine Mindestfläche von 6 m² bei einer Höhe von 2 m messen. Für jedes weitere Tier soll die Grundfläche angemessen (um ca. 0.6 m²) erhöht werden. Die Tierschutzverordnung der Schweiz schreibt für 6 Tiere ein Innengehege von 6 m² bei 2 m Höhe vor. Für jedes weitere Tier wird 1 m² Fläche zusätzlich verlangt. Die 2. Tierhaltungsverordnung Österreichs verlangt für ein Paar ein Innengehege von 2 m² bei 3.5 m Höhe. Für weitere Tiere werden keine Vorgaben gemacht. Taxonomie und NomenklaturDie Art wurde 1858 von John Edward GRAY vom British Museum in London unter ihrem heute noch gültigen Namen erstmals wissenschaftlich beschrieben. Sie ist die Typusart der Gattung Dactylopsila, die heute fünf Arten umfasst. Gegenwärtig werden 4 Unterarten anerkannt [6]. Der Gattungsname bezieht sich auf die beinahe unbehaarten Finger der Tiere (δάκτυλος = Finger, ψιλός = kahl). |
Literatur und Internetquellen
- ANIMAL DIVERSITY WEB
- JACKSON, S. M. (2003)
- PUSCHMANN, W., ZSCHEILE, D., & ZSCHEILE, K. (2009)
- SALAS, L. et al. (2016). Dactylopsila trivirgata. The IUCN Red List of Threatened Species 2016: e.T6226A21960093. https://dx.doi.org/10.2305/IUCN.UK.2016-2.RLTS.T6226A21960093.en. Accessed on 18 April 2023..
- WEIGL, R. (2005)
- WILSON, D. E. et al. eds. (2009-2019)
Zurück zu Übersicht Kloaken- und Beuteltiere
ROWE-ROWE, D. T. (1991)
The Ungulates of Natal.
Broschüre, 36 Seiten. Natal Parks Board, Pietermaritzburg.
Inhalt:
Für 33 Huftierarten (einschließlich Elefant) werden Angaben zu rechtlichem Status, Verbreitung und Bestand, Ansprüche an den Lebensraum, Soziale Organisation, Populationsdynamik Gefährdungen sowie Bedeutung für den Menschen gemacht. Zu jeder Art hat es eine Verbreitungskarte.
rowe-rowe-biblio
ERNST, R., LAUTENSCHLÄGER, T., FUTURO BRANQUIMA, M. & HÖLTING, M. (2020)
At the edge of extinction: a first herpetological assessment of the proposed Serra do Pingano Rainforest National Park in Uíge Province, northern Angola.
Zoosystematics and Evolution 96(1): 237-262.
Volltext: https://doi.org/10.3897/zse.96.51997
Abstract:
We systematically assess the herpetofaunal diversity of the Serra do Pingano Forest Ecosystem (SPFE) and additional localities throughout the northern Angolan province of Uíge during four independent Rapid Assessment (RA) field campaigns held between 2013 and 2019. These assessments represent the first systematic surveys of amphibians and reptiles from the province, and thus we provide the first province-wide species list. We collected data on the status and current threats to amphibians and reptiles in the proposed Serra do Pingano Rainforest National Park and were able to document 33 species of reptiles from Uíge province. Of the 33 species recorded from the province, 10 species are exclusively found in the SPFE. Amphibian surveys yielded 47 amphibian species from the province. These include 14 new country records and additional records that may represent undescribed species. This raises the amphibian count for Angola to at least 133 species, which includes 18 species exclusively found within the SPFE. Species-richness estimators indicate that more species should be detected if survey efforts are intensified. The species composition in the SPFE is unique and consists of a high proportion of forest specialists with restricted ranges and species found nowhere else in the country. This emphasizes today’s paramount importance of the SPFE, which is threatened by increasing agricultural encroachment and uncontrolled timber extraction and charcoal production. These principal factors need to be controlled and/or abandoned in already impacted areas. Conservation strategies should particularly consider the strict protection of remaining intact forests and both lentic and lotic aquatic systems. They are not only crucial for safeguarding a significant number of species that depend on these habitats for reproduction; they also provide key ecosystem services to the local population. Angola, and Uíge province in particular, is at a crossroads concerning decisions and trade-offs among utilization, conservation, and preservation of its forests and, thus, substantial parts of the country’s biodiversity. The establishment of a National Protected Area in the Serra do Pingano Ecosystem is therefore a necessary and urgently needed first step towards protecting Angola’s national biodiversity heritage.
ernst-biblio
SCHMALL, B. & FRIEDRICH, T. (2014)
Das Schicksal der großen Störarten in der Oberen Donau.
Denisia 33, zugleich Kataloge des oberösterreichischen Landesmuseums Neue Serie 163 (2014): 423-442.
Volltext (PDF)
Zusammenfassung:
Durch Fischfang und Gewässerverbauung sind die Störartigen in der Donau inzwischen stark gefährdet und teilweise nahe der Ausrottung. In der österreichischen Donau kommt als kleinste autochthone Art nur noch der Sterlet vor. In der Oberen Donau sind die vier großen Störartigen durch Migrationshindernisse und Überfischung inzwischen ausgestorben. Die Analyse historischer Quellen belegt aber zumindest für manche Arten wie den Hausen in der Vergangenheit eine große wirtschaftliche Bedeutung dieser Tiere, vor allem im Raum Wien. Die hohe Anzahl gehandelter Tiere lässt dabei auf relativ hohe Bestandsdichten in früheren Zeiten schließen. Während für den Hausen eine relativ gute Datengrundlage vorliegt ist die Zuordnung anderer Störarten aus taxonomischer Sicht deutlich schwieriger, da eine große Anzahl von Fehlbestimmungen vorliegt. Die vorliegenden Daten lassen jedoch darauf schließen, dass zumindest der Waxdick und möglicherweise der Glattdick in der Oberen Donau regelmäßig anzutreffen waren, während es keinen dezidierten Nachweis des Sternhausens für diesen Abschnitt gibt. Der Europäische Stör war in seinem Vorkommen auf die Untere Donau beschränkt und spielte für die Störfischerei in der Oberen Donau keine Rolle.
Abstract:
The fate of the large sturgeon species in the Upper Danube. The Danube is home to six sturgeon species, all of which are highly endangered and in some cases already extinct. Through overfishing in the past centuries, four species went almost extinct in the Upper Danube; later the construction of power plants and dams made spawning migrations impossible and led to their doom in the Upper and Middle Danube. In the lower part of the Danube longer spawning runs of diadromous species have been made impossible with the construction of the hydropower plants at the Iron Gate. The sterlet ( Acipenser ruthenus), the last representative of this fish family in the Austrian Danube, is ‘Fish of the Year 2014’ in Austria, while the European sturgeon
(Acipenser sturio) is ‘Fish of the Year 2014’ in Germany. This article is a compilation of three articles (S CHMALL & F RIEDRICH
2014a, 2014b; F RIEDRICH et al. 2014) and deals only partly with autecological issues but rather examines the former range limits and economic importance of these fish, and further identifies the current situation of sturgeon species in the whole Danube basin and efforts to protect them. In terms of historical sources the focus lies on the catchment of the Austrian Danube.
schmall-biblio
Goldnackenara
Ordnung: Papageienvögel (PSITTACIFORMES)
Familie: Echte Papageien (Psittacidae)
Unterfamilie: Eigentliche Papageien (Psittacinae)
Tribus: Neuweltpapageien (Arini)

Goldnackenara
Ara = Primolius auricollis • The Golden-collared Macaw • L'ara à collier jaune
- Körperbau und Körperfunktionen
- Verbreitung
- Lebensraum und Lebensweise
- Gefährdung und Schutz
- Bedeutung für den Menschen
- Haltung
- Taxonomie und Nomenklatur
- Literatur und Internetquellen
|
Weitere Bilder auf BioLib.czStimme auf XENO-CANTO |
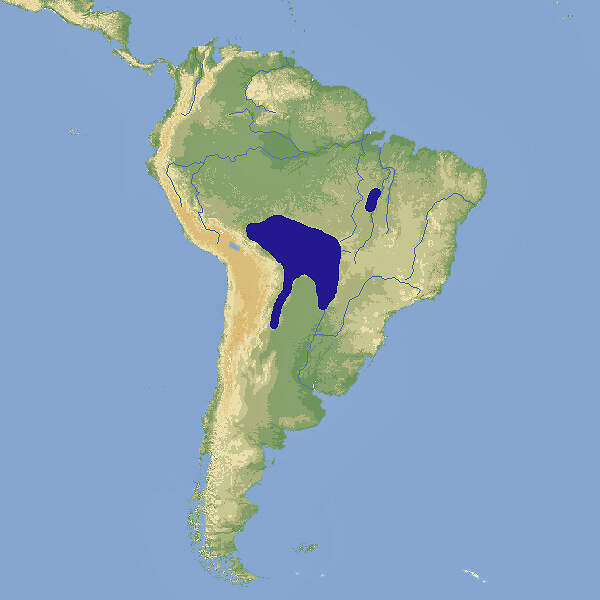
Der Goldnackenara ist ein kleiner Vertreter der Aras. In seinem Verbreitungsgebiet im tropischen und subtropischen Südamerika gilt er als ziemlich häufig und nicht gefährdet. In unseren Zoos ist er nicht allzu oft zu sehen. Körperbau und KörperfunktionenMit einer Gesamtlänge von 38-39 cm, wovon 19-22 cm auf den Schwanz entfallen, einer Flügellänge von 20-22 cm und einem Gewicht von ca. 250 g ist der Gelbnackenara noch etwas kleiner als der Marakana. Die Grundfärbung des Gefieders ist grün. Scheitel und Wangen sind bräunlich-schwarz, der Hinterkopf ist bläulich. Auffällig ist das namengebende gelbe Nackenband, das beim Männchen breiter ist als beim Weibchen. Schwungfedern, Handdecken und Schwanzunterseite sind blau, Die Flügelunterseiten sind oliv-gelb Der Schnabel ist grau-schwarz, zur Spitze hin hornfarben, die Iris orangerot. Die nackten Gesichtspartien sind cremefarben, die Füße gelblich. Jungvögel sind heller und haben ein schmaleres Nackenband und eine dunkelbraune Iris [4; 5; 7; 9; 10]. VerbreitungTropisches und subtropisches Südamerika: Argentinien, Brasilien, Bolivien, Paraguay [1]. Lebensraum und LebensweiseDer Goldnackenara besiedelt trockene oder feuchte Wälder und Savannen wie Cerrado oder Chaco in Höhenlagen bis 600 m, gerne in Wassernähe. Es sind auch Sichtungen in bis zu 2'000 m Höhe bekannt. Früher war er außerhalb der Brutzeit in großen Schwärmen anzutreffen, heute lebt er meist paarweise oder in kleinen Gruppen. Die Nahrung besteht aus Palmfrüchten, Feigen und anderen Früchten, Samen und Knospen, und es können Mais- und Getreidefelder geplündert werden. Genistet wird in Baumhöhlen hoch über dem Boden. Die Gelege bestehen aus 2-3(-4) Eiern, die während etwa 26 (23-28) Tagen bebrütet werden. Die Nestlingszeit dauert etwa 65-70 Tage [1; 5; 8; 9; 10]. Gefährdung und SchutzDer Goldnackenara hat eine weite Verbreitung. Genaue Bestandsangaben fehlen, aber es wird angenommen, dass die Bestände eher wieder zunehmen. Die Art wird deshalb seit 2004, letztmals überprüft 2016, als nicht gefährdet eingestuft (Rote Liste: LEAST CONCERN) [1]. Der internationale Handel ist nach CITES-Anhang II geregelt. Bedeutung für den MenschenDer Goldnackenara wird zur Fleischgewinnung gejagt und für den Tierhandel gefangen bzw. ausgehorstet [1]. Von 1981-1990 meldeten Argentinien die Ausfuhr von 1'554, Bolivien von 8'347, Brasilien von 4 und Paraguay von 7 Wildfängen, danach bis 2020 nur noch Argentinien 30 Stück im Jahr 2003. Von 1981-2020 wurden weltweit Exporte von 13'765 Nachzuchtvögeln erfasst, von denen 12'365 aus Südafrika stammten [3]. HaltungDie Welterstzucht gelang 1968 im Bush Gardens in Tampa FL, die deutsche Erstzucht im Vogelpark Walsrode im Jahr 1976 [8; 10]. Das nachgewiesene Höchstalter in Menschenobhut wird mit 25 Jahren angegeben, andere Quellen geben eine maximale Lebenserwartung von 30-40 bzw. von 50 Jahren an [2]. Haltung in europäischen Zoos: Die Art wird in weniger als 20 Zoos gezeigt, von denen sich einzelne im deutschsprachigen Raum befinden. Für Details siehe Zootierliste. Mindestanforderungen an Gehege: Nach Papageiengutachten des BMELF von 1995 ist für die Haltung eines Paars oder ausnahmsweise eines Einzelvogels eine Voliere mit einer Fläche von 4 x 2 m und einer Höhe von 2 m erforderlich, ferner ein Schutzraum mit einer Grundfläche von 2 m². Für jedes weitere Paar sind die Grundflächen um 50% zu erweitern. Nach Schweizerischer Tierschutzverordnung (Stand 1.2.2022) sind Goldnackaras mindestens paarweise zu halten. Für ein Paar ist ein Käfig mit Badegelegenheit, einer Grundfläche von 0.7 m² und einer Höhe von 120 cm vorgeschrieben, für jedes weitere Tier ist die Grundfläche um 0.1 m² zu erweitern. Dies ist zweifellos für Goldnackenaras nicht adäquat. Die 2. Tierhaltungsverordnung Österreichs (Stand 2022) schreibt für die Haltung eines Paars oder ausnahmsweise eines Einzelvogels eine Voliere mit einer Grundfläche von 4 x 2 m Fläche und einer Höhe von 3 m sowie einen Schutzraum von 2 m² / 2 m Höhe mit einer Mindesttemperatur von 10°C vor. Je weiteres Paar sind die Flächen um 50% zu erweitern. Taxonomie und NomenklaturDer Goldnackenara wurde 1853 von dem amerikanischen Ornithologen John CASSIN unter dem heute noch vielfach gebräuchlichen Namen Ara auricollis erstmals wissenschaftlich beschrieben. In den 1990er-Jahren erfolgte eine Umteilung erst in die Gattung Propyrrhura und danach in die heute gültige, 1857 von Prinz Charles Lucien BONAPARTE, einem Neffen von Kaiser Napoléon Bonaparte, eingeführte Gattung Primolius. Die Art ist monotypisch, sie bildet eine Superspezies mit P. maracana und P. couloni [1; 5; 6; 10]. |
Literatur und Internetquellen
- BIRDLIFE INTERNATIONAL (2016). Primolius auricollis. The IUCN Red List of Threatened Species 2016: e.T22685628A93081914. https://www.iucnredlist.org/species/22685628/93081914 . Downloaded on 12 December 2021.
- PSITTACOLOGY
- CITES TRADE DATA BASE
- DE GRAHL, W. (1979/82)
- DEL HOYO, J., ELLIOTT, A. et al. (eds., 1992-2013)
- DEL HOYO, J., COLLAR, N., CHRISTIE, D.A., ELLIOTT, A. & FISHPOOL L.D.C. (2014)
- FORSHAW, J. M. & COOPER, W. T. (1981)
- GRUMMT, W. & STREHLOW, H. (2009)
- LANTERMANN, W. (1984)
- LEPPERHOFF, L. (2004)
Zurück zu Übersicht Papageienvögel
Weiter zu Weiter zu Rotrückenara (Primolius maracana)
Rotbugara
Ordnung: Papageienvögel (PSITTACIFORMES)
Familie: Echte Papageien (Psittacidae)
Unterfamilie: Eigentliche Papageien (Psittacinae)
Tribus: Neuweltpapageien (Arini)

Rotbugara
Ara severus • The Chestnut-fronted Macaw • L'ara vert ou ara sévère
- Körperbau und Körperfunktionen
- Verbreitung
- Lebensraum und Lebensweise
- Gefährdung und Schutz
- Bedeutung für den Menschen
- Haltung
- Taxonomie und Nomenklatur
- Literatur und Internetquellen
|
Weitere Bilder auf BioLib.czStimme auf XENO-CANTO |
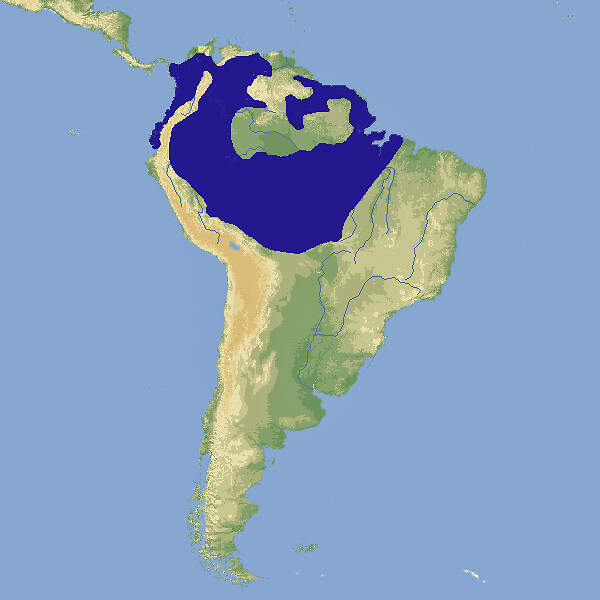
Der Rotbugnara ist der kleinste Vertreter der Gattung Ara im engeren Sinn. Er hat eine weite Verbreitung im tropischen Südamerika, sodass er trotz unbekannter Bestandsgröße und mutmaßlich negativem Bestandstrend als nicht gefährdet gilt. In unseren Zoos ist er nicht häufig zu sehen. Körperbau und KörperfunktionenMit einer Gesamtlänge von 46-48 cm, wovon 20-24 cm auf den Schwanz entfallen, einer Flügellänge von 22-25 cm und einem Gewicht von ca. 350-410 g ist der Rotbugara der kleinste Vertreter des Gattung Ara im engeren Sinn. Die Grundfärbung des Gefieders ist grün. Die Stirn ist dunkelbraun, die Kopfoberseite bläulich. Die Außenfahnen der Handschwingen und -decken sind blau. Auffälligstes Merkmal ist die Rotfärbung von Flügelbug, Flüglspiegel und kleinen Unterflügeldecken. Der Schnabel ist dunkelgrau, die Iris gelb. Die nackten Gesichtspartien sind weißlich, die Füße grau. Jungvögel sind matter gefärbt und haben eine schwarze Iris [4; 5; 7; 9; 10].] VerbreitungTropisches Südamerika: Bolivien, Brasilien, Ekuador, Französisch-Guyana, Guyana, Kolumbien, Panama, Peru, Surinam, Venezuela. Eingeführte Population in den USA [1]. Lebensraum und LebensweiseDer Rotbugara besiedelt Tiefland-Regenwald, Galeriewälder, Sekundärwälder, Sumpfgebiete, Buriti-Palmenhaine (Mauritia flexuosa) und die Chapparales und Llanos genannten Savannen im Norden Südamerikas vom Tiefland bis auf eine Höhe von 800, stellenweise bis 1'500 m. Außerhalb der Brutzeit lebt er in kleinen Gruppen, gelegentlich in größeren Ansammlungen. Er ernährt sich von Samen, Früchten, Blättern, Blüten und der Rinde von Seidenbäumen (Ceiba pentandra). Genistet wird in Höhlen in alten Laubbäumen oder in abgstorbenen Palmen. Die Gelege bestehen aus 3-4 (2-5) Eiern, die während 26-27 (25-28) Tagen bebrütet werden. Die Nestlingszeit dauert etwa 56-63 Tage, mit 4-5 Monaten sind die Jungen selbständig [1; 5; 8; 10]. Gefährdung und SchutzDer Rotbugara hat eine sehr weite, zehn Länder umfassende Verbreitunmg im tropischen Südamerika. Die Größe seines Bestand unbekannt. Es wird angenommen, dass der Populationstrend nach unten zeigt, die vermutete Abnahme gibt jedoch noch keinen Anlass zu Besorgnis. Die Art wird deshalb seit 2004, letztmals überprüft 2016, als nicht-gefährdet eingestuft (Rote Liste: LEAST CONCERN) [1]. Der internationale Handel ist nach CITES-Anhang II geregelt. Bedeutung für den MenschenDer Rotbugara wird zur Fleischgewinnung bejagt und in Surinam in geringem Ausmaß für den internationalen Vogelmarkt gefangen bzw. ausgehorstet [1]. Von 1981-2019 meldeten Ursprungsländer die Ausfuhr von 11'104 Wildfängen. 6'415 wurden bis 1984 von Bolivien ausgeführt, 4'644 von Surinam, dem einzigen Land, das bis in die Gegenwart die Ausfuhr kleiner Kontingente bewilligt. Von 1981-2020 wurden weltweit Exporte von 9'763 Nachzuchtvögeln erfasst, von denen 8'012 aus Südafrika stammten [3]. HaltungDie Welterstzucht gelang im 1940 im San Diego Zoo [8; 10]. Das Höchstalter in Menschenobhut wird mit 39.7 Jahren angegeben [2]. Haltung in europäischen Zoos: Die Art wird in gegen 30 Zoos gezeigt, von denen sich etwa ein Drittel im deutschsprachigen Raum befinden. Für Details siehe Zootierliste. Mindestanforderungen an Gehege: Nach Papageiengutachten des BMELF von 1995 ist für die Haltung eines Paars oder ausnahmsweise eines Einzelvogels eine Voliere mit einer Fläche von 4 x 2 m und einer Höhe von 2 m erforderlich, ferner ein Schutzraum mit einer Grundfläche von 2 m². Für jedes weitere Paar sind die Grundflächen um 50% zu erweitern. Nach Schweizerischer Tierschutzverordnung (Stand 1.2.2022) sind Rotbugaras mindestens paarweise zu halten. Für ein Paar ist ein Käfig mit Badegelegenheit, einer Grundfläche von 0.7 m² und einer Höhe von 120 cm vorgeschrieben, für jedes weitere Tier ist die Grundfläche um 0.1 m² zu erweitern. Dies ist zweifellos für Rotbugaras nicht adäquat. Die 2. Tierhaltungsverordnung Österreichs (Stand 2022) schreibt für die Haltung eines Paars oder ausnahmsweise eines Einzelvogels eine Voliere mit einer Grundfläche von 4 x 2 m Fläche und einer Höhe von 3 m sowie einen Schutzraum von 2 m² / 2 m Höhe mit einer Mindesttemperatur von 10°C vor. Je weiteres Paar sind die Flächen um 50% zu erweitern. Taxonomie und NomenklaturDer Rotbugara wurde 1758 von Carl von LINNÉ als "Psittacus severus" erstmals wissenschaftlich beschrieben. Die heute gültige Gattungsbezeichnung Ara wurde 1799 vom französischen Naturforscher Graf Bernard-Germain-Étienne de LACÉPÈDE eingeführt, womit die Art bis vor Kurzem Ara severa hieß. Nachdem in einer 2013 veröffentlichten Checkliste festgestellt wurde, dass das grammatikalische Geschlecht von Ara männlich sei, wurde der Artname auf severus geändert. In der Literatur und auf Zoo-Namensschildern finden sich beide Bezeichnungen. Es werden oft zwei Unterarten differenziert: Ara s. severus und dsie im Mittel etwas größere Ara s. castaneifrons, es dürfte sich aber um eine Kline handeln [5; 6]. |
Literatur und Internetquellen
- BIRDLIFE INTERNATIONAL (2018). Ara severus. The IUCN Red List of Threatened Species 2018: e.T22685577A130103061. https://www.iucnredlist.org/species/22685577/130103061 .Downloaded on 10 December 2021.
- PSITTACOLOGY
- CITES TRADE DATA BASE
- DE GRAHL, W. (1979/82)
- DEL HOYO, J., ELLIOTT, A. et al. (eds., 1992-2013)
- DEL HOYO, J., COLLAR, N., CHRISTIE, D.A., ELLIOTT, A. & FISHPOOL L.D.C. (2014)
- FORSHAW, J. M. & COOPER, W. T. (1981)
- GRUMMT, W. & STREHLOW, H. (2009)
- LANTERMANN, W. (1984)
- LEPPERHOFF, L. (2004)
Zurück zu Übersicht Papageienvögel
Weiter zu Zwergara (Ara = Diopsittaca nobilis)
UL HASAN, M. A. & NEHA, S. A. (2019)
The Himalayan Crestless Porcupine Hystrix brachyura Linnaeus, 1758 (Mammalia: Rodentia: Hystricidae): first authentic record from Bangladesh.
Journal of Threatened Taxa 11(12):14624-14626. DOI:10.11609/jott.4861.11.12.14624-14626.
Auszug:
During our social survey in Sundarbans mangrove forest, Bangladesh, the Hystrix brachyura was sighted in the Supoti Forest Camp (22.0470N & 89.8270E), Sundarbans East Zone, Bangladesh. On 22 May 2018, opportunistically an individual of porcupine was directly spotted but it was soon fled away into the shrubs and unidentified at that moment. The observation area was dominated by Acanthus ilicifolius and Phragmites karka. To substantiate the confirmation, a subsequent attempt was taken on 24 May 2018. Though several studies have revealed that various kinds of bait lured to particular species in general, or attract more of a prescribed species has been of specific focus; considering the facts, pieces of apples and potatoes were used to attract porcupine in a suitable place where a clear observation could be made. One more time, an individual attracted to bait was seen under the shrub of Phragmites karka at 19.35h. Finally, a clear visual observation as well as several photographs were taken. We recorded the geographic coordination using Garmin GPSMAP 64S.
ul hasan-biblio
Kurzschwanz-Stachelschwein
Überordnung: EUARCHONTOGLIRES
Taxon ohne Rang: Nagetiere und Hasen (GLIRES)
Ordnung: Nagetiere (RODENTIA)
Unterordnung: Stachelschweinverwandte (Hystricomorpha)
Familie: Stachelschweine (Hystricidae)

Kurzschwanz- oder Malaiisches Stachelschwein
Hystrix brachyura • The Malayan Porcupine • Le porc-épic de Malaisie
- Körperbau und Körperfunktionen
- Verbreitung
- Lebensraum und Lebensweise
- Gefährdung und Schutz
- Bedeutung für den Menschen
- Haltung
- Taxonomie und Nomenklatur
- Literatur und Internetquellen
|
Weitere Bilder auf BioLib.cz |
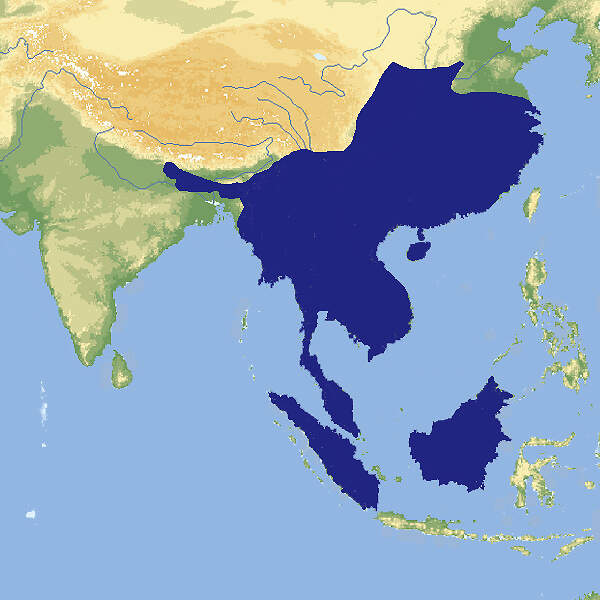
Die Vertreter der Gattung Hystrix sind wegen der Umwandlung des Haarkleids in ein Stachelkleid und wegen ihres Verhaltens von besonderem zoopädagogischem Interesse und gehören zu den Standardtieren in Zoologischen Gärten. Dies trifft allerdings für das nichtgefährdete, aus Südostasien stammende Kurzschwanz-Stachelschwein nicht zu. Dieses ist seit mehreren Jahrzenten aus europäischen Zoos verschwunden. Körperbau und KörperfunktionenKurzschwanz-Stachelschweine erreichen eine Kopf-Rumpflänge von 56-74 (45-93) cm, eine Schwanzlänge von 8-12 (6-17) cm und ein Gewicht von 10-18 (8-27) kg. Im Gegensatz zu dem auf dem Indischen Subkontinent ebenfalls vorkommenden Weißschwanzstachelschwein ist die Nackenmähne nur schwach ausgebildet, und die langen Rückenstacheln haben nur ein dunkles Querband und nicht mindestens drei [4]. VerbreitungSüdostasien: Bangladesch, Bhutan, Brunei (?), China, Hongkong, Indien, Indonesien, Laos, Malaysia, Myanmar, Nepal, Thailand, Vietnam [2]. Lebensraum und LebensweiseDas Kurzschwanz-Stachelschwein lebt in unterschiedlichen Waldtypen, mit Gestrüpp bedecktem, felsigem Gelände und auf Agrarland vom Meeresspiegel bis auf eine Höhe von 1'500 m. Die Tiere sind nachtaktiv und verschlafen den Tag einzeln oder familienweise in selbstgegrabenen Erdbauen. Sie fressen pflanzliches Material aller Art und benagen zur Deckung ihres Kalziumbedarfs Knochen und Abwurfstangen von Hirschen. Bei Gefahr rasseln sie mit dem Schwanz, und auch sonst entspricht das Feindvermeidungsverhalten dem der anderen Arten der Gattung. Nach einer Tragzeit von ca. 110 Tagen werden ein- bis zweimal im Jahr 2 oder gelegentlich 3 weitentwickelte Jungtiere geboren, deren Körper mit noch weichen Stacheln bedeckt ist [2; 4; 7]. Gefährdung und SchutzDie Art ist weitverbreitet, kommt in zahlreichen Schutzgebieten vor und gilt daher seit 2008, letztmals überprüft 2016, trotz angenommenem negativem Bestandstrend als nicht-gefährdet (Rote Liste: LEAST CONCERN). Es ist zu beachten, dass der Status der Art wegen ihrer heimlichen, nächtlichen Lebensweise schwer zu beurteilen ist. So wurde das Vorkommen in Bangladesch erst 2018 bestätigt, und in Singapur, wo die Art von 1970-2000 als möglicherweise ausgestorben galt, gibt es zahlreiche Nachweise, seit Fotofallen zur Überwachung der Wildbestände eingesetzt werden [1; 2; 5]. Der internationale Handel wird durch CITES nicht geregelt. Bedeutung für den MenschenDas Kurzschwanz-Stachelschwein wird zur Gewinnung von Fleisch und von Körperteilen für die Zwecke der traditionellen chinesischen Medizin bejagt und als Schädling an landwirtschftlichen Kulturen verfolgt [2]. Kulturelle Bedeutung: Der deutsche Dichter Christian MORGENSTERN (1871-1914) hat dem Kurzschwanz-Stachelschwein in seinen erstmals 1905 von Bruno CASSIRER verlegten "Galgenliedern" (1952) ein skurriles literarisches Denkmal gesetzt: DIE HYSTRIX
HaltungWEIGL gibt als längste Haltungsdauer 27 Jahre und 3 Monate an, erreicht von einem aus Sumatra importierten Wildfangs des Washingtoner Zoos [5]. Haltung in europäischen Zoos: In den 1960-80er Jahren wurde die Art in etwa einem halben Dutzend Zoos gehalten, darunter Berlin, Dresden, Halle Rostock und Schwerin [3]. Seitdem gibt es keine mehr. Die britische und vermutlich europäische Erstzucht glückte 1914 im Londoner Zoo. Für Details siehe Zootierliste. Nach Säugetiergutachten 2014 können Stachelschweine der Gattung Hystrix ganzjährig in Außengehegen gehalten werden, wenn sie im Winter Zugang zu einem frostfreien Schutzraum haben. Für 2 Stachelschweine soll eine Mindestfläche von 20 m² angeboten werden, für jedes weitere Tier 5 m² mehr. Die Schweizerische Tierschutzverordnung (Stand 01.06.2022) schreibt für 2 Stachelschweine ein Außengehege mit einer Mindestfläche von 40 m², Grabgelegenheit und Schlafboxen, eventuell heizbarem Innenraum vor. Nach der 2. Tierhaltungsverordnung Österreichs (Stand 2021) ist für ein Paar oder eine Familiengruppe Stachelschweine ein Außengehege mit einer Mindestfläche von 40 m² mit einer Sand- oder Erdschicht als Bodengrund und Unterstand erforderlich. Taxonomie und NomenklaturDas Kurzschwanz-Stachelschwein wurde 1758 von Carl von LINNÉ unter seinem heute noch gültigen Namen erstmals wissenschaftlich beschrieben. Der französische Naturforscher und Direktor der Ménagerie von Paris, Georges-Frédéric CUVIER, stellte es 1823 in die Gattung Acanthion, die heute als Untergattung betrachtet wird. Bis vor einiger Zeit wurden fünf Unterarten akzeptiert, gegenwärtig sind es noch deren drei [3; 7; 8]:
|
Literatur und Internetquellen
- CHUNG, Y. F., LIM, N. T.-L., SHUNARI, M. & WANG, D. (2016)
- LUNDE, D., APLIN, K. & MOLUR, S. (2016). Hystrix brachyura (errata version published in 2017). The IUCN Red List of Threatened Species 2016: e.T10749A115099298. https://dx.doi.org/10.2305/IUCN.UK.2016-3.RLTS.T10749A22232129.en. Downloaded on 23 November 2021.
- RUDLOFF, K. (2011)
- SMITH, A. T. & XIE, Y. (Hrsg., 2008)
- UL HASAN, M. A. & NEHA, S. A. (2019)
- WEIGL, R. (2005)
- WILSON, D. E. et al. eds. (2009-2019)
- WILSON, D. E. & REEDER, D. M. (2005)
Zurück zu Übersicht Hasen und Nagetiere
Weiter zu Weißschwanzstachelschwein (Hystrix indica)
Asiatischer Quastenstachler
Überordnung: EUARCHONTOGLIRES
Taxon ohne Rang: Nagetiere und Hasen (GLIRES)
Ordnung: Nagetiere (RODENTIA)
Unterordnung: Stachelschweinverwandte (Hystricomorpha)
Familie: Stachelschweine (Hystricidae)

Asiatischer Quastenstachler
Atherurus macrourus • The Asiatic Brush-tailed Porcupine • L'athérure malais
- Körperbau und Körperfunktionen
- Verbreitung
- Lebensraum und Lebensweise
- Gefährdung und Schutz
- Bedeutung für den Menschen
- Haltung
- Taxonomie und Nomenklatur
- Literatur und Internetquellen
|
Weitere Bilder auf BioLib.cz |
Der nicht-gefährdete Asiatische Quastenstachler ist ein kleines, langschwänziges Altwelt-Stachelschwein aus Südostasien, dessen Aussehen weniger spektakulär ist als jenes der Hystrix-Stachelschweine. In europäischen Zoos wurde er letztmals in den 1990er-Jahren gezeigt. Körperbau und KörperfunktionenMit einer Kopf-Rumpflänge von 38-52 (34-58) cm und einem Gewicht von 2-4 (1.5-4.3) kg ist der Asiatische Quastenstachler deutlich kleiner als die Stachelschweine der Gattung Hystrix. Sein Schwanz ist jedoch mit 16-20 (14-23) cm gleich lang oder länger als bei seinen großen Verwandten. Die Tiere sind relativ schlank und kurzbeinig. Hals, Schultern und Unterseite sind von teils schwarz- oder hellbraunen, teils weißlichen, weichen und abgeflachten Stacheln bedeckt. Die hintere Rückenpartie und die Flanken weisen bis 10 cm lange, grobe und längsgefurchte, harte Stacheln gemischt mit langen weißen Borsten auf. Der schuppige Schwanz endet in einer Quaste aus weißlichen, etwa 20 cm langen Stacheln. Die Weibchen haben im Brustbereich 2-3 Paare seitlich angelegter Zitzen [1; 4; 6]. VerbreitungSüdostasien: Bangladesch, China (Yunnan, Hainan, Hubei, Sichuan), Indien (Assam), Laos, Malaysia, Myanmar, Thailand, Vietnam [2]. Lebensraum und LebensweiseDer Quastenstachler ist eine nachtaktive, bodenlebende Art tropischer und subtropischer Bergwälder, vorzugsweise mit dichtem Unterwuchs und eingestreuten Zuckerrohr- und Bambusbeständen sowie Palmen. Als Unterkunft graben die Tiere Erdbaue, in denen sich bis zu 8 Individuen aufhalten können. Die Nahrung besteht aus Wurzeln, Knollen, Früchten, Baumrinde, Sämereien und anderem Pflanzenmaterial. Daneben werden auch Aas und Insekten genommen und Knochen angenagt. Die Weibchen gebären nach einer Tragzeit von 100-110 Tagen bis zweimal pro Jahr ein schon weit entwickeltes Junges, selten zwei. Dies verlässt das Nest, sobald die Stacheln ausgehärtet sind, was nach etwa einer Woche der Fall ist, und wird mit etwa 2 Monaten entwöhnt [1; 2; 4; 6]. Gefährdung und SchutzDie Art nimmt zwar in ihrem Bestand etwas ab, ist aber weitverbreitet und kommt in zahlreichen Schutzgebieten vor. Sie gilt daher seit 1996, letztmals überprüft 2016 als nicht-gefährdet (Rote Liste: LEAST CONCERN) [2]. Der internationale Handel wird durch CITES nicht geregelt. Bedeutung für den MenschenDer Asiatische Quastenstachler wird zur Fleischgewinnung bejagt [2]. HaltungWEIGL gibt als Höchstalter 13 Jahre und 7 Monate an, erreicht von einem vor dem 2. Weltkrieg im Londoner Zoo gehaltenen Tier. Tatsächlich dürfte das mögliche Höchstalter wie bei Atherurus africanus bei über 20 Jahren liegen [5]. Haltung in europäischen Zoos: Die Art war weltweit in Zoos stets selten, zu den wenigen Haltungen gehörte in den 1960er Jahren der Bergzoo Halle [3]. In Europa wurde sie letztmals bis 1995 im Tiergarten Schönbrunn gezeigt. Im Gegensatz dazu halten einige Zoos den Afrikanischen Quastenstachler. Die britische und vermutlich auch europäische Erstzucht glückte 1924 im Londoner Zoo. Für Details siehe Zootierliste. Nach Säugetiergutachten 2014 soll für 2 Tiere eine Mindestfläche von 10 m² angeboten werden, für jedes weitere Tier 2 m² mehr. Das Gutachten von 1996 sah für maximal 2 Tiere eine Mindestfläche von 5 m² vor. Die Erhöhung war zwar nicht wissenschaft abgestützt, war aber aus Sicht der Zoovertreter in Ordnung. Die Schweizerische Tierschutzverordnung (Stand 01.06.2022) schreibt für maximal 2 Tiere ein Innengehege mit einer Mindestfläche von 5 m² vor, wobei bei Neubauten allfällige neue Erkenntnisse berücksichtigt werden sollten. Nach der 2. Tierhaltungsverordnung Österreichs (Stand 2023) ist für ein Paar ein Gehege mit einer Mindestfläche von 15 m² erforderlich. Während der kalten Jahreszeit müssen die Tiere bei einer Mindesttemperatur von 18ºC gehalten werden. Taxonomie und NomenklaturDas Asiatische Quastenstachler wurde 1758 von Carl von LINNÉ als "Hystrix macroura" erstmals wissenschaftlich beschrieben. Der Gattungsname Atherurus wurde 1829 von dem französischen Naturforscher und Direktor der Ménagerie von Paris, Georges-Frédéric CUVIER, eingeführt. Die Art gilt als monotypisch, manche Autoren anerkennen allerdings zwei Unterarten [6]. |
Literatur und Internetquellen
- ANIMAL DIVERSITY WEB
- MOLUR, S. (2020). Atherurus macrourus (amended version of 2016 assessment). The IUCN Red List of Threatened Species 2020: e.T2354A166518819. https://dx.doi.org/10.2305/IUCN.UK.2020-1.RLTS.T2354A166518819.en. Downloaded on 22 November 2021.
- RUDLOFF, K. (2011)
- SMITH, A. T. & XIE, Y. (Hrsg., 2008)
- WEIGL, R. (2005)
- WILSON, D. E. et al. eds. (2009-2019)
Zurück zu Übersicht Hasen und Nagetiere
Weiter zu Südafrikanisches Stachelschwein (Hystrix africaeaustralis)