RAUHUT, O. W. M. & LÓPEZ-ARBARELLO, A. (2016)
Zur Taxonomie der Brückenechse aus dem oberen Jura von Schamhaupten.
Archaeopteryx 33: 1-11; Eichstätt 2016
Zusammenfassung:
Die Brückenechsen (Rhynchocephalia) sind eine alte Entwicklungslinie der Lepidosaurier (Schuppenechsen), die heute nur noch mit einer einzigen Gattung vertreten ist, im Mesozoikum jedoch taxonomisch und ökologisch divers war. Einer der wichtigsten Fundkomplexe für Rhynchocephalen im Mesozoikum sind die oberjurassischen Plattenkalke Süddeutschlands, insbesondere deswegen, da hier üblicherweise vollständige Skelette und nicht nur isolierte Kiefer vorliegen. Leider ist allerdings die Taxonomie der Brückenechsen aus diesen Schichten noch nicht zufriedenstellend geklärt, was Studien zur Evolution der Gruppe behindert. Aus den Plattenkalken des oberen Kimmeridgium von Schamhaupten ist ein vollständiges Exemplar einer Brückenechse bekannt, die bisher zu Leptosaurus pulchellus gestellt wurde, wobei eine Synonymie der Gattung Kallimodon, dessen Typusart Kallimodon pulchellus ist, mit der Gattung Leptosaurus (Typusart Leptosaurus neptunius) angenommen wurde. Detaillierte Vergleiche des Rhynchocephalen aus Schamhaupten mit dem Typusexemplar von Kallimodon pulchellus sowie publizierten Beschreibungen von Leptosaurus neptunius zeigen jedoch wichtige Unterschiede zwischen diesen Tieren. Unterschiede zu K. pulchellus finden sich unter anderem in der Bezahnung des Oberkiefers, der Phalangenformel der Hände und der Form der zweiten Sakralrippe. Ein wichtiger Unterschied zu L. neptunius ist die Zahl der Prämaxillarzähne, die bei dem Exemplar aus Schamhaupten, trotz fast doppelter Körpergröße, höher ist, obwohl bei Brückenechsen die Zahl Prämaxillarzähne im Wachstum eher reduziert wird. Diese Unterschiede deuten darauf hin, dass die Brückenechse aus Schamhaupten weder zu Kallimodon pulchellus noch zu Leptosaurus neptunius gestellt werden kann und implizieren somit, dass die Diversität dieser Gruppe in den Plattenkalken höher war, als derzeit angenommen. Um das Exemplar als neue Art beschreiben zu können, ist jedoch eine detaillierte Revision der Brückenechsen der süddeutschen Plattenkalke notwendig.
Bezugsquelle (Volltext):
https://www.researchgate.net/publication/301517359_Zur_Taxonomie_der_Bruckenechse_aus_dem_oberen_Jura_von_Schamhaupten_On_the_taxonomy_of_the_rhynchocephalian_from_the_Late_Jurassic_of_Schamhaupten [accessed Jun 11, 2017].
KUCHLING, G. (2010)
Taxonomy and nomenclature of the longneck turtle (genus Chelodina) from south-western Australia.
Records of the Western Australian Museum 25: 449–454
DOI 10.18195/issn.0312-3162.25(4).2010.449-454
Abstract:
Gray (1856) recognised Chelodina colliei from south-western Australia as a different species from Chelodina oblonga Gray, 1841 from ‘Western Australia’. In addition, Gray (1873) specifically mentioned specimens of C. oblonga from the Port Essington region of today’s Northern Territory. Boulenger (1889) synonymized C. colliei with C. oblonga, a view followed by later reviewers for over seven decades. Goode (1967) and Burbidge (1967) both reinstated Gray’s original concept that the longneck turtle of south-western Australia represents a distinct species, but erroneously applied and restricted the name C. oblonga to the south-western Australian species. Thomson (2000) detected this nomenclatural error and subsequently applied to the International Commission on Zoological Nomenclature (ICZN case 3351, Thomson 2006) to give precedence to rugosa over oblonga whenever the two were considered to be conspecific and to place on the official lists the names colliei, oblonga and rugosa, thus leaving colliei as the only available name for the south-western Australian Chelodina. Since then, the name Chelodina colliei was again used by several authors for the south-western Australian taxon, including in books and checklists (Bonin et al. 2006; Fritz and Havaš 2007; Iverson 2007). With case 3351 still under consideration by the ICZN, McCord and Joseph-Ouni (2007) further aggravated the nomenclatural confusion regarding the south-western Australian longneck turtle by fixing a ‘neotype’ for C. oblonga and by describing the genus Macrodiremys for C. oblonga (= colliei), both actions in violation of Articles 75.6 and 82.1 of the 1999 ICZN Code.
ATTUM, O., BAHA EL DIN, S., CARRANZA, S., EARLEY, R., ARNOLD, E. N. & KINGSBURY, B. A. (2007)
An Evaluation of the Taxonomic Validity of Testudo werneri.
Amphibia-Reptilia 28(3): 393-401. ISSN 01735373. http://dx.doi.org/10.1163/156853807781374728
Abstract:
The Egyptian tortoise Testudo kleinmanni was recently split into two species on the basis of apparent differences in shell morphology and markings. Testudo kleinmanni was restricted to areas west of the Nile river and a new form, T. werneri, was described which occurred east of the Nile river (Perälä, 2001). However, when the morphometric analysis on which this decision was based (Perälä, 2001) was adjusted to allow for experiment-wise Type I error, by using P-value corrections, the proportion of the 46 characters that differed significantly between the two populations fell from 36.9% to only 13% in males and from 39.1% to just 8.7% in females. We then conducted a new morphometric analysis using our own data set that showed minor significant variation in morphometric and plastron markings between populations. An analysis of mitochondrial DNA based on 393 base pairs of the 12S rRNA gene, also showed near uniformity of western and eastern populations. Genetic divergence was only 0.2%, with the only consistent difference being a single G – A substitution at position 205. Based on the revised interpretation of Perälä (2001) results, our morphometric analysis on our own data set, and the molecular evidence, the variation observed between populations is normal within a species and therefore T. werneri is not a distinct independent evolutionary lineage and should not be considered a separate species from T. kleinmanni.
CACCONE, A., GIBBS, J.P., KETMAIER, V-, SUATONI, E. & POWELL, J.R. (1999)
Origin and evolutionary relationships of giant Galápagos tortoises (1999).
Proc Natl Acad Sci U S A. 1999 Nov 9; 96(23): 13223–13228.
Zusammenfassung:
Perhaps the most enduring debate in reptile systematics has involved the giant Galápagos tortoises (Geochelone nigra), whose origins and systematic relationships captivated Charles Darwin and remain unresolved to this day. Here we report a phylogenetic reconstruction based on mitochondrial DNA sequences from Galápagos tortoises and Geochelone from mainland South America and Africa. The closest living relative to the Galápagos tortoise is not among the larger-bodied tortoises of South America but is the relatively small-bodied Geochelone chilensis, or Chaco tortoise. The split between G. chilensis and the Galápagos lineage probably occurred 6 to 12 million years ago, before the origin of the oldest extant Galápagos island. Our data suggest that the four named southern subspecies on the largest island, Isabela, are not distinct genetic units, whereas a genetically distinct northernmost Isabela subspecies is probably the result of a separate colonization. Most unexpectedly, the lone survivor of the abingdoni subspecies from Pinta Island (“Lonesome George”) is very closely related to tortoises from San Cristóbal and Española, the islands farthest from the island of Pinta. To rule out a possible recent transplant of Lonesome George, we sequenced DNA from three tortoises collected on Pinta in 1906. They have sequences identical to Lonesome George, consistent with his being the last survivor of his subspecies. This finding may provide guidance in finding a mate for Lonesome George, who so far has failed to reproduce.
TURTLE TAXONOMY WORKING GROUP (2014-2021)
DIJK, P.P., van, IVERSEN, J.B., RHODIN, A.G.J., SHAFFER, H.B. & BOUR, R.
Turtles of the world, 7th edition: annotated checklist of taxonomy, synonymy, distribution with maps, and conservation status.
In: Rhodin, A.G.J., Pritchard, P.C.H., van Dijk, P.P., Saumure, R.A., Buhlmann, K.A., Iverson, J.B., and Mittermeier, R.A. (Eds.). Conservation Biol-
ogy of Freshwater Turtles and Tortoises: A Compilation Project of the IUCN/SSC Tortoise and Freshwater Turtle Specialist Group. Chelonian Research Monographs 5(7):000.329–479, doi:10.3854/crm.5.000.checklist.v7.2014
Download 7. Auflage (2014): http://www.iucn-tftsg.org/wp-content/uploads/file/Accounts/crm_5_000_checklist_v7_2014.pdf
Download 9. Auflage (2021): https://iucn-tftsg.org/wp-content/uploads/crm.8.checklist.atlas_.v9.2021.e3.pdf
Buschbock
Überordnung: LAURASIATHERIA
Taxon ohne Rang: CETARTIODACTYLA
Ordnung: Paarzeher (ARTIODACTYLA)
Unterordnung: Wiederkäuer (Ruminantia)
Familie: Hornträger (Bovidae)
Unterfamilie: Echte Rinder (Bovinae)
Tribus: Afrikanische Waldböcke (Tragelaphini)

Buschbock oder Schirrantilope
Tragelaphus scriptus • The Bushbuck • Le guib harnaché
- Körperbau und Körperfunktionen
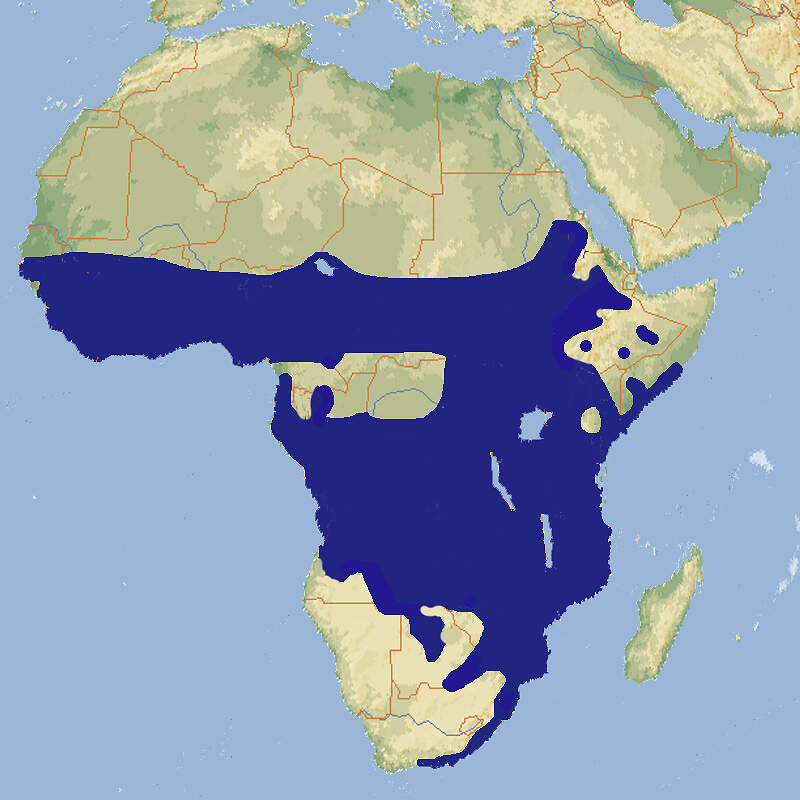
- Verbreitung
- Lebensraum und Lebensweise
- Gefährdung und Schutz
- Bedeutung für den Menschen
- Haltung
- Taxonomie und Nomenklatur
- Literatur und Internetquellen
|
Weitere Bilder auf BioLib.cz |
Der Buschbock ist eine kleinere, äußerst attraktive Antilope mit deutlichem Sexualdimorphismus, die sowohl für das allgemeine Publikum als auch für die Zoopädagogik interessant wäre, die aber als weit verbreitete, nicht gefährdete Art vom Europäischen Zoo- und Aquarienverband als nicht prioritör eingestuft wurde und daher in den Zoos mittlerweile ausgestorben ist. Körperbau und KörperfunktionenDer Buschbock ist der kleinste der afrikanischen Waldböcke. Er zeigt einen stark ausgeprägten Sexualdimorphismus. Die Böcke erreichen eine Kopf-Rumpflänge von 114-150 cm, eine Schulterhöhe von 80 (65-100) cm und ein Gewicht von 40-80 kg. Die Ricken werden bis 132 cm lang, 70 (61-85) cm hoch und 24-60 kg schwer. Der Schwanz wird etwa 19-24 cm lang. Wie bei den anderen afrikanischen Waldböcken haben die Böcke schraubenartig gedrehte Hörner, die 40-55 cm lang werden können. Das Fell zeigt bei beiden Geschlechtern ein auffallendes Muster weißer Punkte und Streifen, wobei es erhebliche regionale Unterschiede gibt. An der Halsunterseite verlaufen 1-2 weiße Querbänder, die Schwanzunterseite ist weiß, die Schwanzspitze kann schwarz sein. Die Beine können je nach Unterart einfarbig sein oder eine weiß oder schwarzweiße Zeichnung aufweisen. Die Grundfarbe ist regional variabel, bei den Ricken meist rotbraun, bei den Böcken etwas dunkler, kastanienbraun oder schwarzgrau [2; 5; 8]. VerbreitungAfrika südlich der Sahara: Angola, Äquatorialguinea, Äthiopien, Benin, Botswana, Burkina Faso, Burundi, Elfenbeinküste, Gabun, Gambia, Ghana, Guinea, Guinea-Bissau, Kamerun, Kenia, Kongo, Kongo Dem., Liberia, Malawi, Mali, Mauretanien, Mosambik, Namibia, Niger, Nigeria, Ruanda, Sambia, Senegal, Sierra Leone, Simbabwe, Somalia, Südafrika, Südsudan, Sudan, Swasiland, Tansania, Togo, Tschad, Uganda, Zentralafrikanische Republik [4]. Lebensraum und LebensweiseBuschböcke benötigen Lebensraum mit viel Deckung. Sie kommen in Tropischen Regen- und Feuchtwäldern, Subtropischen Feuchtwäldern, und Gemäßigten immergrünen Feuchtwäldern, jeweils vorzugsweise an Waldrändern, Galeriewäldern, Trockenwäldern, Dornsavannen, Dickichten und Zuckerrohrpflanzungen vor. Die Nahrung dieser Selektiväser besteht überwiegend aus Blättern und Zweigen, aber auch zarte Gräser werden genommen. Buschböcke leben solitär, sind aber nicht territorial, sondern haben überlappende Streifgebiete [5; 8]. Es gibt keine definierte Fortpflanzungsperiode, allenfalls saisonale Spitzen der Brunftaktivitäten und der Geburten. Nach einer Tragzeit von rund 180 Tagen wird in der Regel ein einzelnes Kitz mit einem Gewicht von 3.1-4.5 kg geboren. Angaben über das Erreichen der Geschlechtsreife sind widersprüchlich. Bei Ricken dürfte dies mit etwa 1 Jahr der Fall sein, bei Böcken mit 1.5 Jahren, wobei sie effektiv meist erst mit 3 Jahren zur Forspflanzung kommen [5; 6; 8]. Gefährdung und SchutzDer Buschbock hat eine sehr weite Verbreitung und einen geschätzten Bestand von 1 bis 1.5 Millionen Adulttieren, der als stabil angesehen wird, außer in vom Menschen dicht besiedelten Regionen. Möglicherweise ist diese Schätzung wegen der heimlichen Lebensweise des Buschbocks zu tief. Er gilt daher seit 1996 als nicht gefährdet (Rote Liste: LEAST CONCERN) , was im Rahmen einer Beurteilung aus dem Jahr 2016 bestätigt wurde. Der Klimawandel macht der Art in den trockeneren Teilen ihres Areals zu schaffen, andererseits kann sie ihre Verbreitung im Gebiet der Regenwälder ausdehnen [4]. Der internationale Handel ist nicht unter CITES geregelt. Die Einfuhr lebender Exemplare aus den Ursprungsländern ist wegen der restriktiven Veterinärbestimmungen der EU so gut wie ausgeschlossen. Bedeutung für den MenschenDer Buschbock wird zur Gewinnung von Fleisch und als Sport gejagt. In Ruanda ist sein Fleisch deutlich billiger als jenes von Nutztieren und dementsprechend ist der Buschbock die häufigste Wildtierart, die auf Fleischmärkten angeboten wird. Im Rahmen der Sportjagd werden in Südafrika "Trophy Fees" von etwa 1'200-1'500 USD fällig, in anderen afrikanischen Ländern 400-1'100 USD. HaltungIn den 1950er Jahren wurde im Zoo Basel ein Buschbock kurze Zeit gemeinsam mit Sitatungas und Vierhornantilopen gehalten, um 1990 in Hannover gemeinsam mit Kirk-Dikdiks. Eine Gemeinschaftshaltung mit Sitatungas sollte sollte wegen der Gefahr der Bastardierung tunlichts vernieden werden Als Höchstalter gibt WEIGL über 15 Jahre und 3 Monate für ein im Ruhr-Zoo Gelsenkirchen geborenes und später in Hannover gehaltenes gehaltenes weibliches Tier an [7]. Haltung in europäischen Zoos: Die Art ist dem Collection Planning der EAZA zum Opfer gefallen und wird heute nicht mehr gehalten. Die britische (europäische?) Erstzucht gelang 1841 in der Menagerie des Earl of Derby in Knowsley (heute Safaripark). Der letzte Hinweis auf eine Nachzucht in Europa im International Zoo Yearbook bezieht sich auf das Jahr 1991 (Zoo Hannover). Bei den in Europa gehaltenen Tiere handelte es sich hauptsächlich um Senegal-Buschböcke, die z.B. in Hannover 31 Jahre lang gehalten und regelmäßig gezüchtet wurden, seltener um Kap-Buschböcke. Andere Unterarten waren Ausnahmeerscheinungen. Für Details siehe Zootierliste. Mindestanforderungen an Gehege: Nach Säugetiergutachten 2014 des BMEL soll für bis zu 5 Tieren ein Gehege von mindestens 200 m² zur Verfügung stehen. Für jedes weitere Tier kommen 20 m² zur Basisfläche dazu. Zudem wird ein Stall von etwa 3 m²/Tier vorgegeben. Die Schweizerische Tierschutzverordnung (Stand 01.06.2022) schreibt für theoretisch bis zu 10 Tieren ein Gehege mit Trenn- oder Absperrmöglichkeit vor, dessen Grundfläche 500 m² misst. Für jedes weitere Tier kommen 40 m² zur Basisfläche dazu. Ferner ist ein Stall mit einer Fläche von 4 m²/Tier erforderlich. Nach der 2. Tierhaltungsverordnung Österreichs (Stand 2023) ist für 1-5 Tiere ein Außengehege von 500 m² erforderlich, für jedes weitere 50 m² mehr. Zudem ist ein beheizter Stall mit einem Mindestausmaß von 4 m² pro Tier mit einer Mindesttemperatur von 10°C vorgeschrieben. Die Haltung hat in Gruppen mit einem erwachsenen Männchen, mehreren Weibchen und deren Nachwuchs zu erfolgen. Taxonomie und NomenklaturDer Buschbock wurde 1766 vom Berliner Naturforscher Peter Simon PALLAS, den Katharina die Große als Professor nach Petersburg berufen hatte, als "Antilope scripta" anhand eines Exemplars aus dem Senegal erstmals wissenschaftlich beschrieben. 1816 stellte ihn der französische Zoologe Henri Marie Ducrotay de BLAINVILLE als Typusart in die neue Gattung Tragelaphus. Traditionell wurde die Art in über 20 (bis etwa 40) Unterarten aufgeteilt. 2005 waren es noch 9. GROVES & GRUBB splitteten in ihrer umstrittenen Huftier-Taxonomie den Buschbock in 8 Arten auf, was Eingang in das Handbuch der Säugetiere fand, aber von der IUCN im Rahmen der Roten Liste nicht mitgemacht wurde [1; 3; 4, 8; 9].
|
Literatur und Internetquellen
- GROVES, C.P. & GRUBB, P. (2011)
- GRZIMEK, B. (ed., 1970)
- HALTENORTH, T. & TRENSE, W. (1956)
- IUCN SSC Antelope Specialist Group 2016. Tragelaphus scriptus (errata version published in 2017). The IUCN Red List of Threatened Species 2016: e.T22051A115165242. http://dx.doi.org/10.2305/IUCN.UK.2016-3.RLTS.T22051A50196111.en. Downloaded on 24 March 2019.
- MILLS, G & HES, L. (1999)
- PUSCHMANN, W., ZSCHEILE, D., & ZSCHEILE, K. (2009)
- WEIGL, R. (2005)
- WILSON, D. E. et al. eds. (2009-2019)
- WILSON, D. E. & REEDER, D. M. (2005)

Weiblicher Buschbock Tragelaphus scriptus sylvaticus) in seinem natürlichen Lebensraum im Pilanesberg-Nationalpark © Peter Dollinger, Zoo Office Bern
Zurück zu Übersicht Paarzeher
Weiter zu Sitatunga (Tragelaphus spekii)
KOEPFLI, K. P., POLLINGER, J. et al. (2015)
und 22 (!) weitere Ko-Autoren.
Genome-wide Evidence Reveals that African and Eurasian Golden Jackals Are Distinct Species.
Current Biology 25 (16): 2158–2165. 17 August 2015. Published Online: July 30, 2015.
DOI: http://dx.doi.org/10.1016/j.cub.2015.06.060
Summary:
The golden jackal of Africa (Canis aureus) has long been considered a conspecific of jackals distributed throughout Eurasia, with the nearest source populations in the Middle East. However, two recent reports found that mitochondrial haplotypes of some African golden jackals aligned more closely to gray wolves (Canis lupus) [ 1, 2 ], which is surprising given the absence of gray wolves in Africa and the phenotypic divergence between the two species. Moreover, these results imply the existence of a previously unrecognized phylogenetically distinct species despite a long history of taxonomic work on African canids. To test the distinct-species hypothesis and understand the evolutionary history that would account for this puzzling result, we analyzed extensive genomic data including mitochondrial genome sequences, sequences from 20 autosomal loci (17 introns and 3 exon segments), microsatellite loci, X- and Y-linked zinc-finger protein gene (ZFX and ZFY) sequences, and whole-genome nuclear sequences in African and Eurasian golden jackals and gray wolves. Our results provide consistent and robust evidence that populations of golden jackals from Africa and Eurasia represent distinct monophyletic lineages separated for more than one million years, sufficient to merit formal recognition as different species: C. anthus (African golden wolf) and C. aureus (Eurasian golden jackal). Using morphologic data, we demonstrate a striking morphologic similarity between East African and Eurasian golden jackals, suggesting parallelism, which may have misled taxonomists and likely reflects uniquely intense interspecific competition in the East African carnivore guild. Our study shows how ecology can confound taxonomy if interspecific competition constrains size diversification.
WRIGHT, T. F., SCHIRTZINGER, E. E. et al. (2008)
WRIGHT, T. F., SCHIRTZINGER, E. E., MATSUMOTO, T., EBERHARD, J. R., GRAVES, G. R., SANCHEZ, J. J., CAPELLI, S., MÜLLER, H., SCHARPEGGE, J. & CHAMBERS, G. K. (2008)
A Multilocus Molecular Phylogeny of the Parrots (Psittaciformes): Support for a Gondwanan Origin during the Cretaceous.
Mol. Biol. Evol. 25 (10): 2141-2156. (Published: 24 July 2008)
DOI: https://doi.org/10.1093/molbev/msn160
Abstract:
The question of when modern birds (Neornithes) first diversified has generated much debate among avian systematists. Fossil evidence generally supports a Tertiary diversification, whereas estimates based on molecular dating favor an earlier diversification in the Cretaceous period. In this study, we used an alternate approach, the inference of historical biogeographic patterns, to test the hypothesis that the initial radiation of the Order Psittaciformes (the parrots and cockatoos) originated on the Gondwana supercontinent during the Cretaceous. We utilized broad taxonomic sampling (representatives of 69 of the 82 extant genera and 8 outgroup taxa) and multilocus molecular character sampling (3,941 bp from mitochondrial DNA (mtDNA) genes cytochrome oxidase I and NADH dehydrogenase 2 and nuclear introns of rhodopsin intron 1, tropomyosin alpha-subunit intron 5, and transforming growth factor ß-2) to generate phylogenetic hypotheses for the Psittaciformes. Analyses of the combined character partitions using maximum parsimony, maximum likelihood, and Bayesian criteria produced well-resolved and topologically similar trees in which the New Zealand taxa Strigops and Nestor (Psittacidae) were sister to all other psittaciforms and the cockatoo clade (Cacatuidae) was sister to a clade containing all remaining parrots (Psittacidae). Within this large clade of Psittacidae, some traditionally recognized tribes and subfamilies were monophyletic (e.g., Arini, Psittacini, and Loriinae), whereas several others were polyphyletic (e.g., Cyclopsittacini, Platycercini, Psittaculini, and Psittacinae). Ancestral area reconstructions using our Bayesian phylogenetic hypothesis and current distributions of genera supported the hypothesis of an Australasian origin for the Psittaciformes. Separate analyses of the timing of parrot diversification constructed with both Bayesian relaxed-clock and penalized likelihood approaches showed better agreement between geologic and diversification events in the chronograms based on a Cretaceous dating of the basal split within parrots than the chronograms based on a Tertiary dating of this split, although these data are more equivocal. Taken together, our results support a Cretaceous origin of Psittaciformes in Gondwana after the separation of Africa and the India/Madagascar block with subsequent diversification through both vicariance and dispersal. These well-resolved molecular phylogenies will be of value for comparative studies of behavior, ecology, and life history in parrots.
COHEN, C., WAKELING, J. L. et al. (2012)
COHEN, C., WAKELING, J. L., MANDIWANA-NEUDANI, T. G., SANDE, E., DRANZOA, C., CROWE, TI. M., BOWIE, R.C. K. (2012)
Phylogenetic affinities of evolutionarily enigmatic African galliforms: the Stone Partridge Ptilopachus petrosus and Nahan's Francolin Francolinus nahani, and support for their sister relationship with New World quails.
IBIS 154 (4): 768–780 (October 2012)
DOI: 10.1111/j.1474-919X.2012.01269.x
Abstract:
The monotypic Stone Partridge Ptilopachus petrosus (Galliformes: Phasianidae), restricted to arid rocky areas of the northern savanna belt including the Sahel on the southern border of the Sahara Desert, is a taxonomic enigma. Historically, it has been grouped with Asian forest partridges (Galloperdix and Bambusicola spp.). However, recent DNA-based phylogenetic research has suggested that its closest relative is Nahan's Francolin Francolinus nahani, another taxonomically enigmatic African galliform, and a globally threatened, narrow endemic species associated with the interior of remnant primary forests of the eastern equatorial lowlands of the Democratic Republic of the Congo and Uganda. This hypothesis is investigated in greater detail using additional DNA evidence and information on behaviour and vocalizations. Phylogenetic analyses of the combined sequences from three nuclear and four mitochondrial markers (5554 bases for 84 galliform taxa) overwhelmingly support the sister relationship between F. nahani and P. petrosus. They, in turn, are the distantly related sister taxon of the New World quails (Odontophoridae), and are not related to any other Old World galliform.
HACKETT, S. J., KIMBAL, R. T. et al. (2008)
HACKETT, S. J., *, KIMBAL, R. T., REDDY, S., BOWIE, R. C. K., BRAUN, E. L., BRAUN, M. J., CHOJNOWSKI, J. L., COX, W. A., HAN, K.-L., HARSHMAN, J., HUDDLESTON, C. J., MARKS, B. D-, MIGLIA, K. J., MOORE, W. S., SHELDON, F. H., STEADMAN, D. W., WITT, C. C. & YURI, T. (2008)
A Phylogenomic Study of Birds Reveals Their Evolutionary History.
Science 320 (5884): 1763-1768 (27. Juni 2008). DOI: 10.1126/science.1157704
Abstract:
Deep avian evolutionary relationships have been difficult to resolve as a result of a putative explosive radiation. Our study examined ∼32 kilobases of aligned nuclear DNA sequences from 19 independent loci for 169 species, representing all major extant groups, and recovered a robust phylogeny from a genome-wide signal supported by multiple analytical methods. We documented well-supported, previously unrecognized interordinal relationships (such as a sister relationship between passerines and parrots) and corroborated previously contentious groupings (such as flamingos and grebes). Our conclusions challenge current classifications and alter our understanding of trait evolution; for example, some diurnal birds evolved from nocturnal ancestors. Our results provide a valuable resource for phylogenetic and comparative studies in birds.