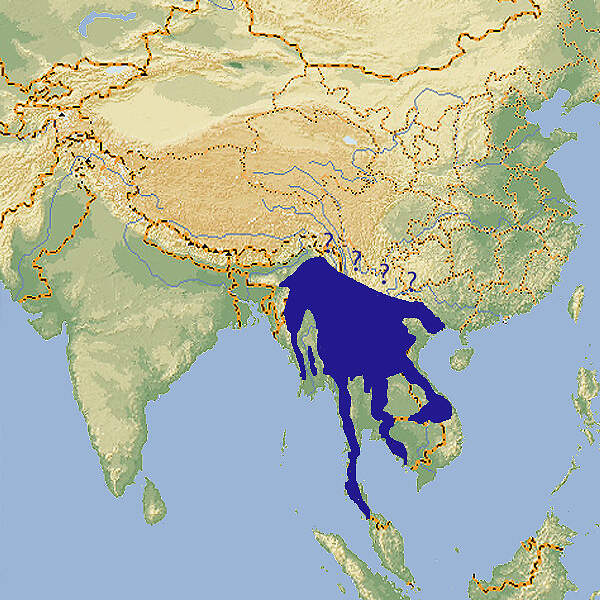
Indochina-Serau
Überordnung: LAURASIATHERIA
Taxon ohne Rang: CETARTIODACTYLA
Ordnung: Paarzeher (ARTIODACTYLA)
Unterordnung: Wiederkäuer (Ruminantia)
Familie: Hornträger (Bovidae)
Unterfamilie: Ziegenartige: (Caprinae)
Tribus: Gemsenverwandte (Naemorhedini)

Indochinesischer Serau
Capricornis maritimus • The Indochinese Serow • Le saro d'Indochine
- Körperbau und Körperfunktionen
- Verbreitung
- Lebensraum und Lebensweise
- Gefährdung und Schutz
- Bedeutung für den Menschen
- Haltung
- Taxonomie und Nomenklatur
- Literatur und Internetquellen
|
Weitere Bilder auf BioLib.cz |
Der Indochinesische Serau ist ein in seiner Heimat nicht gefährdeter Gemsenverwandter, der in Japan in vielen Zoos gezeigt wird, in Europa aber stets nur selten zu sehen war und gegenwärtig (2019) nicht mehr gehalten wird. Ein Grund für die geringe Beliebtheit der Art dürfte ihre einzelgängerische Lebensweise und ihre hohe innerartliche Aggression sein. Körperbau und KörperfunktionenBeim Indochina-Serau gibt es praktisch keinen Geschlechtsdimorphismus. Die Tiere erreichen eine Kopf-Rumpflänge von 140-155 cm, eine Schulterhöhe von 85-94 cm und ein Gewicht von 85-140 kg. Die leicht gekrümmten Hörner sind kurz, die Ohren deutlich länger. Der Schwanz ist mit 11-16 cm länger als beim Japan-Serau. Stark ausgeprägte Voraugendrüsen finden sich bei beiden Geschlechtern, ebenso Zwischenzehendrüsen. Das Fell ist kurz mit einer langen, aber schütteren Nackenmähne. Die Farbe ist grauschwarz mit weißen Haaren in der Mähne und weißen Abzeichen im Maulbereich, ev. an Kehle und Brust. Läufe sind vom Karpal- bzw. Tarsalgelenk an rotbraun, dies im Gegensatz zum südlich anschließenden Sumatra-Serau, der schwarze Beine hat [6; 9]. VerbreitungSüdostasien: Kambodscha, Laos, Myanmar, Thailand, Vietnam [5; 7; 9]. Wegen der unklaren Abgrenzung gegenüber anderen Festlandformen variieren die Angaben zur Verbreitung. Lebensraum und Lebensweise Der Indochinesische Serau besiedelt Wälder im Tiefland und im Gebirge, dort vorzugsweise steile Hänge mit eingesprengten Felspartien, ferner Gebüsch mit Rhododendron- und Heidelbeersträuchern. Er kommt auch auf Karstinseln in Küstennähe vor, z.B. auf Cat Ba in Vietnam. Er ist hauptsächlich während der Dämmerung aktiv, ist überwiegend ein Einzelgänger und ein selektiver Laubäser, der z.B. auf Cat Ba Zweige und Blätter von 34 Strauch- und Baumarten konsumiert. Die Trächtigkeit dauert je nach Quelle 197-240 Tage, meistens werden Einzelkitze geworfen [6]. Gefährdung und SchutzDer Indochina-Serau ist unter der Bezeichnung Capricornis sumatraensis seit 2020 als gefährdet (VULNERABLE) in der Roten Liste der IUCN aufgeführt. Zuvor figurierte er als C. milneedwardsi in der Kategorie "potenziell gefährdet" (NEAR THREATENED). In der Beurteilung der IUCN/SSC Caprinae Specialist Group wurde C. s. maritimus als gefährdet eingestuft, allerdings mit dem Hinweis, dass über die Bedrohungslage in den einzelnen Ländern zu wenig bekannt sei. Gefährdungsursachen sind nicht-nachhaltige Bejagung bzw. Fang mit Schlingen und Lebensraumverlust [5; 7]. Festlandseraue sind unter den Bezeichnungen Capricornis milneedwardsi, C. rubidus, C. sumatraensis und C. thar in CITES-Anhang I aufgeführt. Zoogestütztes Artenschutzprojekt (Beispiel):
Bedeutung für den MenschenFestlandseraue werden zur Gewinnung von Fleisch, Fellen und von Körperteilen, vor allem Knochen, für die Zwecke der traditionellen orientalischen Medizin bejagt. In Vietnam gibt es auch einen Markt für lebende Tiere [5]. Laut CITES-Handelsstatistik wurde in den Jahren 1997-2007 ein gewisser Handel mit Teilen und Erzeugnissen registriert, aber von 1975-2020 wurde kein einziger lebender Wildfang und nur ein Nachzuchttier aus Thailand erfasst [1]. HaltungBei der Gehegegestaltung ist zu berücksichtigen, dass Seraue wenig sozial sind. Abtrenngehege und Einzelboxen sind daher Pflicht [6]. Gehege für kleine Gruppen sollten größer sein, als in den Mindestanforderungen vorgegeben und sollten über Sichtblenden und Rückzugsmöglichkeiten verfügen. WEIGL gibt als Höchstalter im Zoo über 19 Jahre an, erreicht von einem Wildfangbock im Dusit Zoo in Bangkok, der nach einer Haltungsdauer von 18 Jahren und 5 Monaten abgegeben wurde [8]. Der Dusit Zoo hielt und züchtete Seraue vor 1974, als der ganze Bestand von 9 Tieren an einer Krankheit verendete. Danach hielt er ein als Capricornis sumatranus milneedwardsi bezeichnetes Paar, das 1979 Nachwuchs brachte. Außerhalb der Brunftzeit wurde das Paar getrennt gehalten [4]. Haltung in europäischen Zoos: Festlandseraue waren in europäischen Zoos stets extrem selten. Laut Zootierliste. wurde seit dem Zweiten Weltkrieg nur ein einziges Exemplar kurz im Tierpark Berlin gehalten. Mindestanforderungen an Gehege: Nach Säugetiergutachten 2014 des BMEL soll für bis zu 5 Tieren ein Gehege von mindestens 250 m² zur Verfügung stehen, für jedes weitere Tier 20 m² zusätzlich. Ein Stall ist nicht erforderlich. Die Schweizerische Tierschutzverordnung (Stand 01.06.2022) schreibt für bis zu 4 Tieren ein Gehege vor, dessen Grundfläche 500 m² misst. Für jedes weitere Tier kommen 50 m² zur Basisflächen dazu. Es sind natürliche oder künstliche Unterstände anzubieten, in denen alle Tiere gleichzeitig Platz finden. Werden die Tiere aufgestallt, ist eine Grundfläche von mindestens 4 m²/Tier vorgeschrieben. Nach der 2. Tierhaltungsverordnung Österreichs (Stand 2023) sind für bis zu 10 Tiere 500 m² erforderlich, für jedes weitere 50 m² mehr. Es müssen Unterstände zum Schutz gegen Witterungsverhältnisse wie Regen, Wind, Sonneneinstrahlung und Hitze angeboten werden, so dass alle Tiere bei Bedarf darin gleichzeitig Unterschlupf finden können. Die Haltung hat in Herden zu erfolgen. Taxonomie und NomenklaturDer Indochinesische Serau wurde 1888 von dem bretonischen Missionar und Naturforscher Pierre Marie HEUDE, der lange Zeit in China und Indochina tätig war, anhand eines Exemplars aus Tonkin (Nordvietnam) unter seinem nach HANDBOOK heute noch (bzw. wieder) gültigen Namen erstmals wissenschaftlich beschrieben. Zeitweilig wurde er als Unterart von C. sumatraensis, zeitweilig als solche von C. milneedwardsi eingestuft. Die Rote Liste der IUCN subsumiert ihn seit 2020 wieder unter C. sumatraensis. Die gegenwärtig gültige Gattung Capricornis wurde 1836 von dem aus Irland stammenden Naturforscher William OGILBY aufgestellt [2; 3; 5; 7; 9; 10]. Die Systematik der Seraue ist nicht ganz klar. Früher wurden alle Festland-Seraue als eine einzige Art betrachtet. Die Caprinae Spezialisten-Gruppe der IUCN ging von 3, die Rote Liste von 4, WILSON & REEDER von 6 und das Handbook of the Mammals of the World von 7 Arten aus. Bisweilen werden Seraue und Gorale in einer Gattung (Naemorhedus) zusammengefasst [3; 5; 7; 9; 10]. |
Literatur und Internetquellen
- CITES TRADE DATA BASE
- HALTENORTH, T. & TRENSE, W. (1956)
- MATSCHEI, C. (2012)
- MECKVICHAI, C. & MAHANNOP, A. (1987)
- PHAN, T.D., NIJHAWAN, S., LI, S. & XIAO, L. (2020). Capricornis sumatraensis. The IUCN Red List of Threatened Species 2020: e.T162916735A162916910. https://dx.doi.org/10.2305/IUCN.UK.2020-2.RLTS.T162916735A162916910.en. Accessed on 10 February 2022.
- PUSCHMANN, W., ZSCHEILE, D., & ZSCHEILE, K. (2009)
- SHACKLETON, D.M. (1997)
- WEIGL, R. (2005)
- WILSON, D. E. et al. eds. (2009-2019)
- WILSON, D. E. & REEDER, D. M. (2005)
Zurück zu Übersicht Paarzeher
Weiter zu Himalaya-Goral (Naemorhedus goral)
YAMAMOTO, S. (1967)
Breeding Japanese serows Capricornis crispus in captivity.
International Zoo Yearbook 7: 174-175.
Inhalt:
Es wird ei n Überblick über die 1966 in Japan gehaltenen Seraue gegeben. Der Kobe Oji-Zoo erhielt 1964 ein Paar. Am 25. August 1965 kam es zur ersten Geburt, im Juli 1966 zur zweiten.
yamamoto-biblio
HOLLAND, J. & PUTNAM, A. (2014)
Population Analysis and MateRx Japanese Serow (Capricornis crispus).
14 Seiten. Hrsg. Lincoln Park Zoo & Association of Zoos and Aquariums
Explanation:
Recommendations Provided from MateRx:
MateRx is analytical software developed jointly by the National Zoological Park and Lincoln Park Zoo. The primary output is a matrix of genetic ratings (Mate Suitability Indices = MSI) for every possible breeding pair in a population. MSIs allow managers to quickly discover how the genetic status of animals in their collections compare to the rest of a managed population.
Each MSI represents the genetic consequences for the population if a given pair was to produce offspring. There are seven values for MSIs: offspring of pairs rated 1, 2, or 3 would benefit the population’s genetic situation; pairs rated 4, 5, or 6 would be detrimental to the population’s genetic situation. Pairs without an MSI value (i.e., a dash [--]) should not be considered under any circumstances without consulting an advisor.
holland-biblio
MATSCHEI, Ch. (2003)
Vergleichende Untersuchungen zur Fortpflanzungs- und Entwicklungsbiologie der Rupicaprini (Mammalia: Bovidae: Artiodactyla) unter besonderer Berücksichtigung der Gattungen Nemorhaedus und Capricornis in Zoologischen Gärten.
Dissertation
285 Seiten
Fachbereich Biologie, Chemie, Pharmazie (Prof. Dr. Burkhard Schricker)
Freie Universität Berlin
Nationale und internationale Einrichtungen; Schwerpunkt Europa, USA, Japan
Freie Universität Berlin, Staatsbibliothek Berlin, Zoobibliotheken der unterstützenden Einrichtungen
Zusammenfassung:
Die Arbeit befasst sich mit der vergleichenden Fortpflanzungs- und Entwicklungsbiologie der Rupicaprini in den Zoologischen Gärten weltweit. Gegenstand der Untersuchungen waren die Mittelchinesischen Gorale Nemorhaedus goral arnouxianus, die Japanischen Seraus Capricornis crispus crispus, die Schneeziegen Oreamnos americanus und die Abruzzen-Gämsen Rupicapra pyrenaica ornata. Weitere Arten bzw. Unterarten wurden ergänzend betrachtet.
Folgende Ergebnisse können aufgeführt werden:
1. Mittelchinesische Gorale brunsten zwischen Oktober und November, Japanische Seraus zwischen September und Dezember, Schneeziegen zwischen November und Januar, Abruzzen- und Alpen-Gämsen von Oktober bis Januar, verstärkt im November. Die Geburten erfolgen meist in den Monaten Mai und Juni (Gorale, Seraus, Gämsen). Schneeziegen setzen ihre Kitze in der letzten Mai- und ersten Juniwochen. Bei den Alpen-Gämsen ist eine jahreszeitliche Umkehrung von Wurf- und Setzzeit auf der Südhalbkugel erkennbar.
Eine Verschiebung der Brunst- und Wurfzeiten konnte bei unterschiedlichen klimatischen, wie auch geographischen Bedingungen, innerhalb und außerhalb der „biologischen“ Breitengrade, nicht nachgewiesen werden. In äquatorialen Tiergärten verhalten sich außertropische Gorale asaisonal polyoestrisch.
2. Die Geißen und Böcke der Mittelchinesischen Gorale sind mit durchschnittlich 19 Monaten geschlechtsreif. Das jüngste Weibchen brunstete mit 9 Monaten. Beide Geschlechter der Japanischen Seraus brunsten erstmals mit 28 Monaten. Einige Geißen sind mit 16 Monaten fortpflanzungsfähig. Selten deckten 15jährige Böcke. Die Geißen der Schneeziegen sind mit durchschnittlich 2 ½ Jahren, selten mit 16 Monaten, fortpflanzungsfähig. Böcke decken meist ab dem 30. Monat. Alpen-Gämsen sind mit 19 bis 30 Monaten geschlechtsreif. Bei den Abruzzen-Gämsen nehmen die Geißen mit 1 ½ Jahren, die Böcke mit 2 ½ Jahren, an der Brunst teil.
3. Mittelchinesische Gorale tragen im Durchschnitt 208 bis 211 Tage. Die Zyklusdauer beträgt 20,5 Tage. Japanische Seraus setzten nach 218 Tagen ein Kitz. Ihr Zyklus dauert 21,6 Tage. Schneeziegen tragen 177 bis 187 Tage. Der Zyklus der Geiß dauert 15 bis 22 Tage. Die Kitze der Alpen-Gams werden nach 171 – 180 Tagen gesetzt. Die Zykluslänge beträgt 20 – 21 Tage.
4. Mittelchinesische Gorale setzten Einzelkitze. Mehrlingsgeburten sind bisher nicht bekannt. Das Geburtsverhältnis von 146 Geburten weltweiter Tiergärten beträgt 1,27 ♂♂ auf 1 ♀♀. Die Mortalität ist meist gering (Ø 17%). Japanische Seraus setzen Einzelkitze. Mehrlinge sind nicht bekannt. Das Geburtsverhältnis beträgt 1 ♂♂ zu 1,2 ♀♀ (Europa, USA) – 1,3 ♀♀ (Japan). Die Mortalität ist mit 31 bis 53% sehr hoch. Schneeziegen setzen Einzel- und Zwillingskitze. Drillingswürfe sind aus den Zoologischen Gärten bisher nicht bekannt. Das Geschlechtsverhältnis beträgt 1,2 ♂♂ zu 1 ♀♀. Die Mortalität liegt bei etwa 37%. Alpen-Gämsen setzen 1 bis 2 Jungtiere. Die Zwillingsrate liegt unter 12%. Das Geschlechtsverhältnis ist ausgeglichen und die Mortalität ist gering. Abruzzen-Gämsen setzten in München/ Deutschland (einziger Halter weltweit) bisher nur Einlinge. Die Mortalität ist unter den Neonaten sehr gering. Das Geschlechtsverhältnis ist ausgewogen.
5. Die Gravidität aller Gattungen verläuft sehr unauffällig. In den letzten Tagen verringert sich die Aktivität (Seraus, Gämsen). Die Geißen haben ein geringeres Bewegungsbedürfnis (Seraus, Gämsen). Das Markierungsverhalten bleibt unauffällig (Schneeziegen, Gorale, Gämsen) oder wird betont (Seraus). Die Geißen verbleiben bis kurz vor der Geburt in der Gruppe (Gorale) oder distanzieren sich allmählich (Schneeziegen, Gämsen, Seraus). Kitze des letzten Jahres und Böcke werden bei ausreichendem Raumangebot geduldet. Die Nahrungsaufnahme wird am Tag der Geburt vermindert. Geburtsplätze werden aufgesucht (Gorale, Seraus, Gämsen). Diverse Geburtsindikatoren.
6. Geburten erfolgen in der Morgendämmerung (Gorale, Gämsen), am Vormittag (alle Gattungen), nachmittags (alle Gattungen) und am Abend (Seraus, Gämsen). Die Vorbereitungsphase dauerte bei allen Rupicaprini 1 bis 3 Tage (selten bis 7 Tage), die Eröffnungsphase 15 bis 60 Minuten, die Austreibungsphase 2 bis 20 Minuten und die Nachgeburtsphase 3 - 3 ½ h (Gorale, Seraus). Gorale, Seraus und Gämsen setzten im Stehen. Die Kitze kommen meist in Kopfendlage zur Welt. Eine Schneeziegengeburt fand im Liegen statt. Gorale und Seraus fressen Plazentareste und reinigen den Geburtsort. Die sensiblen Prägungsphasen dauern 11 bis 17 Minuten, die absoluten oftmals 29 bis 40 Minuten.
7. Goralgeißen kommunizieren mit Neonaten während der ersten Lebensstunden.
8. Kitze stehen mit 10 bis 15 Minuten. Erste quadropede Lokomotion mit 12 bis 20 (selten 30) Minuten. Jungtiere sind Nachfolger (Schneeziegen, Gämsen, Seraus). Gorale lassen Kitze lange allein zurück. Sie sind temporäre Ablieger. Muttertiere fressen Kot und Urin im ersten Monat (nur Gorale). Bindung zwischen Geiß und Kitz sehr fest. Jungtiere zeigen Kampf- (Schneeziegen, Gämsen, selten Gorale und Seraus) und Bewegungsspiele (Gorale, Gämsen, Seraus). Kitze in den ersten Wochen untereinander anonym (Gorale). Alle Jungtiere sind vor der nächsten Brunst der Geiß entwöhnt. Die Entwicklung des Saugverhaltens wird detailliert beschrieben. Gorale und Seraus nehmen ab dem 6. und 16. Lebenstag feste Nahrung auf.
9. Geburtsgewicht der Gorale meist zwischen 2,7 und 2,9 kg. Schneeziegen wiegen im Mittel 4,3 bis 4,9 kg. Geschlechter und Zwillingskitze unterscheiden sich kaum im Gewicht. Seraukitze wiegen 2,9 bis 3,5 kg. Eine männliche Totgeburt der Abruzzen-Gams wog 3,1 kg. Alle Jungtiere entwickeln sich schnell. Nur Schneeziegen besitzen von Geburt an Hörner. Alle Gattungen zeigen eine Abhängigkeit von Körpermasse und sexueller Reife.
10. Alle Gattungen zeigen ein differenziertes Brunstverhalten. Die Vielfalt der Brunstelemente nimmt wie folgt zu: Serau – Schneeziege – Goral – Gams. Die Geiß bestimmt den Zeitpunkt der Kopulation (außer Serau). Böcke markieren verstärkt Strukturen (Gams, Serau). Goral und Gams zeigen Automarkierung. Gämsen mit akustischer Markierung. Kein reaktives Harnen der Geißen bei Goral und Serau. Alle untersuchten Arten mit Laufschlag. Geiß signalisiert Bereitschaft. Mehrfachkopulationen bei Goral und Serau. Deckakte bevorzugt in Morgen- und Nachmittagsstunden. Außerhalb der Geißenbrunst sind Böcke nicht permanent bei dem Weibchen. Männchen mit verminderter Nahrungsaufnahme (Gämsen, Schneeziege). Zahlreiche Verhaltensweisen werden detailliert beschrieben.
Abstract:
This doctoral thesis looks into the comparative breeding and evolution biology of the Rupicaprini in the zoos worldwide. Subject of the research were the Central Chinese gorals Nemorhaedus goral arnouxianus, the Japanese serow Capricornis crispus crispus, the Mountain goats Oreamnos americanus and the Abruzzo chamois Rupicapra pyrenaica ornata. Additional it was looked at other species and subspecies.
Here I list the following results:
1. Central Chinese gorals have their rutting season between October and November, Japanese serows between September and Dezember, Mountain goats between November and January and Abruzzo- and Alpine chamois between Oktober and January, mainly in November. Most of the time the gorals, serows and chamois deliver in May or June. Mountain goats give birth to their kids in the last week of May or the first week of June. Regarding the Alpine chamois we can recognize that there is a seasonal reversal of the birth time at the southern hemisphere.
A postponement of the breeding seasons and birth times could not be showed in different climatic and also geographic conditions inside or outside of the „biological“ latitudes. In equartorial zoos the untropic gorals behave non-seasonal polyoestrous.
2. The female and male Central Chinese gorals are sexually mature in the age of around 19 months. The youngest of the females bred when it was 9 months old. Both sexes of Japanese serows start to breed when they are 28 months old. A few females are ready to breed in the age of 16 months. 15 year old males mated the females very rarely. The Mountain goat females are ready to breed when they are around 2 ½ years old, sometimes in the age of 16 months. The males start to mate from the 30th month. Alpine chamois are ready to breed between the age of 19 to 30 months. The females of the Abruzzo chamois start to breed in the age of 1 ½ years, the males in the age of 2 ½ years.
3. Central Chinese gorals are pregnant between 208 and 211 days. The oestrous cycle is 20,5 days. Japanese serows give birth to a kid after 218 days. Their oestrous cycle is 21,6 days. Mountain goats are pregnant 177 to 187 days. The oestrous cycle of the female takes 15 to 22 days. Alpine chamois give birth to their kids after 171 – 180 days. The oestrous cycle takes 20 – 21 days.
4. Central Chinese gorals give birth to single kids. Multiple births are unknown until now. The sexual proportion of birth from 146 births in zoos worldwide is 1,27 ♂♂ to 1 ♀♀. The mortality most of the time is small (Ø 17%). Japanese serows give birth to single kids. Multiple births are unknown. The sexual proportion is 1 ♂♂ to 1,2 ♀♀ (Europe, USA) – 1,3 ♀♀ (Japan). The mortality is very high between 31 to 53%. Mountain goats give birth to single and twin kids. Triplet litters are not known until now from the zoological gardens. The sexual proportion is 1,2 ♂♂ to 1 ♀♀. The mortality is around 37%. Alpine chamois give birth to 1 to 2 kids. The birthrate of twins is under 12%. The sexual proportion is balanced and the mortality is low. Until now the Abruzzo chamois in Munich Zoo/ Germany (only owner worldwide) gave birth to only one kid. The mortality between the newborn animals is very small. The sexual proportion is balanced.
5. The pregnancy of all genus proceeds very inconspicuous. During the last days the activity decreases (serows, chamois). The females have a smaller need to move (serows, chamois). The mark behaviour stays inconspicuous (Mountain goats, gorals, chamois) or increases (serows). Shortly before the birth happens the females leave the group (gorals) or they gradual dissociate (Mountain goats, chamois, serows). The kids from last year and the male are allowed to stay, if there is enough space. At the day of birth the females decrease the food intake. They go to birth places (gorals, serows, chamois). Various birth indicators.
6. The births happen in the dawn (gorals, chamois), in the morning (all species) and in the evening (serows, chamois). The preparation time for all Rupicaprini took 1 to 3 days (rarely up to 7 days), the opening phase 15 to 60 minutes, the expulsive stage 2 to 20 minutes and the afterbirth phase 3 to 3 ½ hours (gorals, serows). Gorals, serows and chamois give birth while they are standing. Most of the time the kids are born in an anterior presentation. One Mountain goat laid down when it gave birth to the kid. Gorals and serows eat the rest of placenta and they clean up the place of birth. The sensitive imprinting takes 11 to 17 minutes, the absolutely often 29 to 40 minutes.
7. Goral femals communicate with their new born kids in the first hours.
8. When the kids are 10 – 15 minutes old they are able to stay. First quadrupede locomotion with 12 to 20 (rarely 30) minutes. Young animals are successors (Mountain goats, chamois, gorals). For a long time gorals leave their kids alone. They are temporary laid down. Dams eat during the first months the excrements and the urine (only gorals). The relationship between the female and kid is very close. The young animals show fights (Mountain goats, chamois, rarely gorals and serows) and motion games (gorals, serows, chamois). During the first weeks the kids among each others are anonymous (gorals). All young animals are weaned from their mother before the next rutting season starts. The development of the suck behaviour is described in details. Gorals start at the 6th day and serows at the 16th day to take solid food.
9. The weight at birth of gorals is between 2,7 and 2,9 kg (5,95 – 6,29 lb). Mountain goats weigh 4,3 to 4,9 kg (9,48 – 10,8 lb). There is approximate no difference in the weight between the sexes and twin kids. Serow kids weigh between 2,9 and 3,5 kg(6,39 – 7,72 lb). A male stillbirth of Abruzzo chamois had a weigh of 3,1 kg (6,83 lb). All young animals develope fast. Only Mountain goats have horns when they were born. All genus show a interdepencence between body mass and sexual maturity.
10. All genus show a distinguished behaviour of breeding. The variety of the rutting elements increases like this: serow – Mountain goat – goral – chamois. The female give the order for the moment of the copulation (except serow). Gorals and chamois show auto-marking. Chamois with acoustic marking. No reactive urinate the goral and serow females. All inquired genus with „Laufschlag“. The female signalles that she is ready. Multiple copulations from goral and serow. The animals prefer the morning of noon hours to cover. Beyond the rutting season the males are not always together with the females. Males with reduced food intake (chamois, Mountain goats). Numerous behaviours are described in details.
matschei-biblio
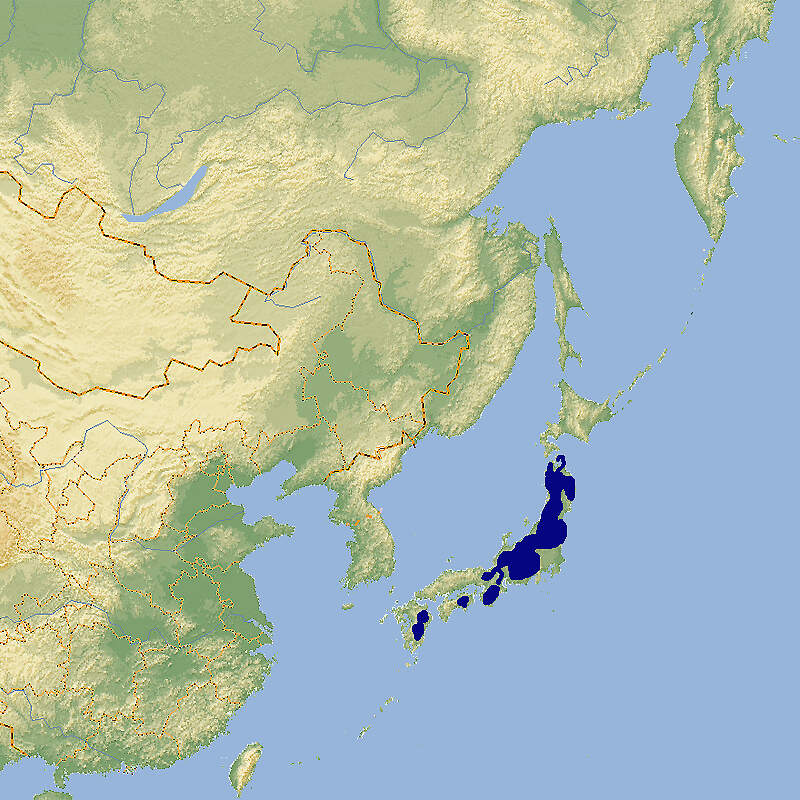
Japanischer Serau
Überordnung: LAURASIATHERIA
Taxon ohne Rang: CETARTIODACTYLA
Ordnung: Paarzeher (ARTIODACTYLA)
Unterordnung: Wiederkäuer (Ruminantia)
Familie: Hornträger (Bovidae)
Unterfamilie: Ziegenartige: (Caprinae)
Tribus: Gemsenverwandte (Naemorhedini)

Japanischer Serau
Capricornis crispus • The Japanese Serow • Le saro du Japon
- Körperbau und Körperfunktionen
- Verbreitung
- Lebensraum und Lebensweise
- Gefährdung und Schutz
- Bedeutung für den Menschen
- Haltung
- Taxonomie und Nomenklatur
- Literatur und Internetquellen
|
Weitere Bilder auf BioLib.cz |
Der Japanische Serau ist ein in seiner Heimat nicht gefährdeter Gemsenverwandter, der in Japan in vielen Zoos gezeigt wird, in Europa aber stets nur selten zu sehen war und gegenwärtig (2019) nicht mehr gehalten wird. Ein Grund für die geringe Beliebtheit der Art dürfte ihre einzelgängerische Lebensweise und ihre hohe innerartliche Aggression sein. Körperbau und KörperfunktionenBeim Japan-Serau gibt es praktisch keinen Geschlechtsdimorphismus. Die Tiere erreichen eine Kopf-Rumpflänge von etwa 130 cm, eine Schulterhöhe von 68-80 cm und ein Gewicht von 31-48 kg. Die leicht gekrümmten Hörner werden 12-16 cm lang. Der Schwanz ist mit 6-8 cm sehr kurz. Stark ausgeprägte Voraugendrüsen finden sich bei beiden Geschlechtern, ebenso Zwischenzehendrüsen. Das Fell ist lang und dicht. Seine Grundfärbung ist blaugrau oder graubraun mit weißen Haaren gesprenkelt, stellenweise schwarz. Die Beine, Ohren und der nackte Nasenspiegel und der kaum behaarte Nasenrücken sind schwarz, allenfalls dunkelbraun, die Kehle und Backenbärte weiß oder hellgrau [1; 6; 8; 13]. VerbreitungJapan: Honshu, Shikoku, Kyushu. In den letzten 30 Jahren konnte der Serau sein Verbreitungsgebiet von rund 34'500 km² auf gegen 60'000 km² ausweiten [5]. Lebensraum und Lebensweise Der Japan-Serau besiedelt alpine Rasen, subalpine Koniferenwälder und Laubwälder der kollinen Stufe [5]. Die Tiere sind hauptsächlich tagsüber aktiv, können aber auch nachts weiden.Sie sind gewöhnlich Einzelgänger, gelegentlich werden aber auch Gruppen bis zu 7 Tieren angetroffen. Die Einzeltiere haben Streifgebiete von wenigen Hektar, die sie als Territorium mit dem wachsartigen Sekret ihrer Voraugendrüsen und durch feste Kotplätze markieren und gegen Artgenossen verteidigen. Oft stehen sie reglos an einer exponierten Stelle, um Präsenz zu markieren. Familienterritorien können bis etwa 22 ha groß sein. Seraue nutzen ein weites Spektrum an Nahrungspflanzen einschließlich Koniferen. Bevorzugt fressen sie Laub von immergrünen und winterkahlen Bäumen und Sträuchern, ferner Farne sowie Gräser, Kräuter und Früchte [2; 5; 7]. Im Gegensatz zu den tropischen Serau-Arten haben die Japan-Seraue eine feste Paarungszeit, die von September bis November dauert. Nach einer Tragzeit von 195-210 Tagen wird im Mai-Juli meistens ein einzelnes Kitz gesetzt, seltener Zwillinge. Seraukitze wiegen bei der Geburt 2,9 bis 3,5 kg. Sie können 12 bis 20 (selten 30) Minuten nach der Geburt gehen und folgen ihrer Mutter. Sie nehmen ab dem 6.- 16. Lebenstag feste Nahrung auf und sind vor der nächsten Brunst der Geiß entwöhnt. Die Geschlechtsreife wird mit anderthalb Jahren erreicht [2; 3]. Gefährdung und SchutzIn der ersten Hälfte des 20. Jahrhunderts büßte der Japanische Serau große Teile seines Areals ein. Heute ist er weit verbreitet, hat eine große Gesamtpopulation (ca. 100'000 Tiere) und stabile bis zunehmende Bestände. Sein Areal ist mittlerweileetwa anderthalb mal so groß wie die Schweiz. Er wurde deshalb im Rahmen einer Beurteilung im Jahr 2008, bestätigt 2020, als nicht-gefährdet eingestuft (Rote Liste: LEAST CONCERN) [5]. Der internationale Handel ist nicht nach CITES geregelt. Bedeutung für den MenschenDer Serau wurde in Japan traditionell zur Fleischgewinnung gejagt. Bis in die 195034-Jahre war dies nicht nachhaltig und meistens illegal. Nachdem die Wilderer-Syndikate eliminiert werden konnten, nahmen die Bestände zu, mit dem Ergebnis, dass es zu größeren forstwirtschaftlichen Schäden kam, was die Behörden veranlasste die Bestände zu reduzieren [5]. HaltungBei der Gehegegestaltung ist zu berücksichtigen, dass Seraue wenig sozial sind. Abtrenngehege und Einzelboxen sind daher Pflicht. Gehege für kleine Gruppen sollten größer sein, als in den Mindestanforderungen vorgegeben und sollten über Sichtblenden und Rückzugsmöglichkeiten verfügen. WEIGL gibt als Höchstalter im Zoo 24 Jahre an, erreicht von einer zoogeborenen Geiß in einem japanischen Zoo, andernorts wird auf ein Rekordalter von 27 Jahren, 7 Monaten und 25 Tagen verwiesen [2; 6]. Die Welterstzucht gelang am 25. August 1965 im Kobe Oji-Zoo von einem Paar, das 1964 gefangen worden war [9]. Für den Japanischen Serau gibt es seit 1971 ein Internationales Zuchtbuch, das früher am Tiergarten Schönbrunn geführt wurde und heute am Toyama Familienpark-Zoo in Japan geführt wird. Dieses umfasste im Dezember 2016 796 lebende Individuen in 130 Einrichtungen [IZY 52]. Haltung in europäischen Zoos: Die Ersteinfuhr nach Europa erfolgte 1879 durch den Londoner Zoo. Währenddem die Art in japanischen Zoos häufig anzutreffen ist, war sie außerhalb ihres Ursprungslands stets selten. 2007 wurde mit 45 Individuen in europäischen und nordamerikanischen Zoos der Höchststand erreicht, danach erfolgte ein dramatischer Rückgang bis 2014 auf noch 22 Tiere [1], und seitdem ist der europäische Bestand ganz ausgestorben. Bis 2018 lebte in Aussig an der Elbe noch ein einzelnes Tier. Dem nordamerikanischen Bestand, der 2019 noch 10 Tiere in 4 Haltungen umfasste, droht dasselbe [10]. Für Details siehe Zootierliste. Im Tiergarten Schönbrunn war 1994 die europäische Erstzucht gelungen, dem Zoologischen Garten Berlin 1997 die deutsche Erstzucht. Mindestanforderungen an Gehege: Nach Säugetiergutachten 2014 des BMEL soll für bis zu 5 Tieren ein Gehege von mindestens 250 m² zur Verfügung stehen, für jedes weitere Tier 20 m² zusätzlich. Ein Stall ist nicht erforderlich. Die Schweizerische Tierschutzverordnung (Stand 01.06.2022) schreibt für bis zu 4 Tieren ein Gehege vor, dessen Grundfläche 500 m² misst. Für jedes weitere Tier kommen 50 m² zur Basisflächen dazu. Es sind natürliche oder künstliche Unterstände anzubieten, in denen alle Tiere gleichzeitig Platz finden. Werden die Tiere aufgestallt, ist eine Grundfläche von mindestens 4 m²/Tier vorgeschrieben. Nach der 2. Tierhaltungsverordnung Österreichs (Stand 2023) sind für bis zu 10 Tiere 500 m² erforderlich, für jedes weitere 50 m² mehr. Es müssen Unterstände zum Schutz gegen Witterungsverhältnisse wie Regen, Wind, Sonneneinstrahlung und Hitze angeboten werden, so dass alle Tiere bei Bedarf darin gleichzeitig Unterschlupf finden können. Die Haltung hat in Herden zu erfolgen. Taxonomie und NomenklaturDer Japanische Serau wurde 1844 von Coenraad Jacob TEMMINCK vom Naturhistorischen Museum in Leiden als "Antilope crispa" erstmals wissenschaftlich beschrieben. Die gegenwärtig gültige Gattung Capricornis wurde 1836 von dem aus Irland stammenden Naturforscher William OGILBY aufgestellt [7; 8]. Die Systematik der Seraue ist nicht ganz klar, Die Caprinae Spezialisten-Gruppe der IUCN geht von 3, WILSON & REEDER sowie die Rote Liste der IUCN gehen von sechs Arten aus. Das Handbook of the Mammals of the World von 7. Von den Goralen werden vier Arten unterschieden. Bisweilen werden Seraue und Gorale in einer Gattung (Naemorhedus) zusammengefasst [4; 5; 7; 8]. |
Literatur und Internetquellen
- HOLLAND, J. & PUTNAM, A. (2014)
- MATSCHEI, C. (2012)
- PUSCHMANN, W., ZSCHEILE, D., & ZSCHEILE, K. (2009)
- SHACKLETON, D.M. (1997)
- TOKIDA, K. (2020). Capricornis crispus. The IUCN Red List of Threatened Species 2020: e.T3811A22151909. https://dx.doi.org/10.2305/IUCN.UK.2020-2.RLTS.T3811A22151909.en. Accessed on 23 January 2023.
- WEIGL, R. (2005)
- WILSON, D. E. et al. eds. (2009-2019)
- WILSON, D. E. & REEDER, D. M. (2005)
- YAMAMOTO, S. (1967)
- DAMOIS, P., ROBOVSKÝ, J., MUELLER, D, PENELLO, M.,ZIMMERMANN,M., VAN DER MEER, R.AND VOORHAM, M. (eds., 2020).
Zurück zu Übersicht Paarzeher
Weiter zu Indochina-Serau (Capricornis maritimus)