REYNOLDS, R. G., NIEMILLER, M. L.; REVELL, L. J. (2014)
Toward a tree-of-life for the boas and pythons: multilocus species-level phylogeny with unprecedented taxon sampling.
Molecular Phylogenetics and Evolution 71: 201–213. doi:10.1016/j.ympev.2013.11.011.
Abstract:
Snakes in the families Boidae and Pythonidae constitute some of the most spectacular reptiles and comprise an enormous diversity of morphology, behavior, and ecology. While many species of boas and pythons are familiar, taxonomy and evolutionary relationships within these families remain contentious and fluid. A major effort in evolutionary and conservation biology is to assemble a comprehensive Tree-of-Life, or a macro-scale phylogenetic hypothesis, for all known life on Earth. No previously published study has produced a species-level molecular phylogeny for more than 61% of boa species or 65% of python species. Using both novel and previously published sequence data, we have produced a species-level phylogeny for 84.5% of boid species and 82.5% of pythonid species, contextualized within a larger phylogeny of henophidian snakes. We obtained new sequence data for three boid, one pythonid, and two tropidophiid taxa which have never previously been included in a molecular study, in addition to generating novel sequences for seven genes across an additional 12 taxa. We compiled an 11-gene dataset for 127 taxa, consisting of the mitochondrial genes CYTB, 12S, and 16S, and the nuclear genes bdnf, bmp2, c-mos, gpr35, rag1, ntf3, odc, and slc30a1, totaling up to 7561 base pairs per taxon. We analyzed this dataset using both maximum likelihood and Bayesian inference and recovered a well-supported phylogeny for these species. We found significant evidence of discordance between taxonomy and evolutionary relationships in the genera Tropidophis, Morelia, Liasis, and Leiopython, and we found support for elevating two previously suggested boid species. We suggest a revised taxonomy for the boas (13 genera, 58 species) and pythons (8 genera, 40 species), review relationships between our study and the many other molecular phylogenetic studies of henophidian snakes, and present a taxonomic database and alignment which may be easily used and built upon by other researchers.
reynolds-biblio
HARVEY, M. B., BARKER, D. G., AMMERMAN, L. K., CHIPPINDALE, P. T. (2000)
Systematics of Pythons of the Morelia amethistina Complex (Serpentes: Boidae) with the Description of three new Species.
Herpetological Monographs. 14: 139–185. doi:10.2307/1467047.
Description:
The scrub pythons (Morelia amethistina complex) are revised based on museum specimens and new material recently collected in eastern Indonesia. Morelia kinghorni (formerly M. amethistina kinghorni) and M. amethistina (formerly M. amethistina amethistina) are recognized as species, and three new species are described. The phylogenetic relationships of scrub pythons are resolved using morphological and molecular characters Scrub pythons are most closely related to Morelia boeleni and have undergone both ancient divergences and a relatively recent radiation. The distribution of scrub pythons corresponds well with areas of endemism recognized in earlier studies of other taxa. Their distribution and evolution appears to have been shaped by combined effects of dispersal and vicariance. Scrub python populations exhibit interesting color and pattern polymorphism and ontogenetic change, and these characteristics vary among populations.
harvey-biblio
RIVERA, P.C., DI COLA, V., MARTÍNEZ, J.J., GARDENAL, C.N., CHIARAVIGLIO, M. (2011)
Species delimitation in the continental forms of the genus Epicrates (Serpentes, Boidae) integrating phylogenetics and environmental niche models.
PLoS One. 2011; 6(9): e22199.
Published online 2011 Sep 2. doi: 10.1371/journal.pone.0022199
Abstract:
Until recently, the genus Epicrates (Boidae) presented only one continental species, Epicrates cenchria, distributed in Central and South America, but after a taxonomic revision using morphologic characters five species were recognized: E. cenchria, E. crassus, E. maurus, E. assisi, and E. alvarezi. We analyzed two independent data sets, environmental niche models and phylogeny based on molecular information, to explore species delimitation in the continental species of this genus. Our results indicated that the environmental requirements of the species are different; therefore there are not evidences of ecological interchangeability among them. There is a clear correlation between species distributions and the major biogeographic regions of Central and South America. Their overall distribution reveals that allopatry or parapatry is the general pattern. These evidences suggest that habitat isolation prevents or limits gene exchange among them. The phylogenetic reconstruction showed that the continental Epicrates are monophyletic, being E. alvarezi the sister species for the remaining two clades: E. crassus-E. assisi, and E. maurus-E. cenchria. The clade grouping the continental Epicrates is the sister taxon of the genus Eunectes and not of the Caribbean Epicrates clade, indicating that the genus is paraphyletic. There is a non-consistent pattern in niche evolution among continental Epicrates. On the contrary, a high variation and abrupt shifts in environmental variables are shown when ancestral character states were reconstructed on the sequence-based tree. The degree of genetic and ecological divergence among continental Epicrates and the phylogenetic analyses support the elevation to full species of E. cenchria, E. crassus, E. maurus, E. assisi, and E. alvarezi.
REYNOLDS, R. G., NIEMILLER, M. L., HEDGES, S. B., DORNBURG, A., PUENTE-ROLÓN, A. & REVELL, L. J. (2013)
Molecular phylogeny and historical biogeography of West Indian boid snakes (Chilabothrus).
Molecular Phylogenetics and Evolution Volume 68 (3): 461–470.
Abstract:
The evolutionary and biogeographic history of West Indian boid snakes (Epicrates), a group of nine species and 14 subspecies, was once thought to be well understood; however, new research has indicated that we are missing a clear understanding of the evolutionary relationships of this group. Here, we present the first multilocus, species-tree based analyses of the evolutionary relationships, divergence times, and historical biogeography of this clade with data from 10 genes and 6256 bp. We find evidence for a single colonization of the Caribbean from mainland South America in the Oligocene or early Miocene, followed by a radiation throughout the Greater Antilles and Bahamas. These findings support the previous suggestion that Epicrates sensu lato Wagler is paraphyletic with respect to the anacondas (Eunectes Wagler), and hence we restrict Epicrates to the mainland clade and use the available name Chilabothrus Duméril and Bibron for the West Indian clade. Our results suggest some diversification occurred within island banks, though most species divergence events seem to have occurred in allopatry. We also find evidence for a remarkable diversification within the Bahamian archipelago suggesting that the recognition of another Bahamian endemic species C. strigilatus is warranted.
reynolds-biblio
Tigerpython
Ordnung: Schuppenkriechtiere (SQUAMATA)
Unterordnung: Schlangen (SERPENTES)
Überfamilie: Wühl- und Riesenschlangenartige (Booidea / Pythonoidea)
Familie: Pythons (Pythonidae)

Tigerpython
Python molurus / bivittatus • The Asiatic Rock Python • Le python molure
- Körperbau und Körperfunktionen
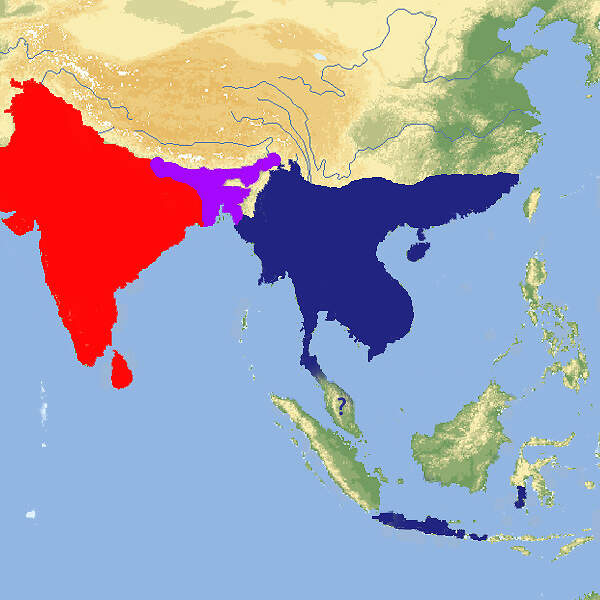
- Verbreitung
- Lebensraum und Lebensweise
- Gefährdung und Schutz
- Bedeutung für den Menschen
- Haltung
- Taxonomie und Nomenklatur
- Literatur und Internetquellen
|
Weitere Bilder auf BioLib.cz |
Tigerpythons sind mit bis zu 7 m Länge wahre Riesen und gehören zu den Prototypen der Würgeschlangen, die selbst mittelgroße Hirsche töten und verschlingen können. Sie werden sehr häufig im Zoo gezeigt Körperbau und KörperfunktionenDie meisten Tiere werden nicht länger als 3.7 m, es gibt jedoch zuverlässige Belege über 6 m lange und Berichte über gegen 8 m lange Individuen. Der Kopf ist ziemlich klein, dreieckig und deutlich vom Hals abgesetzt, der Körper relativ plump, der Schwanz mäßig lang und greiffähig. Das Auge ist mäßig groß und hat eine Schlitzpupille. Grubenorgane zur Ortung von Wärmeunterschieden finden sich nur an den ersten beiden oberen Labialschuppen. Es sind Analsporen vorhanden. Die Grundfärbung ist weißlich bis hellbraun. Sie wird bis auf ein Gittermuster überlagert von hell- oder dunkelbraunen, oft schwärzlich gesäumten Flecken. Auf dem Kopf befindet sich ein Y-förmiger Fleck [3; 5; 6; 8]. VerbreitungSüd- und Südostasien: Bangladesch, Burma, Südchina, Hongkong, Indien, Indonesien (fehlt auf Sumatra und Borneo, kommt in Java, Bali, Sulawesi und den kleinen Sundainseln Lombok und Sumbawa vor), Kambodscha, Laos, Malaysia, Nepal, Pakistan, Sri Lanka, Thailand, Vietnam: Bei den Vorkommen in Indonesien stellt sich Frage, ob es sich um Reliktbestände handelt, oder ob die Populationen auf vom Menschen verschleppte Tiere zurückgehen [1; 9; 10]. Lebensraum und LebensweiseDer tag- wie nachtaktive Tigerpython besiedelt unterschiedliche Lebensräume wie Grasland, Sümpfe, Flussauen, Wälder und felsiges Gelände, aber stets in Wassernähe. Das Nahrungsspektrum umfasst größere Säugetiere (z.B. Hirsche], Vögel sowie Reptilien und Amphibien. Wie alle Arten seiner Familie ist der Tigerpython eierlegend. Die aus 20-50 und bis zu 100 Eiern Gefährdung und SchutzNach einer Beurteilung aus dem Jahr 1996 wurde der Tigerpython als Art molurus als potenziell gefährdet (Rote Liste: NEAR THREATENED) eingestuft. Dies wurde 2019 überprüft und bestätigt. bivittatus, 2009 als eigene Art beschrieben, gilt aufgrund einer Beurteilung aus dem Jahr 2011 als gefährdet (VULNERABLE) [9]. Der internationale Handel mit Exemplaren der Nominatform ist nach CITES Anhang I eingeschränkt, jener mit Exemplaren der Unterart bivittatus ist nach Anhang II geregelt. Bedeutung für den MenschenÜber den Tigerpython gibt es aus dem Altertum phantasievolle Berichte. So soll der seleukidische Diplomat MEGASTHENES (360-290 v. Chr.), der Gesandter am Königskof des indischen Maurya-Reichs war, geschrieben haben, in Indien würden die Schlangen so groß, dass sie Hirsche und Ochsen ganz verschlingen könnten [2]. Von dieser Mär stammt übrigens der Name "Boa", denn Rind heißt auf Altgriechisch "βοῦς". Faktisch machen sich Tigerpythons bestenfalls dadurch unbeliebt, dass sie gelegentlich in Stallungen eindringen und Hühner oder Schweine erbeuten [6]. Die Art befindet sich im Reptilleder- und Heimtierhandel. Von 2001-2016 meldete Vietnam die Ausfuhr von 15'006, Malaysia jene von 3 Wildfängen von P. m. bivittatus. Im selben Zeitraum wurde von den südostasiatischen Ländern die Ausfuhr von 72'289 Häuten sowie zahlreicher anderer Teile und Erzeugnisse gemeldet. P. m. molurus wurden weder lebend noch tot mit CITES-Dokumenten aus den Ursprungsländenr ausgeführt. Ebenfalls von 2001-2016 wurden weltweit 92 Nachzuchttiere von P. m. molurus und 140'785 von P. m. bivittatus international verschoben. Wichtigste Ausfuhrländer waren Vietnam mit über 110'000 und Tschechien mit über 26'000 Tieren [4]. HaltungDer Tigerpython gehört zu den "Gefahrtieren", deren Haltung in manchen deutschen Bundesländern unter sicherheitspolizeilichen Aspekten eingeschränkt oder geregelt ist. Die Deutsche Gesellschaft für Herpetologie und Terrarienkunde (DGHT) und der Verband Deutscher Verein für Aquarien- und Terrarienkunde (DVA) haben zu dieser Thematik einen Leitfaden herausgegeben [12]. Für die Haltung wird ein sehr geräumiges, beheiztes, mit UV-Lampen ausgestattetes Feuchtterrarium mit fest eingebautem Wasserbecken empfohlen, das ein Drittel bis die Hälfte der Grundfläche einnehmen soll. Ein Kletterbaum ist nicht unbedingt erforderlich. Als Bodensubstrat eignen sich z.B. Torf oder Rindenmulch. Die Lufttemperatur soll tagsüber 24-30ºC betragen, nachts etwa 6ºC weniger. Die Wassertemperatur soll bei 22-28ºC liegen. Eine angemessene Temperatur wird durch eine teilweise unter dem Badebecken befindliche Bodenheizung in Kombination mit Wärmelampen erreicht. Die Beleuchtung soll 12-14 Stunden in Betrieb sein [5; 6; 9]. Von dem etwas größeren bivittatus werden häufig Albinos und andere Farbmutationen gehalten. Die sogenannten "Golden Thai Pythons" gehen alle auf ein einziges Männchen zurück, das 1979 in Nordost-Thailand gefunden wurde und im Pata-Zoo in Bangkok, der sich im 6./7. Stock des Pata-Kaufhauses befindet, mit einem normalfarbigen und einem ebenfalls teilalbinotischen Weibchen verpaart wurde. Die Nachzucht wurde anfänglich zu Phantasiepreisen von 5'000 USD / Stück gehandelt [11]. In den USA, wo die private Wildtierhaltung wenig reguliert ist, wurden Tigerpythons in Florida von überforderten Haltern freigelassen und haben in den Everglades und anderswo auf dem Festland, auf den Florida Keys und auf Puerto Rico umfangreiche Populationen gebildet, die mittlerweile bekämpft werden [9]. Haltung in europäischen Zoos: Wildfarbene Tigerpythons werden in etwa 290 Institutionen gezeigt, von denen sich etwa 50 im deutschsprachigen Raum befinden. Mit Abstand am häufigsten zu sehen ist der Dunkle Tigerpython (Python (molurus) bivittatus). Etwa 80 Zoos halten nur oder zusätzlich Farbmutanten. Für Details siehe Zootierliste. Mindestanforderungen an Gehege: Nach Reptiliengutachten 1997 des BMELF soll ein Terrarium für zwei über 2.5 m lange Tiere mindestens 0.75x so lang und 0.5x so breit sein wie die Gesamtlänge eines Tieres. Die Höhe soll die Hälfte der Gesamtlänge betragen. Für jedes weitere Tier ist das Terrarienvolumen unter Beibehaltung der Proportionen um 20% zu erhöhen.Die Schweizerische Tierschutzverordnung (Stand 01.06.2022) schreibt für 1-2 Tiere ein Gehege vor, dessen Grundfläche dem 1.0x0.5-fachen und dessen Höhe dem 0.75-fachen der Gesamtlänge eines Tiers entsprechen. Die 2. Tierhaltungsverordnung Österreichs (Stand 2023) verlangt für 1-2 erwachsene Tiere eine Grundfläche von 2 m² bei einer Höhe von 180 cm. Für jedes weitere Adulttier ist die Grundfläche um 0.8 m² zu erhöhen. Taxonomie und NomenklaturDer Tigerpython wurde 1758 von Carl von LINNÉ als "Coluber molurus" beschrieben. Der Name Python molurus geht auf John Edward GRAY (1842)von der Londoner zoologischen Gesellschaft zurück. In der Regel werden zwei Unterarten (bzw. seit 2009 zwei Arten) anerkannt: Python molurus molurus aus dem vorderindischen und Python molurus bivittatus aus dem hinterindischen Raum. Eine dritte Unterart (pimbura ) wurde aus Sri Lanka beschrieben, aber die Unterschiede zu molurus wurden schon bald einmal als nicht ausreichend betrachtet, um eine Unterart zu rechtfertigen. Der Tigerpython ist nahe mit dem Afrikanischen Felsenpython (Python sebae) verwandt [1; 5; 10]. |
Literatur und Internetquellen
- BELLOSA, H., DIRKSEN, L. & AULIYA M. (2007)
- BREHM, A. E. (1882-1887)
- CITES IDENTIFICATION MANUAL
- CITES TRADE DATA BASE
- MATTISON, C. (2007)
- MEHRTENS, J. M. (1993)
- NIETZKE, G. (1969)
- O'SHEA, M. & HALLIDAY, T. (2002)
- STUART, B., NGUYEN, T.Q.et al. (2012). Python bivittatus. The IUCN Red List of Threatened Species 2012: e.T193451A2237271. http://www.iucnredlist.org/details/193451/0. Downloaded on 14 October 2017 und
AENGALS, A., DAS, A., MOHAPATRA, P. et al. 2021. Python molurus. The IUCN Red List of Threatened Species (2021): e.T58894358A1945283. https://dx.doi.org/10.2305/IUCN.UK.2021-2.RLTS.T58894358A1945283.en. Accessed on 23 July 2023. - THE REPTILE DATA BASE (P. bivittatus)
- TRUTNAU, L. (2002)
- DGHT/DVA (Hrsg. 2014)
Zurück zu Übersicht Schlangen
Weiter zu Königspython (Python regius)