PAGEL, T. (1985)
Loris - Freileben, Haltung und Zucht der Pinselzungenpapageien.
2., überarbeitete Auflage 1998. 240 S., 86 Farbfotos, 8 s/w-Fotos, 25 Zeichn., 13 Verbreit.-Karten, geb.
Verlag Eugen Ulmer, Stuttgart, ISBN 978-3-8001-7352-5.
Buchbeschreibung:
Loris gehören zu den farbenprächtigsten und deshalb zu den attraktivsten Papageien. Die Lori-Pflege setzt nicht nur Fachwissen voraus, sondern auch die Kenntnis und Beachtung mancherlei gesetzlicher Bestimmungen, die zum Schutz der bedrohten Tierwelt erlassen wurden. Das Buch beschreibt ausführlich die Lebensweise und das Verhalten der Loris und beantwortet alle Fragen zur Haltung, Brut und Zucht der einzelnen Arten dieser Papageiengruppe. Zahlreiche Farbfotos, Zeichnungen und Verbreitungskarten vervollständigen das Buch.
pagel-biblio
LANTERMANN, W. (2007)
Amazonenpapageien - Biologie, Gefährdung, Haltung, Arten.
236 Seiten, Farbtafeln, s/w-Abbildungen, Verbreitungskarten.
Filander-Verlag. ISBN-13: 978-3930831661
Anbietertext:
Amazonenpapageien gehören zu den Charaktervögel Süd-und Mittelamerikas und sind in 31 Arten von Mexiko bis Argentinien, von Ekuador bis zu den karibischen Inseln verbreitet. Sie gehören zu den bedrohtesten Vogelgruppen der Welt, einige Arten der Karibischen Inseln befinden sich in stetiger Gefahr der Ausrottung. Der Verfasser geht aus jahrelanger eigener Praxis neben einer ausführlichen Einführung in die Biologie, Ökologie, Ethologie und den Status von Amazonen auch ausführlich auf die artgemäße Pflege und Erhaltungszucht ein
lantermann-biblio
Kleiner Soldatenara
Ordnung: Papageienvögel (PSITTACIFORMES)
Familie: Echte Papageien (Psittacidae)
Unterfamilie: Eigentliche Papageien (Psittacinae)
Tribus: Neuweltpapageien (Arini)

 Zootier des Jahres 2023
Zootier des Jahres 2023
Kleiner Soldatenara
Ara militaris • The Military Macaw • L'ara militaire
- Körperbau und Körperfunktionen
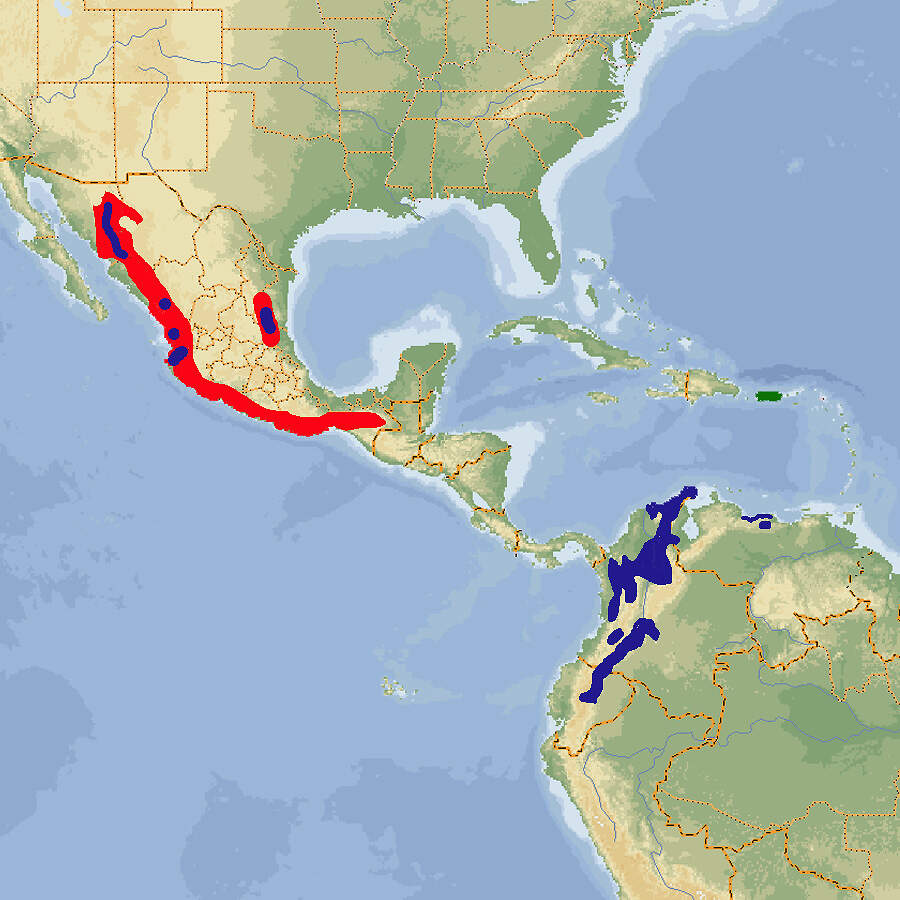
- Verbreitung
- Lebensraum und Lebensweise
- Gefährdung und Schutz
- Bedeutung für den Menschen
- Haltung
- Taxonomie und Nomenklatur
- Literatur und Internetquellen
|
Weitere Bilder auf BioLib.czStimme auf XENO-CANTO |
Der Kleine Soldatenara ist eine gefährdete Art, um deren ex situ-Erhaltung sich die Zoos mittels eines europäischen Zuchtbuchs bemühen. In europäischen Tiergärten wird er häufig gehalten. Körperbau und KörperfunktionenDer Kleine Soldatenara erreicht eine Gesamtlänge von 70 cm und ein Gewicht von ca. 970-1'130 g. Er ist also deutlich kleiner als Ara ambiguus. Die Grundfarbe des Gefieders ist grün mit olivem Anflug auf Rücken und Flügeln. Der Kopf ist heller mit bläulichem Schimmer am Hinterkopf. Die Stirn ist rot, die nackte Wangenhaut hell fleischfarben mit Fluren von schwärzlich grünen Federchen. Der Schnabel ist grau-schwarz, die Iris hellgelb und die Füße sind schwarzbraun. Der Kehlfleck ist bräunlich. Die großen Flügeldecken, der Hinterrücken und die Oberschwanzdecken sowie die Außenfahnen der Handschwingen sind blau. Die Schwanzfedern sind oberseits rötlich-braun mit blauen Enden, die Unterseite von Schwanz- und Schwungfedern ist gelb-oliv. Bei Jungvögeln ist die Iris braun [2; 4; 5; 6; 8]. VerbreitungSüdamerika und Mexiko: Argentinien, Bolivien, Ekuador, Kolumbien, Mexiko, Peru, Venezuela [1]. Lebensraum und LebensweiseIn Südamerika besiedelt der Kleine Soldatenara feuchte Tieflandwälder und anschließende offene Gebiete, in Mexiko trockene und halbtrockene offene Wälder, Kiefern-Eichenwälder, feuchte Tieflandwälder und Galeriewälder. Saisonal geht er auch in Dornbusch. Ferner nutzt er Agrarland, Kaffeepflanzungen und Obstgärten. Die Höhenverbreitung reicht vom Meeresspiegel bis auf 3'600 m. Er ernährt sich von verschiedenen Famen, Früchten - vorzugsweise Feigen - und Beeren. Geschlafen und genistet wird in Felswänden oder großen Bäumen. Die Gelege bestehen aus 2-3 Eiern, die während 25-27 Tagen bebrütet werden, die Nestlingszeit dauert 77-98 Tage [1; 7; 8]. Gefährdung und SchutzWegen Lebensraumverlust und Fang für den Tierhandel nehmen die Bestände des Kleinen Soldatenaras seit Jahren ab und werden mittlerweile auf nur noch 2'000-7'000 erwachsene Individuen geschätzt. Er ist deshalb seit 1994, letztmals überprüft 2020, als gefährdet (Rote Liste: VULNERABLE) eingestuft [1]. Der internationale Handel ist seit 1987 nach CITES-Anhang I eingeschränkt. Zoogestütztes Artenschutzprojekt (Beispiel):
Bedeutung für den MenschenVon 2001-2020 wurde als einzigem Ursprungsland aus Mexiko die Ausfuhr von 9 Wildfängen nebst wenig Wissenschaftsmaterial erfasst. Im selben Zeitraum wurden weltweit 1023 Nachzuchtvögel international verschoben. Die meisten davon (350) wurden in Südafrika gezüchtet, gefolgt von den Niederlanden mit 151 Ausfuhren [3]. Haltung1963 glückte dem Wellington Zoo in Neuseeland die Welterstzucht, 1964 dem Fort Woth Zoo die nordamerikanische und 1974 dem Tierpark Berlin die europäische Erstzucht. Bei der Vergesellschaftung mit anderen Ara-Arten kann es leicht zu Mischlingszuchten kommen [7; 8]. Das Höchstalter in Menschenobhut wird mit 54 Jahren und 5 Monaten angegeben [10]. Haltung in europäischen Zoos: Die Art wird in etwa 130 Zoos gezeigt, von denen sich über ein Dutzend im deutschsprachigen Raum befinden. Für Details siehe Zootierliste. Für die Unterart Ara militaris mexicana gibt es ein Europäisches Zuchtbuch (ESB), das am Antwerpener Zoo geführt wird. Mindestanforderungen an Gehege: Nach Papageiengutachten des BMELF von 1995 ist für die Haltung eines Paars oder ausnahmsweise eines Einzelvogels eine Voliere mit einer Fläche von 4 x 2 m und einer Höhe von 2 m erforderlich, ferner ein Schutzraum mit einer Grundfläche von 2 m². Für jedes weitere Paar sind die Grundflächen um 50% zu erweitern. Nach Schweizerischer Tierschutzverordnung (Stand 01.06.2022) sind Aras mindestens paarweise zu halten. Für ein Paar ist eine bei Bedarf unterteilbare Innenvoliere mit Badegelegenheit, einer Grundfläche von 10 m² und einem Volumen von 30 m³ vorgeschrieben, für jedes weitere Tier ist die Grundfläche um 1 m² zu erweitern. Ein Aussengehege ist fakultativ. Ist dieses vorhanden und permanent zugänglich, so können dessen Maße ans Innengehege angerechnet werden, wobei maximal ein Drittel des Innengeheges durch das Außengehege ersetzt werden kann. Die 2. Tierhaltungsverordnung Österreichs (Stand 2023) schreibt für die Haltung eines Paars oder ausnahmsweise eines Einzelvogels eine Voliere mit einer Grundfläche von 4 x 2 m Fläche und einer Höhe von 3 m sowie einen Schutzraum von 2 m² / 2 m Höhe mit einer Mindesttemperatur von 10°C vor. Je weiteres Paar sind die Flächen um 50% zu erweitern. Taxonomie und NomenklaturDer Kleine Soldatenara wurde 1766 von Carl von LINNÉ als "Psittacus militaris" erstmals wissenschaftlich beschrieben und wurde später in die 1799 vom französischen Naturforscher Graf Bernard-Germain-Étienne de LACÉPÈDE eingeführte Gattung Ara gestellt. Es sind drei Unterarten anerkannt: A. m. bolivianus, A. m. mexicanus, A. m. militaris [5]. |
Literatur und Internetquellen
- BIRDLIFE INTERNATIONAL (2020). Ara militaris. The IUCN Red List of Threatened Species 2020: e.T22685548A179407584. https://dx.doi.org/10.2305/IUCN.UK.2020-3.RLTS.T22685548A179407584.en. Downloaded on 18 December 2020.
- CITES IDENTIFICATION MANUAL
- CITES TRADE DATA BASE
- DE GRAHL, W. (1979/82)
- DEL HOYO, J., ELLIOTT, A. et al. (eds., 1992-2013)
- FORSHAW, J. M. & COOPER, W. T. (1981)
- GRUMMT, W. & STREHLOW, H. (2009)
- LANTERMANN, W. (1984)
- LEPPERHOFF, L. (2004)
- YOUNG, A. M., HOBSON, E. A., BINGAMAN LACKEY, L. & WRIGHT, T. F. (2012)
Zurück zu Übersicht Papageienvögel
Weiter zu Rotohrara (Ara rubrogenys)
Gelbbrustara
Ordnung: Papageienvögel (PSITTACIFORMES)
Familie: Echte Papageien (Psittacidae)
Unterfamilie: Eigentliche Papageien (Psittacinae)
Tribus: Neuweltpapageien (Arini)

Gelbbrustara
Ara ararauna • The Blue-and-yellow Macaw • L'ara bleu et jaune
- Körperbau und Körperfunktionen
- Verbreitung
- Lebensraum und Lebensweise
- Gefährdung und Schutz
- Bedeutung für den Menschen
- Haltung
- Taxonomie und Nomenklatur
- Literatur und Internetquellen
|
Weitere Bilder auf BioLib.czStimme auf XENO-CANTO |
Der selbst nicht gefährdete Gelbbrustara ist ein plakativ gefärbter Großpapagei, der beim Zoopublikum große Beachtung findet. Er eignet sich daher bestens als Botschafter für Natur- und Artenschutz in seinen südamerikanischen Heimatländern. Er wird aus diesem Grund und weil Zoos öfter in die Lage kommen, aus Tierschutzgründen Vögel aus Privathaltungen zu übernehmen, außerordentlich häufig in europäischen Zoos gehalten. Körperbau und KörperfunktionenDer Gelbbrustara wird 86 cm lang und erreicht ein Gewicht von 1'040-1'286 Gramm. Das Gefieder der Körperoberseite ist hellblau, die Unterseite ist gelb, die Stirn grün und die Kehle schwarz. Der unbefiederte Wangenbereich ist weiß mit schwarzen Federfluren, der Schnabel ist schwarz-grau, die Iris hellgelb und die Füße sind dunkelgrau mit schwarzen Krallen. Bei Jungvögeln ist die Iris dunkel und der Schnabel während der ersten zwei Wochen hell [2; 4; 5; 6; 9; 10]. VerbreitungSüdamerika: Bolivien, Brasilien, Ekuador, Französisch Guiana, Guyana, Panama, Paraguay, Peru, Surinam, Venezuela [1]. Lebensraum und LebensweiseGelbbrustaras bewohnen Galeriewälder und sumpfige Palmenhaine. Zwischen ihren Schlaf- und Futterplätzen können Distanzen von bis zu 25 km liegen. Bevorzugtes Futter sind die Früchte verschiedener Palmen (Mauritia, Oreodoxa, Astrocaryum, Bactris und Maximilianea). Sie sind stets paarweise anzutreffen. Auch wenn sie sich außerhalb der Brutzeit zu größeren Trupps zusammenfinden, ist der Zusammenhalt der Paare deutlich zu erkennen. Die Brutzeit beginnt zwischen Februar und April. Das Nest befindet sich in natürlichen Baumhöhlen abgestorbener Palmen. Es werden 2-4 Eier gelegt, die 25-28 Tage bebrütet werden. Die Nestlingszeit beträgt rund 90-95 Tage und mit 6-9 Monaten werden die Jungvögel selbständig [5; 9; 10]. Gefährdung und SchutzDer Gelbbrustara hat ein sehr großes Verbreitungsgebiet und die Gesamtpopulation ist, trotz rückläufigem Trend, immer noch sehr groß. Er wurde deshalb letztmals 2018 als nicht-gefährdet eingestuft (Rote Liste: LEAST CONCERN) [1]. Der internationale Handel ist nach CITES-Anhang II geregelt. Bedeutung für den MenschenAraraunas werden zur Gewinnung von Fleisch gejagt und für den nationalen und internationalen Heimtierhandel gefangen. Die Ursprungsländer registrierten von 2001-2018 Ausfuhren von 24'848 lebenden Wildfängen, wovon 13'997 aus Guyana, 9'424 aus Surinam kamen. Im selben Zeitraum wurden weltweit Exporte von 64'792 Nachzuchtvögeln erfasst, von denen 55'790 aus Südafrika stammten [1; 3]. HaltungDer Gelbbrustara ist wohl die weltweit am häufigsten gezüchtete Ara-Art. Aus Frankreich sind erfolgreiche Nachzuchten bereits aus den Jahren 1833 und 1892 dokumentiert. In Deutschland wurden Gelbbrustaras 1934 im Grugapark, Essen, gezüchtet. Das Höchstalter in menschlicher Obhut wird mit 48 Jahren und 6 Monaten angegeben [7; 9; 11]. Haltung in europäischen Zoos: Die Art wird in über 500 Zoos gezeigt, von denen sich etwa ein Viertel im deutschsprachigen Raum befinden. Für Details siehe Zootierliste. Forschung im Zoo: Über das Lernverhalten des Gelbbrustaras wurde am Zoo Hannover eine Bachelorarbeit durchgeführt [8]. Mindestanforderungen an Gehege: Nach Papageiengutachten des BMELF von 1995 ist für die Haltung eines Paars oder ausnahmsweise eines Einzelvogels eine Voliere mit einer Fläche von 4 x 2 m und einer Höhe von 2 m erforderlich, ferner ein Schutzraum mit einer Grundfläche von 2 m². Für jedes weitere Paar sind die Grundflächen um 50% zu erweitern. Nach Schweizerischer Tierschutzverordnung (Stand 1.2.2022) sind Aras mindestens paarweise zu halten. Für ein Paar ist eine bei Bedarf unterteilbare Innenvoliere mit Badegelegenheit, einer Grundfläche von 10 m² und einem Volumen von 30 m³ vorgeschrieben, für jedes weitere Tier ist die Grundfläche um 1 m² zu erweitern. Ein Aussengehege ist fakultativ. Ist dieses vorhanden und permanent zugänglich, so können dessen Maße ans Innengehege angerechnet werden, wobei maximal ein Drittel des Innengeheges durch das Außengehege ersetzt werden kann. Die 2. Tierhaltungsverordnung Österreichs (Stand 2022) schreibt für die Haltung eines Paars oder ausnahmsweise eines Einzelvogels eine Voliere mit einer Grundfläche von 4 x 2 m Fläche und einer Höhe von 3 m sowie einen Schutzraum von 2 m² / 2 m Höhe mit einer Mindesttemperatur von 10°C vor. Je weiteres Paar sind die Flächen um 50% zu erweitern. Taxonomie und NomenklaturDer Gelbbrustara wurde 1758 von Carl von LINNÉ als "Psittacus Ararauna" erstmals wissenschaftlich beschrieben. Die heute gültige Gattungsbezeichnung Ara wurde 1799 vom französischen Naturforscher Graf Bernard-Germain-Étienne de LACÉPÈDE eingeführt. Es gibt keine Unterarten [5]. |
Literatur und Internetquellen
- BIRDLIFE INTERNATIONAL (2018). Ara ararauna. The IUCN Red List of Threatened Species 2018: e.T22685539A131917270. http://dx.doi.org/10.2305/IUCN.UK.2018-2.RLTS.T22685539A131917270.en . Downloaded on 04 August 2019.
- CITES IDENTIFICATION MANUAL
- CITES TRADE DATA BASE
- DE GRAHL, W. (1979/82)
- DEL HOYO, J., ELLIOTT, A. et al. (eds., 1992-2013)
- FORSHAW, J. M. & COOPER, W. T. (1981)
- GRUMMT, W. & STREHLOW, H. (2009)
- HEISE, L. (2015)
- LANTERMANN, W. (1984)
- LEPPERHOFF, R. (2004)
- YOUNG, A. M., HOBSON, E. A., BINGAMAN LACKEY, L. & WRIGHT, T. F. (2012)
Zurück zu Übersicht Papageienvögel
Weiter zu Grünflügelara (Ara chloropterus)
Grünflügelara
Ordnung: Papageienvögel (Psittaciformes)
Familie: Echte Papageien (Psittacidae)
Unterfamilie: Eigentliche Papageien (Psittacinae)
Tribus: Neuweltpapageien (Arini)

Grünflügelara, Dunkelroter Ara
Ara chloropterus (A. chloroptera) • The Red-and-green Macaw • L'ara à ailes vertes
- Körperbau und Körperfunktionen
- Verbreitung
- Lebensraum und Lebensweise
- Gefährdung und Schutz
- Bedeutung für den Menschen
- Haltung
- Taxonomie und Nomenklatur
- Literatur und Internetquellen
|
Weitere Bilder auf BioLib.czStimme auf XENO-CANTO |
Der selbst nicht gefährdete Grünflügelara ist ein plakativ gefärbter Großpapagei, der beim Zoopublikum große Beachtung findet. Er eignet sich daher bestens als Botschafter für Natur- und Artenschutz in seinen südamerikanischen Heimatländern. Er wird aus diesem Grund und weil Zoos öfter in die Lage kommen, aus Tierschutzgründen Vögel aus Privathaltungen zu übernehmen, sehr häufig in europäischen Zoos gehalten. Körperbau und KörperfunktionenDer Grünflügelara ist mit 90 und mehr cm Gesamtlänge und einem Gewicht von etwa 1'050-1'700 g etwas größer als der Hellrote Ara. Die Grundfarbe seines Gefieders ist ein dunkleres Rot als bei jenem und die mittleren Flügeldecken sind grün anstatt gelb. Schnabel, Iris und Füße sind bei beiden Arten ähnlich gefärbt: der Oberschnabel zum größeren Teil hornfarben, der Unterschnabel grauschwarz, die Iris hellgelb und die Füße dunkelgrau. Der nackte Wangenbereich ist weiß mit roten Federfluren. Die großen Flügeldecken, die äußeren Armschwingen, die Außenfahnen der Handschwingen und die Schwanzspitzen sind blau [2; 4; 7; 8]. VerbreitungSüdamerika: Argentinien, Bolivien, Brasilien, Ekuador, Französisch Guiana, Guyana, Kolumbien, Panama, Paraguay, Peru, Surinam, Venezuela [1]. Lebensraum und LebensweiseDer Grünflügelara bewohnt hauptsächlich tropische Wälder unterschiedlichen Typs des Tieflandes, sowie Savannen einschließlich des Cerrado. Im Gebirge findet man ihn kaum noch in Höhenlagen über 1'500 m. Er nistet in Baum- oder Felshöhlen, nur selten in Palmenstämmen. Es werden 1-4 Eier gelegt, die 25-28 (24-29) Tage bebrütet werden. Die Nestlingszeit beträgt rund 90-103 Tage und mit 6-9 Monaten werden die Jungvögel selbständig [4; 6; 7; 8]. Gefährdung und SchutzDie Bestände des Grünflügelaras nehmen zwar etwas ab, das Verbreitungsgebiet ist aber so groß, dass die Art letztmals 2016 nicht als gefährdet taxiert wurde (Rote Liste: LEAST CONCERN) [1]. Der internationale Handel ist nach CITES-Anhang II geregelt. Bedeutung für den MenschenGrünflügelaras werden zur Gewinnung von Fleisch gejagt und für den nationalen und internationalen Heimtierhandel gefangen. Die Ursprungsländer registrierten von 2001-2018 Ausfuhren von 21'817 lebenden Wildfängen, wovon 17'711 aus Guyana, 4'091 aus Surinam kamen. Im selben Zeitraum wurden weltweit Exporte von 25'994 Nachzuchtvögeln erfasst, von denen 21'039 aus Südafrika stammten [1; 3]. HaltungVermutlich wurden die ersten Grünflügelaras bereits zu Beginn des 17. Jahrhunderts nach Europa gebracht. Die Welterstzucht gelang 1926 im San Diego Zoo, in Privathand glückte sie 1962 in England. Bei der Gemeinschaftshaltung mit anderen Ara-Arten kann es zu Bastardierungen kommen. Im Zoo Wuppertal z.B. haben ein Ararauna x Grünflügelara-Paar während 18 Jahren an die 40 Jungvögel produziert. Das Höchstalter in menschlicher Obhut wird mit gut 63 Jahren angegeben [6; 7; 9]. Haltung in europäischen Zoos: Die Art wird in rund 310 Zoos gezeigt, von denen sich etwa ein Viertel im deutschsprachigen Raum befinden. Für Details siehe Zootierliste. Mindestanforderungen an Gehege: Nach Papageiengutachten des BMELF von 1995 ist für die Haltung eines Paars oder ausnahmsweise eines Einzelvogels eine Voliere mit einer Fläche von 4 x 2 m und einer Höhe von 2 m erforderlich, ferner ein Schutzraum mit einer Grundfläche von 2 m². Für jedes weitere Paar sind die Grundflächen um 50% zu erweitern. Nach Schweizerischer Tierschutzverordnung (Stand 1.2.2022) sind Aras mindestens paarweise zu halten. Für ein Paar ist eine bei Bedarf unterteilbare Innenvoliere mit Badegelegenheit, einer Grundfläche von 10 m² und einem Volumen von 30 m³ vorgeschrieben, für jedes weitere Tier ist die Grundfläche um 1 m² zu erweitern. Ein Aussengehege ist fakultativ. Ist dieses vorhanden und permanent zugänglich, so können dessen Maße ans Innengehege angerechnet werden, wobei maximal ein Drittel des Innengeheges durch das Außengehege ersetzt werden kann. Die 2. Tierhaltungsverordnung Österreichs (Stand 2022)schreibt für die Haltung eines Paars oder ausnahmsweise eines Einzelvogels eine Voliere mit einer Grundfläche von 4 x 2 m Fläche und einer Höhe von 3 m sowie einen Schutzraum von 2 m² / 2 m Höhe mit einer Mindesttemperatur von 10°C vor. Je weiteres Paar sind die Flächen um 50% zu erweitern. Taxonomie und NomenklaturDer Grünflügelara wurde 1859 von dem britischen Zoologen George Robert GRAY als Ara chloroptera. erstmals wissenschaftlich beschrieben und hieß bis vor wenigen Jahren auch so. Nachdem in einer 2013 veröffentlichten Checkliste festgestellt wurde, dass das grammatikalische Geschlecht von Ara männlich sei, wurde der Artname auf chloropterus geändert. In der Literatur und auf Zoo-Namensschildern finden sich beide Bezeichnungen. Es gibt keine Unterarten [4; 5]. |
Literatur und Internetquellen
- BIRDLIFE INTERNATIONAL (2016). Ara chloropterus. The IUCN Red List of Threatened Species 2016: e.T22685566A93080287. http://dx.doi.org/10.2305/IUCN.UK.2016-3.RLTS.T22685566A93080287.en . Downloaded on 04 August 2019.
- CITES IDENTIFICATION MANUAL
- CITES TRADE DATA BASE
- DEL HOYO, J., ELLIOTT, A. et al. (eds., 1992-2013)
- DEL HOYO, J., COLLAR, N., CHRISTIE, D.A., ELLIOTT, A. & FISHPOOL L.D.C. (2014)
- GRUMMT, W. & STREHLOW, H. (2009)
- LANTERMANN, W. (1984)
- LEPPERHOFF, R. (2004)
- YOUNG, A. M., HOBSON, E. A., BINGAMAN LACKEY, L. & WRIGHT, T. F. (2012)
Zurück zu Übersicht Papageienvögel
Weiter zu Blaulatzara (Ara glaucogularis)
WRIGHT, T. F., SCHIRTZINGER, E. E. et al. (2008)
WRIGHT, T. F., SCHIRTZINGER, E. E., MATSUMOTO, T., EBERHARD, J. R., GRAVES, G. R., SANCHEZ, J. J., CAPELLI, S., MÜLLER, H., SCHARPEGGE, J. & CHAMBERS, G. K. (2008)
A Multilocus Molecular Phylogeny of the Parrots (Psittaciformes): Support for a Gondwanan Origin during the Cretaceous.
Mol. Biol. Evol. 25 (10): 2141-2156. (Published: 24 July 2008)
DOI: https://doi.org/10.1093/molbev/msn160
Abstract:
The question of when modern birds (Neornithes) first diversified has generated much debate among avian systematists. Fossil evidence generally supports a Tertiary diversification, whereas estimates based on molecular dating favor an earlier diversification in the Cretaceous period. In this study, we used an alternate approach, the inference of historical biogeographic patterns, to test the hypothesis that the initial radiation of the Order Psittaciformes (the parrots and cockatoos) originated on the Gondwana supercontinent during the Cretaceous. We utilized broad taxonomic sampling (representatives of 69 of the 82 extant genera and 8 outgroup taxa) and multilocus molecular character sampling (3,941 bp from mitochondrial DNA (mtDNA) genes cytochrome oxidase I and NADH dehydrogenase 2 and nuclear introns of rhodopsin intron 1, tropomyosin alpha-subunit intron 5, and transforming growth factor ß-2) to generate phylogenetic hypotheses for the Psittaciformes. Analyses of the combined character partitions using maximum parsimony, maximum likelihood, and Bayesian criteria produced well-resolved and topologically similar trees in which the New Zealand taxa Strigops and Nestor (Psittacidae) were sister to all other psittaciforms and the cockatoo clade (Cacatuidae) was sister to a clade containing all remaining parrots (Psittacidae). Within this large clade of Psittacidae, some traditionally recognized tribes and subfamilies were monophyletic (e.g., Arini, Psittacini, and Loriinae), whereas several others were polyphyletic (e.g., Cyclopsittacini, Platycercini, Psittaculini, and Psittacinae). Ancestral area reconstructions using our Bayesian phylogenetic hypothesis and current distributions of genera supported the hypothesis of an Australasian origin for the Psittaciformes. Separate analyses of the timing of parrot diversification constructed with both Bayesian relaxed-clock and penalized likelihood approaches showed better agreement between geologic and diversification events in the chronograms based on a Cretaceous dating of the basal split within parrots than the chronograms based on a Tertiary dating of this split, although these data are more equivocal. Taken together, our results support a Cretaceous origin of Psittaciformes in Gondwana after the separation of Africa and the India/Madagascar block with subsequent diversification through both vicariance and dispersal. These well-resolved molecular phylogenies will be of value for comparative studies of behavior, ecology, and life history in parrots.
REINSCHMIDT, M. (2006)
Untersuchungen zur Brutbiologie des Inkakakadus (Cacatua leadbeateri ) im Loro Parque, Teneriffa.
Investigation of the Breeding Biology of the Major Mitchell´s Cockatoo (Cacatua leadbeateri) at Loro Parque, Tenerife.
Dr. biol. anim. Dissertation
317 Seiten
Justus-Liebig-Universität Gießen, Klinik für Vögel, Reptilien, Amphibien und Fische, Fachbereich Veterinärmedizin
Leitung: Prof. Dr. E. F. Kaleta
Loro Parque, Teneriffa, Spanien
Zusammenfassung:
Der Schwerpunkt der vorliegenden Arbeit liegt in den Untersuchungen zur Brutbiologie des Inkakakadus (Cacatua leadbeateri ) in der Loro Parque Fundación, Teneriffa. Dabei stehen mehrere Hauptthemen im Mittelpunkt des Interesses:
1. Studien an acht Zuchtpaaren
2. Morphometrische Untersuchungen an Bruteiern (n = 88)
3. Morphometrische Untersuchungen an Jungtieren (n = 54)
4. Fotografische Dokumentation der Jugendentwicklung (am Beispiel eines Jungvogels)
5. Beobachtungen in der Nisthöhle mit einem Videoüberwachungssystem: Brutgeschehen in sieben 24-h-Einheiten sowie das Aufzuchtverhalten in je neunzehn 24-h-Einheiten (2 Paare mit 1 bzw. 3 Jungvögeln)
Für die Arbeit stehen alle in der Zuchtstation der Loro Parque Fundación gehaltenen Inkakakadus zur Verfügung (Zeitraum 2002 bis 2005). Ziele sind es, neue Erkenntnisse zur Biologie des Paarverhaltens, der Brut und der Aufzucht des Inkakakadus zu gewinnen; vergleichende Studien Naturbrut und Aufzucht durch die Eltern bzw. Kunstbrut und Handaufzucht.
Erstmals werden 88 Eier der Inkakakadus auf ihren Legezeitpunkt, Größe, Masse, Schale, Ablageintervalle, Masseverlust, Befruchtungs- und Schlupfrate hin untersucht. Des Weiteren werden die Gelegegröße, Gelegeanzahl, der Zeitabstand zwischen den Gelegen und die Brutdauer registriert. Die Herzfrequenz von 5 Embryonen wird erstmals für den Zeitraum vom 6. bis 28. Bruttag dokumentiert. Zwischen dem 11. und dem 26. Bruttag liegt dabei die Herzfrequenz bei allen fünf Embryonen im Bereich von 250 und 280 Schlägen je Minute. Von 54 Inkakakaduküken wurde die Körpermasse nach dem Schlupf registriert, wobei das arithmetische Mittel bei 10,01 g liegt (SD 0,87 g).
Die morphometrischen Untersuchungen an den Küken beschreiben die körperliche Entwicklung der Küken quantitativ. Neben der Entwicklung der Körpermasse wird die Körper- und Gefiederentwicklung der Küken in 13 verschiedenen Maßen registriert. Dabei werden die Messungen von zwei Gruppen, die unterschiedlich aufgezogen werden, verglichen. Zum einen wird die Entwicklung vom Schlupf bis zum Flüggewerden von sieben Küken in Elternaufzucht bzw. von sieben Küken in Handaufzucht registriert und verglichen. Auf die Entwicklung der Körpermasse wurde dabei besonderes Augenmerk gelegt, da die gewonnenen Daten am einfachsten mit anderen Papageienarten vergleichbar sind. Dabei fällt auf, dass die Gruppe der von den Eltern aufgezogenen Küken zunächst schneller wächst und bereits am 40. Lebenstag die höchste durchschnittliche Körpermasse von 391,6 g erreicht. Die von Hand aufgezogenen Küken übertreffen die von den Eltern aufgezogenen Küken erstmals in ihrer mittleren Körpermasse am 44. Lebenstag und erreichen ihre höchste mittlere Körpermasse am 47. Lebenstag mit 409,9 g. Bis zum Endoskopietermin einige Wochen später zeigen die von Hand aufgezogenen Tiere stets eine höhere Körpermasse. Zum Ausfliegen hin nimmt die Gruppe der von den Eltern aufgezogenen Jungtiere 19,0 % von ihrer höchsten Körpermasse ab, die Gruppe der handaufgezogenen Jungtiere lediglich 12,3 %.
Die fotografische Dokumentation der Entwicklung belegt exemplarisch anhand von Fotos eines Jungtieres aus Elternaufzucht die Entwicklungsstufen und den Werdegang eines Kükens.
In einer Übersicht werden die Ergebnisse der endoskopischen Untersuchung der in der Loro Parque Fundación gezüchteten Inkakakadus zur Bestimmung des Geschlechts aus neun Jahren (1996– 2004) ausgewertet. Von 145 untersuchten Tieren waren 80 Männchen und 65 Weibchen.
Mit Hilfe eines Video-Überwachungssystems werden Beobachtungen während der Brutphasen sowie während der Aufzucht der Jungtiere gemacht. Dabei werden sieben Beobachtungseinheiten zu je 24 Stunden zum Brutvorgang ausgewertet. Die durchschnittliche Brutzeit beträgt somit täglich 1.298 min und 46 sec, damit ist das Gelege am Tag 141 min und 14 sec nicht bebrütet. Im Schnitt bewegen die Elterntiere die Eier 92,14 mal pro Tag, was eine durchschnittliche Kontaktzahl von 3,84/h ergibt.
In jeweils neunzehn weiteren 24-Stunden-Beobachtungseinheiten wird mit Hilfe der Intervallmethode das unterschiedliche Brutverhalten zweier Zuchtpaare verglichen, die sich in der Anzahl der Jungtiere (ein und drei Küken) unterscheiden. Neben der Beschreibung der beobachteten Verhaltensweisen wie Hudern, Körperpflege, Füttern, Jungtiere alleine und Bewachen werden diese auch quantitativ erfasst. Einzelne Verhaltensweisen ändern sich in ihrer gezeigten Häufigkeit während der Aufzuchtsphase. Folgende prozentuale Verteilungen der einzelnen Verhaltensweisen wurden registriert (erste Zahl: Ergebnis bei der Einzeltieraufzucht, Zahl in Klammer: Ergebnis der Aufzucht von drei Jungtieren). Hudern: 16,9 % (30,5 % ); Körperpflege: 11,6 % (2,2 %); Füttern: 6,3 % (7,5 %); allein im Nistkasten: 47,2 % (59,1 %); Bewachen: 17,4 % (0,7 %); Zustand des Ausgeflogen seins: 0,3 % (0,1 %). Die Summe aller Verhaltensweisen der Eltern, bei denen mindestens ein Elternteil mit dem bzw. den Jungtieren verbringt, ergibt für das Einzelküken eine direkte Kontakt- bzw. Betreuungszeit von 52,2 % der Gesamtaufzuchtszeit, hingegen weisen diese Ergebnisse für das Dreiergelege nur eine Gesamtbetreuungszeit von 40,8 % auf.
Summary
The focus of the present study is the breeding biology of the Major Mitchell´s Cockatoo (Cacatua leadbeateri ) in the Loro Parque Fundación, Tenerife. Five main subjects are the centre of interest:
1. Studies on eight breeding pairs
2. Morphometric studies of eggs (n = 88)
3. Morphometric studies of chicks (n = 54)
4. Photographic documentation of juvenile development (example of
one juvenile)
5. Observation of the nest cavities with a video monitoring system: breeding occurrences in seven 24-hour observation units, as well the rearing behaviour in 19 24-hour units (2 pairs with 1 and 3 young birds respectively).
For the study, all the Major Mitchell´s Cockatoos in the breeding centre of the Loro Parque Fundación are available (period: 2002 until 2005). The objectives are to: reach new conclusions regarding the biology of pair behaviour; the breeding and rearing of Major Mitchell’s Cockatoos; comparative studies on natural breeding and rearing by the parents versus artificial and hand-raising.
For the first time, 88 eggs of Major Mitchell’s Cockatoos are analysed concerning their time of laying in the clutch, size, mass, eggshell, deposit intervals, mass loss, fertility and hatching rate. Furthermore, the size and number of clutches, the time interval between the clutches and the breeding period are recorded. The heart rate of 5 embryos are documented for the first time during the 6th to 28th day of incubation. The heart rate of all five embryos are from 250 to 280 heart-beats per minute. The body mass of 54 Major Mitchell’s Cockatoos are recorded post-hatching, with the arithmetic mean of 10.01 g (SD 0.87 g)
The morphometric studies on the chicks describe quantitatively the corporal development of the chicks. Besides the development of body mass, the development of the body and plumage of the chicks are recorded as 13 different metrics. In doing so, the measurement of two groups being raised differently are compared. The development of seven chicks being raised by their parents and seven hand-raised chicks is recorded and compared from the time of hatching until they are fully fledged. Special attention is paid to the development of body mass given that the extracted data are simplest to compare with other parrot species. It is notable that chicks of the group being parent-raised grow faster in the first instance until reaching on day 40 (from hatching date) the highest average body mass of 391.6 g. The handraised chicks by comparison exceed the mean body mass on day 44 and reach their highest average body mass on day 47 with 409.9 g. Until the date to carry out endoscopy (for gender identification) some few weeks later, the birds which have been raised by hand always show a higher body mass. When they start to fly, the group of birds being parent-raised lose 19.0 % of the peak body mass, and the group being handraised only 12.3 %.
The photographic documentation of the development of one youngster being raised by its parents provides an example of the levels of development and the progress of this chick.
In a survey, the results of the endoscopic examination to determine the sex of Major Mitchell’s Cockatoos being bred by the Loro Parque Fundación over nine years (1996 – 2004) are evaluated. From 145 birds, 80 were males and 65 females.
With a video monitoring system, observations are made during the incubation phase and during the rearing of the chicks. Seven observation units, each of 24 hours, have been made of the incubation activities. The average incubation time per day amounts to 1,298 minutes and 46 seconds. Therefore the clutch is not incubated for 141 min and 14 sec per day. On average the parents move the eggs 92.14 times per day which results in a mean contact of 3.84 hours.
In nineteen further 24-hour-observation units, the different breeding behaviour of two breeding pairs which differ in their number of youngsters (one and three chicks) are compared by means of the interval method. In addition to the description of observed behaviour patterns, such as warming the chicks, hygiene, feeding, leaving the chicks alone and watching them, these data are also recorded quantitatively. Some behaviours change in frequency during the rearing phase. The following rates in percentage of each behaviour pattern are documented (first figure: rearing results of the single chick, second figure (in brackets): rearing result of the three chicks). Warming the chick(s): 16.9 % (30.5%), hygiene: 11.6% (2.2%); feeding: 6.3% (7.5%), chick(s) alone in the nest box: 47.2% (59,1%), watching the chicks: 17.4% (0,7%); situation of being alone: 0.3% (0.1%). The sum of all behaviour patterns of the parents, from which at least one parent spends time with the chick(s), results in a contact/attendance time for the single chick of 52.2% of the total breeding time. However, the results of the clutch with three chicks show a total contact time of only 40.8%.
reinschmidt-biblio