Buschbock
Überordnung: LAURASIATHERIA
Taxon ohne Rang: CETARTIODACTYLA
Ordnung: Paarzeher (ARTIODACTYLA)
Unterordnung: Wiederkäuer (Ruminantia)
Familie: Hornträger (Bovidae)
Unterfamilie: Echte Rinder (Bovinae)
Tribus: Afrikanische Waldböcke (Tragelaphini)

Buschbock oder Schirrantilope
Tragelaphus scriptus • The Bushbuck • Le guib harnaché
- Körperbau und Körperfunktionen
- Verbreitung
- Lebensraum und Lebensweise
- Gefährdung und Schutz
- Bedeutung für den Menschen
- Haltung
- Taxonomie und Nomenklatur
- Literatur und Internetquellen
|
Weitere Bilder auf BioLib.cz |
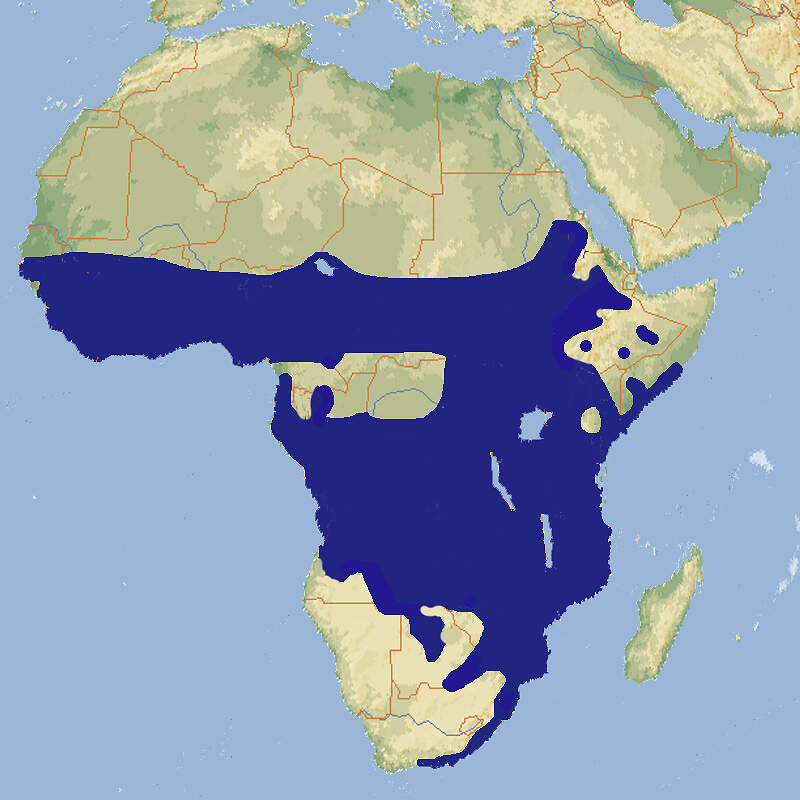
Der Buschbock ist eine kleinere, äußerst attraktive Antilope mit deutlichem Sexualdimorphismus, die sowohl für das allgemeine Publikum als auch für die Zoopädagogik interessant wäre, die aber als weit verbreitete, nicht gefährdete Art vom Europäischen Zoo- und Aquarienverband als nicht prioritör eingestuft wurde und daher in den Zoos mittlerweile ausgestorben ist. Körperbau und KörperfunktionenDer Buschbock ist der kleinste der afrikanischen Waldböcke. Er zeigt einen stark ausgeprägten Sexualdimorphismus. Die Böcke erreichen eine Kopf-Rumpflänge von 114-150 cm, eine Schulterhöhe von 80 (65-100) cm und ein Gewicht von 40-80 kg. Die Ricken werden bis 132 cm lang, 70 (61-85) cm hoch und 24-60 kg schwer. Der Schwanz wird etwa 19-24 cm lang. Wie bei den anderen afrikanischen Waldböcken haben die Böcke schraubenartig gedrehte Hörner, die 40-55 cm lang werden können. Das Fell zeigt bei beiden Geschlechtern ein auffallendes Muster weißer Punkte und Streifen, wobei es erhebliche regionale Unterschiede gibt. An der Halsunterseite verlaufen 1-2 weiße Querbänder, die Schwanzunterseite ist weiß, die Schwanzspitze kann schwarz sein. Die Beine können je nach Unterart einfarbig sein oder eine weiß oder schwarzweiße Zeichnung aufweisen. Die Grundfarbe ist regional variabel, bei den Ricken meist rotbraun, bei den Böcken etwas dunkler, kastanienbraun oder schwarzgrau [2; 5; 8]. VerbreitungAfrika südlich der Sahara: Angola, Äquatorialguinea, Äthiopien, Benin, Botswana, Burkina Faso, Burundi, Elfenbeinküste, Gabun, Gambia, Ghana, Guinea, Guinea-Bissau, Kamerun, Kenia, Kongo, Kongo Dem., Liberia, Malawi, Mali, Mauretanien, Mosambik, Namibia, Niger, Nigeria, Ruanda, Sambia, Senegal, Sierra Leone, Simbabwe, Somalia, Südafrika, Südsudan, Sudan, Swasiland, Tansania, Togo, Tschad, Uganda, Zentralafrikanische Republik [4]. Lebensraum und LebensweiseBuschböcke benötigen Lebensraum mit viel Deckung. Sie kommen in Tropischen Regen- und Feuchtwäldern, Subtropischen Feuchtwäldern, und Gemäßigten immergrünen Feuchtwäldern, jeweils vorzugsweise an Waldrändern, Galeriewäldern, Trockenwäldern, Dornsavannen, Dickichten und Zuckerrohrpflanzungen vor. Die Nahrung dieser Selektiväser besteht überwiegend aus Blättern und Zweigen, aber auch zarte Gräser werden genommen. Buschböcke leben solitär, sind aber nicht territorial, sondern haben überlappende Streifgebiete [5; 8]. Es gibt keine definierte Fortpflanzungsperiode, allenfalls saisonale Spitzen der Brunftaktivitäten und der Geburten. Nach einer Tragzeit von rund 180 Tagen wird in der Regel ein einzelnes Kitz mit einem Gewicht von 3.1-4.5 kg geboren. Angaben über das Erreichen der Geschlechtsreife sind widersprüchlich. Bei Ricken dürfte dies mit etwa 1 Jahr der Fall sein, bei Böcken mit 1.5 Jahren, wobei sie effektiv meist erst mit 3 Jahren zur Forspflanzung kommen [5; 6; 8]. Gefährdung und SchutzDer Buschbock hat eine sehr weite Verbreitung und einen geschätzten Bestand von 1 bis 1.5 Millionen Adulttieren, der als stabil angesehen wird, außer in vom Menschen dicht besiedelten Regionen. Möglicherweise ist diese Schätzung wegen der heimlichen Lebensweise des Buschbocks zu tief. Er gilt daher seit 1996 als nicht gefährdet (Rote Liste: LEAST CONCERN) , was im Rahmen einer Beurteilung aus dem Jahr 2016 bestätigt wurde. Der Klimawandel macht der Art in den trockeneren Teilen ihres Areals zu schaffen, andererseits kann sie ihre Verbreitung im Gebiet der Regenwälder ausdehnen [4]. Der internationale Handel ist nicht unter CITES geregelt. Die Einfuhr lebender Exemplare aus den Ursprungsländern ist wegen der restriktiven Veterinärbestimmungen der EU so gut wie ausgeschlossen. Bedeutung für den MenschenDer Buschbock wird zur Gewinnung von Fleisch und als Sport gejagt. In Ruanda ist sein Fleisch deutlich billiger als jenes von Nutztieren und dementsprechend ist der Buschbock die häufigste Wildtierart, die auf Fleischmärkten angeboten wird. Im Rahmen der Sportjagd werden in Südafrika "Trophy Fees" von etwa 1'200-1'500 USD fällig, in anderen afrikanischen Ländern 400-1'100 USD. HaltungIn den 1950er Jahren wurde im Zoo Basel ein Buschbock kurze Zeit gemeinsam mit Sitatungas und Vierhornantilopen gehalten, um 1990 in Hannover gemeinsam mit Kirk-Dikdiks. Eine Gemeinschaftshaltung mit Sitatungas sollte sollte wegen der Gefahr der Bastardierung tunlichts vernieden werden Als Höchstalter gibt WEIGL über 15 Jahre und 3 Monate für ein im Ruhr-Zoo Gelsenkirchen geborenes und später in Hannover gehaltenes gehaltenes weibliches Tier an [7]. Haltung in europäischen Zoos: Die Art ist dem Collection Planning der EAZA zum Opfer gefallen und wird heute nicht mehr gehalten. Die britische (europäische?) Erstzucht gelang 1841 in der Menagerie des Earl of Derby in Knowsley (heute Safaripark). Der letzte Hinweis auf eine Nachzucht in Europa im International Zoo Yearbook bezieht sich auf das Jahr 1991 (Zoo Hannover). Bei den in Europa gehaltenen Tiere handelte es sich hauptsächlich um Senegal-Buschböcke, die z.B. in Hannover 31 Jahre lang gehalten und regelmäßig gezüchtet wurden, seltener um Kap-Buschböcke. Andere Unterarten waren Ausnahmeerscheinungen. Für Details siehe Zootierliste. Mindestanforderungen an Gehege: Nach Säugetiergutachten 2014 des BMEL soll für bis zu 5 Tieren ein Gehege von mindestens 200 m² zur Verfügung stehen. Für jedes weitere Tier kommen 20 m² zur Basisfläche dazu. Zudem wird ein Stall von etwa 3 m²/Tier vorgegeben. Die Schweizerische Tierschutzverordnung (Stand 01.06.2022) schreibt für theoretisch bis zu 10 Tieren ein Gehege mit Trenn- oder Absperrmöglichkeit vor, dessen Grundfläche 500 m² misst. Für jedes weitere Tier kommen 40 m² zur Basisfläche dazu. Ferner ist ein Stall mit einer Fläche von 4 m²/Tier erforderlich. Nach der 2. Tierhaltungsverordnung Österreichs (Stand 2023) ist für 1-5 Tiere ein Außengehege von 500 m² erforderlich, für jedes weitere 50 m² mehr. Zudem ist ein beheizter Stall mit einem Mindestausmaß von 4 m² pro Tier mit einer Mindesttemperatur von 10°C vorgeschrieben. Die Haltung hat in Gruppen mit einem erwachsenen Männchen, mehreren Weibchen und deren Nachwuchs zu erfolgen. Taxonomie und NomenklaturDer Buschbock wurde 1766 vom Berliner Naturforscher Peter Simon PALLAS, den Katharina die Große als Professor nach Petersburg berufen hatte, als "Antilope scripta" anhand eines Exemplars aus dem Senegal erstmals wissenschaftlich beschrieben. 1816 stellte ihn der französische Zoologe Henri Marie Ducrotay de BLAINVILLE als Typusart in die neue Gattung Tragelaphus. Traditionell wurde die Art in über 20 (bis etwa 40) Unterarten aufgeteilt. 2005 waren es noch 9. GROVES & GRUBB splitteten in ihrer umstrittenen Huftier-Taxonomie den Buschbock in 8 Arten auf, was Eingang in das Handbuch der Säugetiere fand, aber von der IUCN im Rahmen der Roten Liste nicht mitgemacht wurde [1; 3; 4, 8; 9].
|
Literatur und Internetquellen
- GROVES, C.P. & GRUBB, P. (2011)
- GRZIMEK, B. (ed., 1970)
- HALTENORTH, T. & TRENSE, W. (1956)
- IUCN SSC Antelope Specialist Group 2016. Tragelaphus scriptus (errata version published in 2017). The IUCN Red List of Threatened Species 2016: e.T22051A115165242. http://dx.doi.org/10.2305/IUCN.UK.2016-3.RLTS.T22051A50196111.en. Downloaded on 24 March 2019.
- MILLS, G & HES, L. (1999)
- PUSCHMANN, W., ZSCHEILE, D., & ZSCHEILE, K. (2009)
- WEIGL, R. (2005)
- WILSON, D. E. et al. eds. (2009-2019)
- WILSON, D. E. & REEDER, D. M. (2005)

Weiblicher Buschbock Tragelaphus scriptus sylvaticus) in seinem natürlichen Lebensraum im Pilanesberg-Nationalpark © Peter Dollinger, Zoo Office Bern
Zurück zu Übersicht Paarzeher
Weiter zu Sitatunga (Tragelaphus spekii)
SPAULDING, M., O'LEARY, M. A. & GATESY, J. (2009)
Relationships of Cetacea (Artiodactyla) Among Mammals: Increased Taxon Sampling Alters Interpretations of Key Fossils and Character Evolution.
PLoS ONE 4(9): e7062. doi:10.1371/journal.pone.0007062.
Abstract:
Background
Integration of diverse data (molecules, fossils) provides the most robust test of the phylogeny of cetaceans. Positioning key fossils is critical for reconstructing the character change from life on land to life in the water.
Methodology/Principal Findings
We reexamine relationships of critical extinct taxa that impact our understanding of the origin of Cetacea. We do this in the context of the largest total evidence analysis of morphological and molecular information for Artiodactyla (661 phenotypic characters and 46,587 molecular characters, coded for 33 extant and 48 extinct taxa). We score morphological data for Carnivoramorpha, †Creodonta, Lipotyphla, and the †raoellid artiodactylan †Indohyus and concentrate on determining which fossils are positioned along stem lineages to major artiodactylan crown clades. Shortest trees place Cetacea within Artiodactyla and close to †Indohyus, with †Mesonychia outside of Artiodactyla. The relationships of †Mesonychia and †Indohyus are highly unstable, however - in trees only two steps longer than minimum length, †Mesonychia falls inside Artiodactyla and displaces †Indohyus from a position close to Cetacea. Trees based only on data that fossilize continue to show the classic arrangement of relationships within Artiodactyla with Cetacea grouping outside the clade, a signal incongruent with the molecular data that dominate the total evidence result.
Conclusions/Significance
Integration of new fossil material of †Indohyus impacts placement of another extinct clade †Mesonychia, pushing it much farther down the tree. The phylogenetic position of †Indohyus suggests that the cetacean stem lineage included herbivorous and carnivorous aquatic species. We also conclude that extinct members of Cetancodonta (whales + hippopotamids) shared a derived ability to hear underwater sounds, even though several cetancodontans lack a pachyostotic auditory bulla. We revise the taxonomy of living and extinct artiodactylans and propose explicit node and stem-based definitions for the ingroup.
MONTGELARD, C., CATZEFLIS, F. M. & DOUZERY, E. (1997)
Phylogenetic relationships of artiodactyls and cetaceans as deduced from the comparison of cytochrome b and 12S rRNA mitochondrial sequences.
Mol. Biol. Evol. (1997) 14 (5): 550-559.
DOI: https://doi.org/10.1093/oxfordjournals.molbev.a025792.
Abstract:
A data set of complete mitochondrial cytochrome b and 12S rDNA sequences is presented here for 17 representatives of Artiodactyla and Cetacea, together with potential outgroups (two Perissodactyla, two Carnivora, two Tethytheria, four Rodentia, and two Marsupialia). We include seven sequences not previously published from Hippopotamidae (Ancodonta) and Camelidae (Tylopoda), yielding a total of nearly 2.1 kb for both genes combined. Distance and parsimony analyses of each gene indicate that 11 clades are well supported, including the artiodactyl taxa Pecora, Ruminantia (with low 12S rRNA support), Tylopoda, Suina, and Ancodonta, as well as Cetacea, Perissodactyla, Carnivora, Tethytheria, Muridae, and Caviomorpha. Neither the cytochrome b nor the 12S rDNA genes resolve the relationships between these major clades. The combined analysis of the two genes suggests a monophyletic Cetacea +Artiodactyla clade (defined as "Cetartiodactyla"), whereas Perissodactyla, Carnivora, and Tethytheria fall outside this clade. Perissodactyla could represent the sister taxon of Cetartiodactyla, as deduced from resampling studies among outgroup lineages. Cetartiodactyla includes five major lineages: Ruminantia, Tylopoda, Suina, Ancodonta, and Cetacea, among which the phylogenetic relationships are not resolved. Thus, Suiformes do not appear to be monophyletic, justifying their split into the Suina and Ancodonta infraorders. An association between Cetacea and Hippopotamidae is supported by the cytochrome b gene but not by the 12S rRNA gene. Calculation of divergence dates suggests that the Cetartiodactyla could have diverged from other Ferungulata about 60 MYA.
BANNIKOV, A.G. (1963)
Die Saiga-Antilope.
143 Seiten, 54 Abbildungen. Umfangreiches Literaturverzeichnis. Ins Deutsche übertragen von Dipl. Biol. Renate Angermann.
Die Neue Brehm-Bücherei Bd. 320. A. Ziemsen Verlag, Wittenberg-Lutherstadt.
2004 erschien eine 2. unveränderte Auflage bei Westarp-Wiss, Hohenwarsleben. ISBN-10: 3-89432-735-9; ISBN-13: 978-3-89432-735-4.
Inhalt:
Die Saiga-Antilope (Saiga tatarica), die in früherer Zeit die gesamte Steppenzone Europas besiedelte, ist heute auf ein Areal beschränkt, das von den Kalmücken- und Kirgisensteppen bis zur Mongolei reicht. Vor Jahrhunderten waren die Saigas in unübersehbaren Herden verbreitet. Durch rücksichtslose unkontrollierte Bejagung waren sie jedoch bis zum Anfang des 20. Jahrhunderts in ihrem Bestand derartig zurückgegangen, daß intensive Schutzmaßnahmen ergriffen werden mußten. In einer langen Einzelentwicklung haben sich typische Merkmale herausgebildet, die eine weitgehende Anpassung dieser ausgesprochenen Schnelläufer, die sich in großen Herden fortbewegen, an das Leben in Steppen und Staubhalbwüsten darstellen. Gegenüber anderen Hornträgern ist eine Abänderung der Anatomie des Kopfskeletts eingetreten. Der Nasenvorhof hat sich zu einem beweglichen Rüssel entwickelt, der den Atemwegen als Staubschutz vorgelagert ist. In weiten jahreszeitlichen Wanderungen sucht die Saiga die klimatisch am günstigsten beeinflußten Lebensbedingungen zu nutzen. Strenge Winter mit Schneestürmen und lange anhaltender verharschter Schneedecke haben oft ein Massensterben der Saiga-Antilope zur Folge. Doch durch verschiedene Faktoren, die als Anpassung an solche Katastrophen angesellen werden können, ergänzen sich die Bestände in kurzer Zeit wieder. In der Gegenwart stellen die Saiga-Herden, die durch die staatlich gelenkte Jagdwirtschaft und Hege wieder erheblich zugenommen haben, einen bedeutenden Wirtschaftsfaktor dar.
bannikov-biblio
MATSCHEI, C. (2005)
Bemerkungen zur Zucht der Himalaya-Tahre Hemitragus jemlahicus im Zoologischen Garten Berlin.
BONGO Berlin, 35: 43-48.
Zusammenfassung:
Berichtet wird über die Zucht des Himalaya-Tahres (Hemitragus jemlahicus) im Berliner Zoo. 1955 gelangten die ersten Tiere nach dem 2. Weltkrieg in den Zoo. Die jüngste Geiß brunstete erstmals mit anderthalb Jahren. Bis 2004 wurden 83 Würfe mit 97 Kitzen gemeldet. Unter den Jungtieren hab es 70 Einzelkitze, 12 Zwillingspaare und eine Drillingsgeburt. Die Wurfzeit liegt zwischen April und Augist, der Schwerpunkt liegt im Juni (57.8%).
Abstract:
A report of breeding effort at Berlin Zoo by Himalayan tahrs (Hemitragus jemlahicus) is given. Berlin received the first animals after World War II. in 1955. Since then there are noticed 83 births with 97 offsprings. The youngest female show breeding behaviour at the age of 1 1/2 year. 70 singles, 12 twins and 1 triplet were born till now (2004). The breeding saison is from April to August, by the main emphasis of June (57,8 %).
matschei-biblio
WEDDING, S. (1979)
Das Blutbild in den ersten drei Lebensmonaten von drei Kamelen (Camelus ferus bactrianus) und einem Lama (Lama guanicoe glama) des Zoologischen Gartens Berlin.
Dr. med. vet. Dissertation
81 Seiten.
Fachrichtung Veterinär-Hämatologie im Institut für Veterinär-Pathologie des Fachbereiches Veterinärmedizin der Freien Universität Berlin
Referent: Prof. Dr. H. Niepage
Korreferent: Prof. Dr. M. Mülling
Zoologischer Garten Berlin
Zusammenfassung:
Deutsche und Englische Zusammenfassung
wedding-biblio
SCHERPE, W-P. (1971)
Beobachtungen am Verhalten des chinesischen Wasserrehs (Hydropotes inermis, SWINHOE), des indischen Muntjaks (Muntiacus muntjak muntjak, ZIMMERMANN) und des chinesischen Muntjaks (Muntiacus muntjak reevesi, OGILBY).
Dr. med. vet. Dissertation
195 Seiten.
Institut für Experimentelle Therapie und Funktionelle Pathologie der Freien Universität Berlin
Referent: Prof. Dr. phil. Dr. med. vet. Dr. med. G. Schützler
Korreferent: Prof. Dr. med. vet. J. Boch
Zoologischer Garten Berlin
Zusammenfassung:
scherpe-biblio
LETZNER, G. (1987)
Ein Beitrag zur Immobilisation, Physiologie und Pathologie der Giraffidae.
A Contribution concerning the Immobilization, Physiology and the Pathology of the Giraffidae.
Dr. med. vet. Dissertation
273 Seiten.
Klinik für kleine Klauentiere und forensische Medizin und Ambulatorische Klinik der Tierärztlichen Hochschule Hannover
Wissenschaftliche Betreuung: Prof. Dr. W. Bollwahn
1. Berichterstatter: Prof. Dr. W. Bollwahn
2.Berichterstatter: Prof. Dr. K. Wächtler
Zoologischer Garten Berlin
Zusammenfassung:
Deutsche und Englische Zusammenfassung
letzner-biblio
HEROLD, G. (1997)
Untersuchungen zur Verfolgung der Sexualfunktion bei hirschartigen Tieren und dem Okapi (Okapia johnstoni) durch Progesteron- und Östrogenbestimmung aus dem Kot.
Non-Invasive Monitoring of Sexual Function in three different deer species and Okapi (Okapia johnstoni) by Measurement of Faecal Progestins and Estrogens.
Dr. med. vet. Dissertation
104 Seiten.
Aus der Tierklinik für Fortpflanzung des Fachbereiches Veterinärmedizin der Freien Universität Berlin
Erster Gutachter: Univ.-Prof. Dr. habil. W. Busch
Zweiter Gutachter: Prof. Dr. Dr. h. c. H.-G. Klös
Zoologischer Garten Berlin
Zusammenfassung:
Deutsche und Englische Zusammenfassung
heriold-biblio
HARMUTH, D. (1962)
Verhaltensstudien an Wildschweinen im Zoologischen Garten zu Berlin.
Dr. med. vet. Dissertation
41 Seiten.
Freie Universität Berlin
Referent: Prof. Dr. Schmidt-Hoensdorf
Korreferent: Prof. Dr. Heidrich
Zoologischer Garten Berlin
Zusammenfassung:
harmuth-biblio