SCHNUG, C. (1993)
Entwicklung der Delphinhaltung in Delphinarien von 1965 bis 1992. Haltung-Fütterung-Krankheiten
The development of keeping dolphins in dolphinaria from 1965 to 1992. Keeping-feeding-diseases
Dr. med. vet. Dissertation
207 Seite
Tierärztliche Fakultät, Ludwig-Maximilians-Universität München
Leitung: Prof. Dr. Helmut Kraft
u.a. Zoo Duisburg
Zusammenfassung:
Neun deutsche und ein schweizer Delphinarium wurden vom Zeitpunkt ihrer Eröffnung bis zum Dezember 1992 hinsichtlich der Entwicklung auf dem Gebiet der technischen Gegebenheiten, der Wasserqualität und Umgebungsbedingungen, der importierten Delphine und ihrer Erkrankungen und Behandlungen sowie der Aufzucht untersucht. Als Grundlagen dienten ein an alle untersuchten Delphinarien verschickter Fragebogen und persönliche Gespräche mit Tierärzten, -trainern und -pflegern.
Da alle untersuchten Delphinarien bis Ende der 70er Jahre gebaut wurden, entsprachen die baulichen Anlagen, außer bei den Delphinarien, die erweitert wurden, nicht mehr zweifellos den neuesten Anforderungen. Die technischen Anlagen, obwohl sie ebenfalls meist aus den 70er Jahren stammten, waren einwandfrei und stimmten mit den Anforderungen an Filteranlagen für eine Delphinhaltung überein. Eine gewisse Entwicklung zeigte sich insofern, dass ebenso vermehrt Wert auf andere Umgebungsbedingungen und weniger stark schwankende Wasserparameter gelegt wurde. Eine große positive Veränderung ab Anfang bis Mitte der 80er Jahre fand im Gegensatz dazu im Laufe der Jahre auf dem Gebiet der Delphinimporte, der Todesfälle, des erreichten Alters der Tiere und dem Auftreten von Krankheiten statt. Auch bezüglich der Aufzucht von Jungtieren konnte eine positive Entwicklung registriert werden. Diese stand aber zum Zeitpunkt der Untersuchung noch ganz am Anfang und begann erst die letzten Jahre. Hält diese Entwicklung an, so kann die Delphinhaltung, außer für z.B. Blutauffrischung, bald auf Wildfänge verzichten und einen Bestand aus der Nachzucht sichern. Es sollte aber stärkerer Informationsaustausch zwischen den Delphinarien bestehen, um begangene Fehler zu vermeiden und dafür neue Erkenntnisse zu gewinnen. Dies gilt im gleichen Maße für Wissenschaft und Praxis.
Abstract:
Studies on nine German and one Swiss dolphinaria have been conducted regarding technical changes, water quality and environmental standards as well as the imported dolphins themselves, their diseases, treatment and breeding covering the period from the dolphinaria's opening until December 1992. Basis of this investigation were questionnaires sent to all dolphinaria and interviews with veterinarians, dolphin trainers and curators. As all the dolphinaria in the study had been built before the end of the seventies, their facilities do not conform in all aspects to latest requirements, except for those which had been modernized in the meantime. Their technical facilities, although also installed in the seventies, conformed to the required standard for filter systems for dolphins in captivity. Development to some extend was seen in the greater emphasis placed on environmental conditions and less fluctuating water parameters.
Significant changes for the better took place during the first half of the eighties with regard to dolphin imports, facilities, the animal's life expectancy and the frequency of disease. Progress was also made in the rearing of calves. This positive trend began only several years ago and is still in its early stages. Should it continue, no more wild dolphins will have to be captured and it will be possible to rely entirely on the breeding of dolphins in captivity. Exceptions would be for example "Blutauffrischungen" (Exceptions could be made to avoid exceeded inbreeding). There should, however, be an increased exchange of information between dolphinaria to avoid the same mistakes again and to gain new knowledge. This applies equally to scientific and practical work.
schnug-biblio
MICHAELS, C. J., TAPLEY, B., HARDING, L., BRYANT, Z., GRANT, S., SUNTER, G., GILL, I., NYINGCHIA, O. & DOHERTY-BONE, T. (2015)
Breeding and rearing the Critically Endangered Lake Oku Clawed Frog (Xenopus longipes Loumont and Kobel 1991).
Amphibian & Reptile Conservation 9(2) [General Section]: 100–110 (e102)
Abstract:
The Lake Oku Clawed Frog Xenopus longipes is a Critically Endangered, dodecaploid anuran endemic to Lake Oku in Cameroon. An ex situ population of this species was established at Zoological Society of London (ZSL), London Zoo in 2008, as well as at several other institutions, with the intention of providing data on the biology and husbandry of this species. We report the first captive breeding of the species. Adult frogs maintained under environmental conditions designed to mimic field data produced clutches of 7–300 eggs; eggs measured 1.23 mm in diameter, and were laid singly after a period of 6.5 hours in axial amplexus. Spawning took place only during the day. Tadpoles hatched in 2–3 days, and development was very long compared to congeners, lasting 193–240+ days until metamorphosis. Tadpoles grew very large (maximum 79 mm total length), particularly compared with the relatively small adult size (maximum 36 mm Snout to Vent Length [SVL]). Tadpoles proved to be highly sensitive to total dissolved solids (TDS) in the water and only thrived when low levels (20 mg/L) were used. Metamorphosis concluded with an SVL of 19–25 mm and F1 animals began first sexual activity at 5–6 months post metamorphosis. These data will inform future husbandry in captivity as well as illuminating facets of biology previously unknown and difficult to determine in the field
WEIMER, R. & STUBNER, S. (1993)
Haltung, Zucht und Entwicklung des Beutelfrosches Gastrotheca riobambae (FOWLER, 1913) (Anura: Hylidae)
Keeping, breeding, and evelopment of the Marsupial Frog Gastrotheca riobambae (FOWLER, 1913) (Anura: Hylidae)
HERPETOZOA 6 (3/4): 89-96. Wien, 30. Dezember 1993
Zusammenfassung:
Dreizehn Beutelfrösche der Art Gastrotheca riobambae (FOWLER, 1913) aus Ecuador wurden zur Nachzucht gebracht. Anleitungen zur Haltung und Zucht sowie zur Aufzucht der Kaulquappen und Jungfrösche werden gegeben. Paarungsverhalten und Absetzen der Kaulquappen werden beschrieben. Die Eiablage wurde durch Beregnung und Temperaturschwankungen stimuliert. Die beobachtete Entwicklungszeit von 59 Tagen vom Ei zum Jungfrosch wird mit Literaturangaben verglichen.
Buschbock
Überordnung: LAURASIATHERIA
Taxon ohne Rang: CETARTIODACTYLA
Ordnung: Paarzeher (ARTIODACTYLA)
Unterordnung: Wiederkäuer (Ruminantia)
Familie: Hornträger (Bovidae)
Unterfamilie: Echte Rinder (Bovinae)
Tribus: Afrikanische Waldböcke (Tragelaphini)

Buschbock oder Schirrantilope
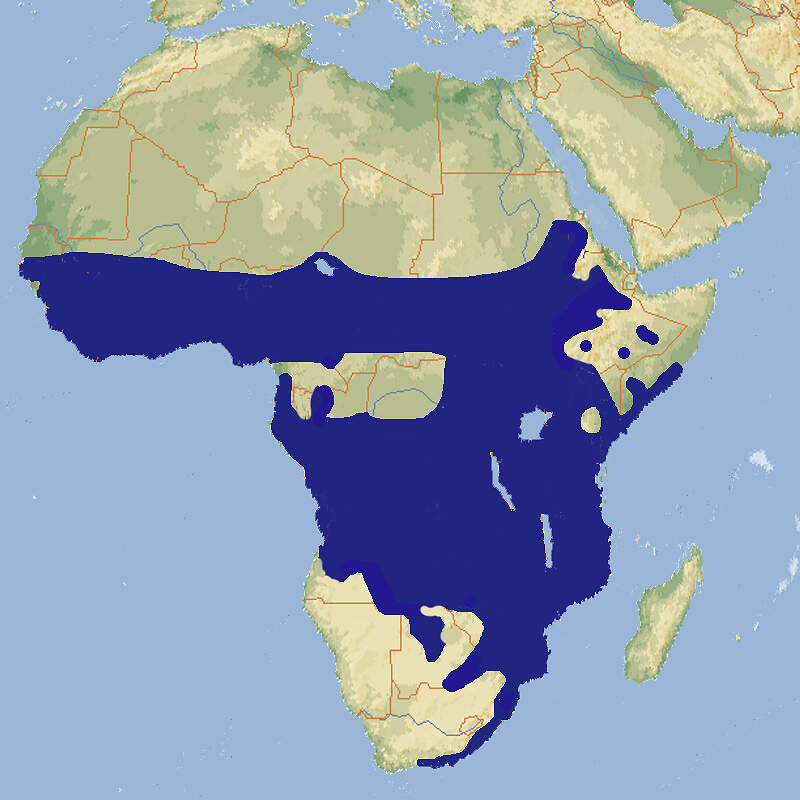
Tragelaphus scriptus • The Bushbuck • Le guib harnaché
- Körperbau und Körperfunktionen
- Verbreitung
- Lebensraum und Lebensweise
- Gefährdung und Schutz
- Bedeutung für den Menschen
- Haltung
- Taxonomie und Nomenklatur
- Literatur und Internetquellen
|
Weitere Bilder auf BioLib.cz |
Der Buschbock ist eine kleinere, äußerst attraktive Antilope mit deutlichem Sexualdimorphismus, die sowohl für das allgemeine Publikum als auch für die Zoopädagogik interessant wäre, die aber als weit verbreitete, nicht gefährdete Art vom Europäischen Zoo- und Aquarienverband als nicht prioritör eingestuft wurde und daher in den Zoos mittlerweile ausgestorben ist. Körperbau und KörperfunktionenDer Buschbock ist der kleinste der afrikanischen Waldböcke. Er zeigt einen stark ausgeprägten Sexualdimorphismus. Die Böcke erreichen eine Kopf-Rumpflänge von 114-150 cm, eine Schulterhöhe von 80 (65-100) cm und ein Gewicht von 40-80 kg. Die Ricken werden bis 132 cm lang, 70 (61-85) cm hoch und 24-60 kg schwer. Der Schwanz wird etwa 19-24 cm lang. Wie bei den anderen afrikanischen Waldböcken haben die Böcke schraubenartig gedrehte Hörner, die 40-55 cm lang werden können. Das Fell zeigt bei beiden Geschlechtern ein auffallendes Muster weißer Punkte und Streifen, wobei es erhebliche regionale Unterschiede gibt. An der Halsunterseite verlaufen 1-2 weiße Querbänder, die Schwanzunterseite ist weiß, die Schwanzspitze kann schwarz sein. Die Beine können je nach Unterart einfarbig sein oder eine weiß oder schwarzweiße Zeichnung aufweisen. Die Grundfarbe ist regional variabel, bei den Ricken meist rotbraun, bei den Böcken etwas dunkler, kastanienbraun oder schwarzgrau [2; 5; 8]. VerbreitungAfrika südlich der Sahara: Angola, Äquatorialguinea, Äthiopien, Benin, Botswana, Burkina Faso, Burundi, Elfenbeinküste, Gabun, Gambia, Ghana, Guinea, Guinea-Bissau, Kamerun, Kenia, Kongo, Kongo Dem., Liberia, Malawi, Mali, Mauretanien, Mosambik, Namibia, Niger, Nigeria, Ruanda, Sambia, Senegal, Sierra Leone, Simbabwe, Somalia, Südafrika, Südsudan, Sudan, Swasiland, Tansania, Togo, Tschad, Uganda, Zentralafrikanische Republik [4]. Lebensraum und LebensweiseBuschböcke benötigen Lebensraum mit viel Deckung. Sie kommen in Tropischen Regen- und Feuchtwäldern, Subtropischen Feuchtwäldern, und Gemäßigten immergrünen Feuchtwäldern, jeweils vorzugsweise an Waldrändern, Galeriewäldern, Trockenwäldern, Dornsavannen, Dickichten und Zuckerrohrpflanzungen vor. Die Nahrung dieser Selektiväser besteht überwiegend aus Blättern und Zweigen, aber auch zarte Gräser werden genommen. Buschböcke leben solitär, sind aber nicht territorial, sondern haben überlappende Streifgebiete [5; 8]. Es gibt keine definierte Fortpflanzungsperiode, allenfalls saisonale Spitzen der Brunftaktivitäten und der Geburten. Nach einer Tragzeit von rund 180 Tagen wird in der Regel ein einzelnes Kitz mit einem Gewicht von 3.1-4.5 kg geboren. Angaben über das Erreichen der Geschlechtsreife sind widersprüchlich. Bei Ricken dürfte dies mit etwa 1 Jahr der Fall sein, bei Böcken mit 1.5 Jahren, wobei sie effektiv meist erst mit 3 Jahren zur Forspflanzung kommen [5; 6; 8]. Gefährdung und SchutzDer Buschbock hat eine sehr weite Verbreitung und einen geschätzten Bestand von 1 bis 1.5 Millionen Adulttieren, der als stabil angesehen wird, außer in vom Menschen dicht besiedelten Regionen. Möglicherweise ist diese Schätzung wegen der heimlichen Lebensweise des Buschbocks zu tief. Er gilt daher seit 1996 als nicht gefährdet (Rote Liste: LEAST CONCERN) , was im Rahmen einer Beurteilung aus dem Jahr 2016 bestätigt wurde. Der Klimawandel macht der Art in den trockeneren Teilen ihres Areals zu schaffen, andererseits kann sie ihre Verbreitung im Gebiet der Regenwälder ausdehnen [4]. Der internationale Handel ist nicht unter CITES geregelt. Die Einfuhr lebender Exemplare aus den Ursprungsländern ist wegen der restriktiven Veterinärbestimmungen der EU so gut wie ausgeschlossen. Bedeutung für den MenschenDer Buschbock wird zur Gewinnung von Fleisch und als Sport gejagt. In Ruanda ist sein Fleisch deutlich billiger als jenes von Nutztieren und dementsprechend ist der Buschbock die häufigste Wildtierart, die auf Fleischmärkten angeboten wird. Im Rahmen der Sportjagd werden in Südafrika "Trophy Fees" von etwa 1'200-1'500 USD fällig, in anderen afrikanischen Ländern 400-1'100 USD. HaltungIn den 1950er Jahren wurde im Zoo Basel ein Buschbock kurze Zeit gemeinsam mit Sitatungas und Vierhornantilopen gehalten, um 1990 in Hannover gemeinsam mit Kirk-Dikdiks. Eine Gemeinschaftshaltung mit Sitatungas sollte sollte wegen der Gefahr der Bastardierung tunlichts vernieden werden Als Höchstalter gibt WEIGL über 15 Jahre und 3 Monate für ein im Ruhr-Zoo Gelsenkirchen geborenes und später in Hannover gehaltenes gehaltenes weibliches Tier an [7]. Haltung in europäischen Zoos: Die Art ist dem Collection Planning der EAZA zum Opfer gefallen und wird heute nicht mehr gehalten. Die britische (europäische?) Erstzucht gelang 1841 in der Menagerie des Earl of Derby in Knowsley (heute Safaripark). Der letzte Hinweis auf eine Nachzucht in Europa im International Zoo Yearbook bezieht sich auf das Jahr 1991 (Zoo Hannover). Bei den in Europa gehaltenen Tiere handelte es sich hauptsächlich um Senegal-Buschböcke, die z.B. in Hannover 31 Jahre lang gehalten und regelmäßig gezüchtet wurden, seltener um Kap-Buschböcke. Andere Unterarten waren Ausnahmeerscheinungen. Für Details siehe Zootierliste. Mindestanforderungen an Gehege: Nach Säugetiergutachten 2014 des BMEL soll für bis zu 5 Tieren ein Gehege von mindestens 200 m² zur Verfügung stehen. Für jedes weitere Tier kommen 20 m² zur Basisfläche dazu. Zudem wird ein Stall von etwa 3 m²/Tier vorgegeben. Die Schweizerische Tierschutzverordnung (Stand 01.06.2022) schreibt für theoretisch bis zu 10 Tieren ein Gehege mit Trenn- oder Absperrmöglichkeit vor, dessen Grundfläche 500 m² misst. Für jedes weitere Tier kommen 40 m² zur Basisfläche dazu. Ferner ist ein Stall mit einer Fläche von 4 m²/Tier erforderlich. Nach der 2. Tierhaltungsverordnung Österreichs (Stand 2023) ist für 1-5 Tiere ein Außengehege von 500 m² erforderlich, für jedes weitere 50 m² mehr. Zudem ist ein beheizter Stall mit einem Mindestausmaß von 4 m² pro Tier mit einer Mindesttemperatur von 10°C vorgeschrieben. Die Haltung hat in Gruppen mit einem erwachsenen Männchen, mehreren Weibchen und deren Nachwuchs zu erfolgen. Taxonomie und NomenklaturDer Buschbock wurde 1766 vom Berliner Naturforscher Peter Simon PALLAS, den Katharina die Große als Professor nach Petersburg berufen hatte, als "Antilope scripta" anhand eines Exemplars aus dem Senegal erstmals wissenschaftlich beschrieben. 1816 stellte ihn der französische Zoologe Henri Marie Ducrotay de BLAINVILLE als Typusart in die neue Gattung Tragelaphus. Traditionell wurde die Art in über 20 (bis etwa 40) Unterarten aufgeteilt. 2005 waren es noch 9. GROVES & GRUBB splitteten in ihrer umstrittenen Huftier-Taxonomie den Buschbock in 8 Arten auf, was Eingang in das Handbuch der Säugetiere fand, aber von der IUCN im Rahmen der Roten Liste nicht mitgemacht wurde [1; 3; 4, 8; 9].
|
Literatur und Internetquellen
- GROVES, C.P. & GRUBB, P. (2011)
- GRZIMEK, B. (ed., 1970)
- HALTENORTH, T. & TRENSE, W. (1956)
- IUCN SSC Antelope Specialist Group 2016. Tragelaphus scriptus (errata version published in 2017). The IUCN Red List of Threatened Species 2016: e.T22051A115165242. http://dx.doi.org/10.2305/IUCN.UK.2016-3.RLTS.T22051A50196111.en. Downloaded on 24 March 2019.
- MILLS, G & HES, L. (1999)
- PUSCHMANN, W., ZSCHEILE, D., & ZSCHEILE, K. (2009)
- WEIGL, R. (2005)
- WILSON, D. E. et al. eds. (2009-2019)
- WILSON, D. E. & REEDER, D. M. (2005)

Weiblicher Buschbock Tragelaphus scriptus sylvaticus) in seinem natürlichen Lebensraum im Pilanesberg-Nationalpark © Peter Dollinger, Zoo Office Bern
Zurück zu Übersicht Paarzeher
Weiter zu Sitatunga (Tragelaphus spekii)
Beuteltiere - Allgemeines
Klasse: Säugetiere (Mammalia)
Unterklasse: Beutelsäuger (Metatheria)
oder:
Beuteltiere
Marsupialia • The Marsupials • Les marsupiaux
- Artenspektrum und innere Systematik
- Körperbau und Körperfunktionen
- Verbreitung
- Haltung im Zoo
- Taxonomie und Nomenklatur
- Literatur und Internetquellen
|
|
Die Beuteltiere gebären Junge, die sich noch in einem embryonalen Zustand befinden und nach der Geburt in einem Bauchbeutel fertig ausgetragen werden. Ihre Wege und die der Höheren Säugetiere haben sich zu Ende der Jurazeit – vor rund 150 Millionen Jahren - getrennt. In der nachfolgenden Evolution kam es zu zahlreichen konvergenten Entwicklungen bei den beiden Tiergruppen, z.B: Mäuse / Beutelmäuse, Goldmulle / Beutelmulle, Marder / Beutelmarder, Dachse / Beuteldachse, Wölfe / Beutelwölfe, Gleithörnchen / Gleitbeutler. Artenspektrum und innere SystematikHeute werden die 349 gegenwärtig anerkannten rezenten Arten wie folgt auf sieben Ordnungen verteilt [2; 4]:
13 Arten sind seit der Besiedlung Australiens durch die Europäer ausgestorben, 12 davon im Lauf des 20. Jahrhunderts. Eine davon, der Beutelwolf (Thylacinus cynocephalus), repräsentierte eine eigene Familie. Bei den übrigen handelt es sich um 8 Kängurus, 3 Nasenbeutler sowie ein Opossum aus Argentinien [2]. Nach Roter Liste der IUCN gelten 17 der noch lebenden Arten als vom Aussterben bedroht (CRITICALLY ENDANGERED), 22 als stark gefährdet (ENDANGERED), 43 als gefährdet (VULNERABLE) und 41 als potenziell gefährdet (NEAR THREATENED). 194 sind nicht gefährdet (LEAST CONCERN) und 19 können mangels Daten nicht eingestuft werden [2]. Körperbau und KörperfunktionenDas Skelett der Beuteltiere ist säugetiertypisch. Das Rabenbein (Coracoid) ist zwar embryonal angelegt, verschmilzt dann aber mit dem Schulterblatt. In der Regel sind Schlüsselbeine vorhanden. Als Besonderheit ist bei beiden Geschlechtern in der Gegend des Schambeins ein Paar Beutelknochen (Ossa marsupialia) ausgebildet. Die Körpertemperatur ist mit 34-36°C höher als die der Kloakentiere, aber liegt unter jener der Höheren Säugetiere. Ihr Gehirn ist klein und einfach gebaut, die Großhirnhemisphären sind praktisch ungefurcht und überlappen das Kleinhirn nicht. Gut ausgebildet ist das Riechhirn. Das Gebiss kann eine sehr hohe Zahnzahl enthalten (bis 56). Außer beim 4. Prämolaren bricht nur eine Zahngeneration durch. Enddarm und Vaginalöffnungen münden in eine von einem Ringmuskel umgebene Kloakentasche, ebenso die Harnröhre, sofern sie nicht bei männlichen Tieren an der Basis des Penis mündet. Der ausschließlich samenführende Penis liegt in einer Penistasche und zwar, anders als bei den Höheren Säugetieren, nicht vor, sondern hinter dem Scrotum. Der weibliche Geschlechtsapparat ist mit unterschiedlichem Verwachsungsgrad paarig ausgebildet. Außer bei den Beuteldachsen wird keine Plazenta ausgebildet, die bis zu 11 Embryos werden von Ausscheidungen der Gebärmutterschleimhaut ernährt. Die Brutbeutel der Weibchen sind je nach Art sehr unterschiedlich. Die Zitzen sind sehr lang, damit sich die Neubegorenen an ihnen festsaugen können, vielfach kommt es zu einer sekundären Verwachsung von Jungem und Zitze. Die Jungen verlassen nach einer kurzen Tragzeit von 8-42 Tagen die Gebärmutter und werden danach im Brutbeutel untergebracht, den sie erst nach einer längeren Beuteltragzeit von bis zu 250 Tagen verlassen [1; 5]. VerbreitungSüdamerika und von dort Ausbreitung einiger Arten nach Mittel- und Nordamerika; Australien, Neuguinea, Indonesien östlich der Wallace-Linie, Salomonen. Haltung im ZooIn europäischen Zoos sind die Beuteltiere mit rund 25 Arten schwach vertreten. Das hängt damit zusammen, dass einerseits die Ausfuhr aus Australien sehr restriktiv geregelt ist, andererseits viele Arten klein und nachtaktiv sind und somit dem Publikum in Zoos nur präsentiert werden können, wenn diese über ein Nachttierhaus verfügen. Etwa die Hälfte der gezeigten Arten sind Kängurus (Macropodidae), die andere Hälfte verteilt sich auf 9 Familien. Die in Europa mit Abstand häufigste Art ist das Bennettkänguru (Macropus rufogriseus), das in rund 540 Zoos gezeigt wird, mit Abstand gefolgt vom Roten Riesenkänguru (Macropus rufus) und dem Parmakänguru (Macropus parma) mit jeweils gegen 90 Haltungen [6]. Taxonomie und NomenklaturBeuteltiere waren im Erdmittelalter und in der frühen Erdneuzeit in Nordamerika, Eurasien, Mittel- und Südamerika, der Antarktis und Afrika weit verbreitet, wurden aber bis auf die Beutelratten und Beutelmäuse in Nord- Mittel und Südamerika überall von den Höheen Säugetieren verdrängt oder wurden Opfer des Klimawandels. Nach Australien, wo wir heute die größte Artenvielfalt haben, gelangten sie, von Südamerika her, erst im Eozän, d. h. vor rund 50 Millionen Jahren [1]. Die Beutelsäuger werden als Unterklasse den Ursäugern und Höheren Säugetieren gegenüber gestellt. Früher wurden alle Beuteltiere in einer einzigen Ordnung zusammengefasst [1; 3]. HALTENORTH unterteilte 1969 die Unterklasse in mehrere Ordnungen, was in Analogie zu den Verhältnissen bei den Höheren Säugetieren durchaus gerechtfertigt ist und bis heute Bestand hat [4; 5]. |
Literatur und Internetquellen
- GRZIMEK, B. (1970). In GRZIMEKs TIERLEBEN
- IUCN Red List of Threatened Species. Version 2022-2. Downloaded on 6 January 2023.
- SIMPSON, G. G. (1945)
- WILSON, D. E. et al. eds. (2009-2019)
- ZISWILER, V. (1976)
- ZOOTIERLISTE
Zurück zu Übersicht Kloaken- und Beuteltiere
Weiter zu Nordopossum (Didelphis virginiana)
HUMMEL, J. (1998)
Variabilität im Verhalten von Okapis - Einfluss von Haltung und individuellen Unterschieden.
Diplomarbeit
120 Seiten plus Anhang
Fachbereich Biologie, Johannes Gutenberg - Universität Mainz
Supervisor: Prof. Dr. Neumeyer
Zoo Basel, Zoo Köln und weitere Zoos
Zusammenfassung:
hummel-biblio
DETTWILER, R. (2005)
Wie veränderte sich die Haltung der Elefanten im Zoologischen Garten Basel von 1980 bis heute und was könnte man im Hinblick auf eine artgerechte Tierhaltung verbessern?
Maturarbeit
40 Seiten
Gymnasium
Supervisor: P. Beerli
Zoo Basel
Zusammenfassung:
dettwiler-biblio
BERGER, H. (1993)
Fortpflanzung bei Leopard und Tiger unter Haltungsbedingungen
Doktorarbeit
67 Seiten
Universität Wien
Supervisor: Prof. John Dittami
14 zoologische Gärten
Zusammenfassung:
Summary:
berger-biblio
MÜLLER, M. (2010)
Ratgeber zur Haltung von Steppenlemmingen.
63 Seiten; 49 Farbfotos
Thorsten Geier Kleintierverlag; ISBN: 9783981121230
Inhalt (Verlagstext):
Dieses Buch ist Ergebnis langer Erfahrung der Autorin in artgerechter Haltung ihrer grauen Steppenlemminge. Ausgehend von der natürlichen Lebensweise dieser liebenswerten Tiere informiert dieser Ratgeber Sie zu allem, was Sie für den täglichen Umgang mit Steppenlemmingen wissen müssen. Sie erfahren, wie Sie Lemminge
► artgerecht unterbringen,
► fit und gesund halten,
► beschäftigen und ernähren,
► zähmen und züchten,
damit Sie und Ihre Lieblinge gemeinsam
viel Spaß haben.
müller-biblio
HONIGS, S. (2008)
Stachelmäuse - Biologie, Haltung, Zucht.
1. Auflage; 79 Seiten; 107 Fotos.
Natur- und Tier-Verlag GmbH, D-48157 Münster; ISBN: 978-3-86659-040-3.
Inhalt (Verlagstext):
Stachelmäuse liegen im Trend: Immer mehr Tierfreunde interessieren sich für die interessanten Nager mit dem ungewöhnlichen Aussehen und dem spannenden Familienverhalten. Sandra Honigs, Diplom-Biologin und bekannte Nager-Expertin, vermittelt dem Leser dieses Ratgebers alles Wissenswerte über die Biologie, Haltung und Zucht der verschiedenen Stachelmausarten in leicht verständlicher und äußerst fachkundiger Art und Weise.
honigs-biblio