WEINBERGER, I. & BAUMGARTNER, H. (2018)
Der Fischotter - Ein heimlicher Jäger kehrt zurück.
1. Auflage 2018
256 Seiten, rund 145 Abbildungen, 20 Karten, 10 Grafiken
Haupt Verlag, Bern. ISBN: 978-3-258-08084-0
Inhalt:
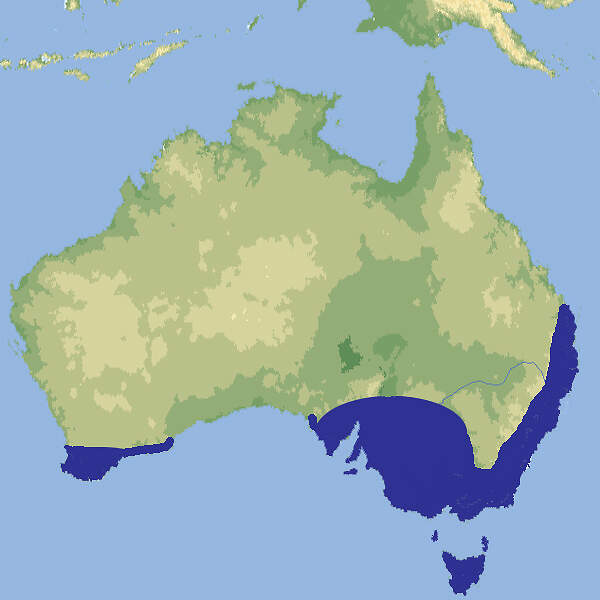
Der Fischotter hat ein bewegtes Jahrhundert hinter sich. Anfänglich wurde er rigoros verfolgt. Als er vielerorts ausgestorben war, wurde der Fischotter zum Symboltier für die bedrohte Natur. Doch kaum geht es ihm wieder besser, macht er sich in manchen Kreisen erneut als Fischräuber unbeliebt. Die Tierart scheint niemanden kaltzulassen. Doch was wissen wir eigentlich über den Fischotter? Mit seinem vornehmlich nachtaktiven und heimlichen Leben entzieht er sich weitgehend der Beobachtung.
Dieses Buch stellt die Geschichte, Biologie und Ökologie des Fischotters vor. Es beschreibt seine Lebensweise, zeichnet die Geschichte seiner Ausrottung und Rückkehr nach und diskutiert die Herausforderungen, die das Zusammenleben mit dem anpassungsfähigen Wassermarder in unserer Gewässerlandschaft mit sich bringt.
Gehe zu Fischotter (Lutra lutra)
weinberger-biblio
HUSSAIN, S.A., GUPTA, S.K. & DE SILVA, P.K. (2011)
Biology and Ecology of Asian Small-Clawed Otter Aonyx cinereus (Illiger, 1815): A Review .
IUCN Otter Spec. Group Bull. 28 (2): 63 - 75
Abstract
The Asian small-clawed otter is the smallest among the 13 extant species of otters. It has a large distribution range extending from India in South Asia through Southeast Asia up to Taiwan and Philippines in the east and Southern China in the north. It is considered ‘Vulnerable’ due to habitat loss and degradation, depletion of prey species and exploitation. Being adapted to live in shallow streams and water bodies, they are more vulnerable to modification of these habitats by anthropogenic as well as climate change impacts. This paper summarizes the state of knowledge on the biology and ecology of this little known species. Over the years, the IUCN SSC Otter Specialist Group has developed a cadre of biologist across Asia to conduct field surveys and has popularized otter conservation by promoting otter as the ambassador of wetlands. However, concerted effort is needed for its long-term survival. Policy based action, research on factors affecting survival, habitat-based actions on creation and where required expansion of protected areas and communication and awareness building among local communities are suggested.
Volltext: http://iucnosg.org/Bulletin/Volume28/Hussain_et_al_2011.html
hussain-biblio
ERLICH DE YOFFE, A. et al., ed. (1984)
Los zorros.
Fauna Argentina 52.
Brosch., 32 Seiten mit Farbfotos, Strichzeichnungen und Verbreitungskarten.
Centro Editor de América Latina, Buenos Aires.
erlich-biblio
Westlicher-Baumschliefer
Überordnung: AFROTHERIA
Taxon ohne Rang: PAENUNGULATA
Ordnung: Schliefer (HYRACOIDEA)
Familie: Schliefer (Procaviidae)

Westlicher oder Regenwald-Baumschliefer
Dendrohyrax dorsalis • The Western Tree Hyrax • Le daman arboricole
- Körperbau und Körperfunktionen
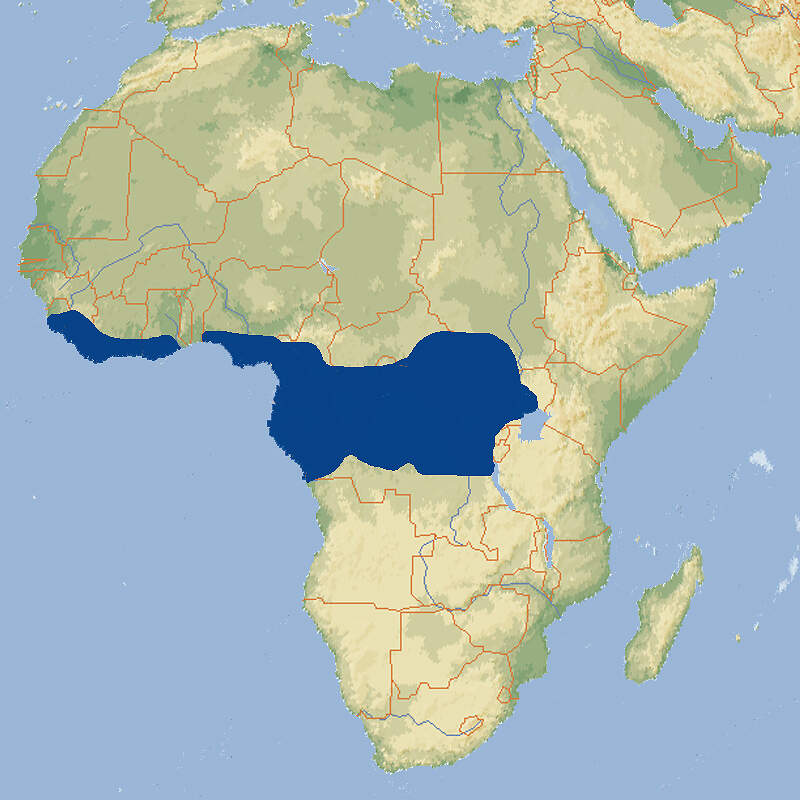
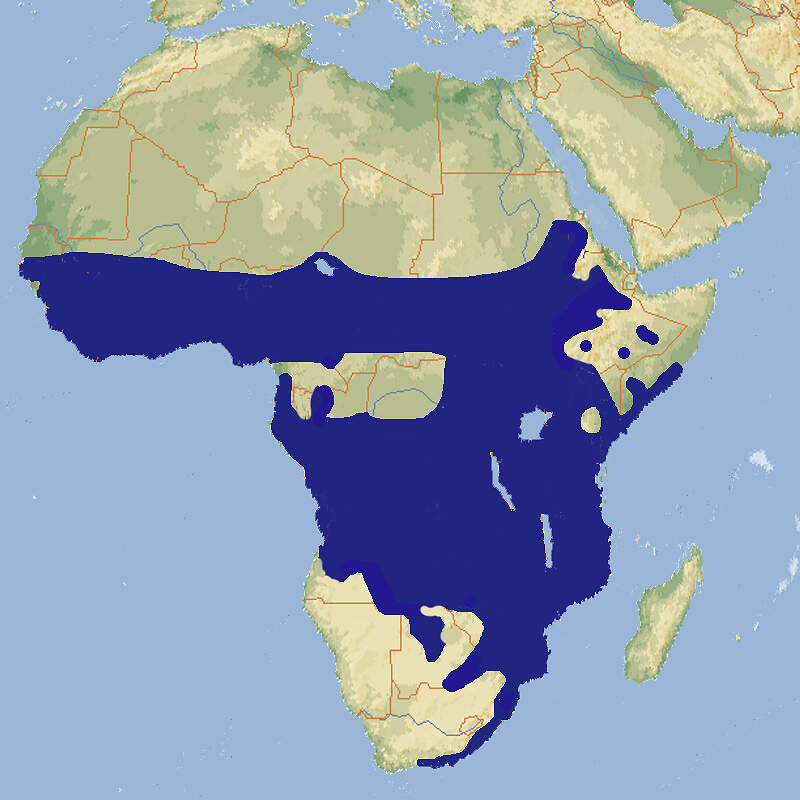
- Verbreitung
- Lebensraum und Lebensweise
- Gefährdung und Schutz
- Bedeutung für den Menschen
- Haltung
- Taxonomie und Nomenklatur
- Literatur und Internetquellen
|
Weitere Bilder auf BioLib |
Aufgrund ihrer anatomischen Besonderheiten und ihrer Eigenschaft als kleine Verwandte der Elefanten bieten die Schliefer Stoff für die Zoopädagogik. Anhand der Baumschliefer kann zudem über die Problematik des Buschfleischhandels und die zunehmende Zerstörung der Wälder Afrikas informiert werden. Allerdings sind die nachtaktiven Baumschliefer sehr viel seltener in europäischen Zoos zu sehen als die tagaktiven Klipp- oder Buschchliefer. Körperbau und KörperfunktionenWestliche Baumschliefer haben eine Kopf-Rumpflänge von 44-57 cm und wiegen 1.8-4.5 kg. Es gibt kaum einen Unterschied zwischen den Geschlechtern. Das Fell ist dunkelbraun bis schwarzbraun gefärbt, unterseits heller. Es ist kurz und rau. Die Nasenpartie ist praktisch unbehaart und es ist ein kleiner weißer Kinnfleck vorhanden. Der Rückenfleck ist ausgedehnter als beim Südlichen Baumschliefer und seine meist weißen, gelblichen oder ockerfarbenen Haare sind deutlich länger als bei jenem [3; 7]. VerbreitungWest- und Zentralafrika: Angola, Äquatorial-Guinea (Bioko), Elfenbeinküste Gabun, Ghana, Guinea, Kamerun, Kongo, Kongo Dem., Liberia, Nigeria, Sierra Leone, Sudan, Tansania, Uganda, Zentralafrikanische Republik [1]. Lebensraum und LebensweiseDer Westliche Baumschliefer besiedelt hauptsächlich feuchte Wälder des Tieflands und Feuchtsavannen, kommt aber auch in Bergwäldern bis auf eine Höhe von 3'500 m vor. Die Tiere sind dämmerungs- und nachtaktiv, in höheren Lagen teilweise tagaktiv. Sie leben meist einzeln, gelegentlich in Gruppen von 2-3 Individuen. Sie halten sich oft hoch in den Bäumen auf, wo sie sich von Blättern, Zweigen, Früchten und Baumrinde ernähren. Tagsüber schlafen sie in Baumhöhlen, nachts machen sie sich durch laute Rufe bemerkbar. Nach einer Trächtigkeit von etwa 200-220 Tagen werden 1-2 voll behaarte und sehtüchtige Junge mit einem Geburtsgewicht von 180-380 g geboren, die ab dem ersten Lebenstag geschickt klettern können [1; 2; 6]. Gefährdung und SchutzDie Art ist weit verbreitet, hat eine großen Bestand und kommt in zahlreichen Schutzgebieten vor. Aufgrund einer Beurteilung aus dem Jahr 2014 wurde sie deshalb als nicht-gefährdet eingestuft, obwohl keine Informationen über den Bestandstrend vorliegen [1]. Der internationale Handel ist durch CITES nicht geregelt. Bedeutung für den MenschenDie Art wird gebietsweise stark zur Gewinnung von Fleisch und Fellen bejagt. Auf den "Bush meat"-Märkten ist sie stets häufiger zu finden [1]. HaltungÜber die Frühzeit der Baumschlieferhaltung wird berichtet, dass ein Tier, das anfäglich nur schwer zum Fressen zu bringen war, an eine Diät bestehend aus Weißdornblättern, saftigem weichem Gras, Keks in Milchkaffee und in Rotwein getauchtes Brot gewöhnt wurde [3], was heute gewiss nicht als Empfehlung zu verstehen ist. Baumschliefer sind zur Haltung als Heimtiere wenig geeignet. Sie werden zwar zahm und stubenrein, setzen aber Harn als Duftmarke auf Möbelstücken ab und fressen Zimmerpflanzen [4]. Als Höchstalter werden 5 Jahre angegeben, was allerdings nicht der tatsächlichen Lebenserwartung in Menschenobhut entsprechen dürfte, sondern durch die geringe Zahl der Meldungen bedingt ist [5]. Haltung in europäischen Zoos: Im Gegensatz zu Klipp- und Buschschliefern werden Baumschliefer in europäischen Zoos nur sehr selten gezeigt. Dies gilt für beide Arten. Für Details siehe Zootierliste. Mindestanforderungen an Gehege: Im Säugetiergutachten 2014 des BMEL ist die Art nicht erwähnt. Die Schweizerische Tierschutzverordnung (Stand 01.06.2022) schreibt für 1-5 Tier ein Außen- und Innengehege von je 16 m² / 40 m vor. Für jedes weitere Tier kommen jeweil 3 m² zur Basisflächen dazu. Es steht zu vermuten, dass sich die Anforderungen der 2. Tierhaltungsverordnung Österreichs (Stand 2023) nur auf Klipp- und Buschschliefer beziehen, auch wenn das nicht so angegeben ist. Für Baumschliefer wären sie jedenfalls inadäquat. Taxonomie und NomenklaturDie Art wurde 1854 (1855) anhand eines Exemplars von der Insel Bioko von dem englischen Zoologen Louis FRASER als "Hyrax dorsalis" beschrieben. Später kam sie in die von John Edward GRAY vom British Museum in London aufgestellte, neue Gattung Dendrohyrax. Es wurden bisher sechs Unterarten beschrieben [3; 6; 7]. |
Literatur und Internetquellen
- BUTYNSKI, T., DOWSETT-LEMAIRE, F. & HOECK, H. 2015. Dendrohyrax dorsalis. The IUCN Red List of Threatened Species 2015: e.T6410A21282601. http://www.iucnredlist.org/details/6410/0. Downloaded on 25 July 2018.
- GRZIMEK, B. (Hrsg. 1970)
- HAHN, H. (1959)
- PUSCHMANN, W., ZSCHEILE, D., & ZSCHEILE, K. (2009)
- WEIGL, R. (2005)
- WILSON, D. E. et al. eds. (2009-2019)
- <WILSON, D. E. & REEDER, D. M. (2005)
Zurück zu Übersicht Afrotheria
Weiter zu Buschschliefer (Heterohyrax brucei)
Sandtigerhai
Klasse: Knorpelfische (CHONDRICHTHYES)
Teilklasse: Plattenkiemer (ELASMOBRANCHII)
Taxon ohne Rang: Haie (SELACHII)
Überordnung: GALEOMORPHI
Ordnung: Makrelenhaiartige (LAMNIFORMES)
Unterordnung: Orectoloboidei
Familie: Sandtigerhaie (Odontaspididae)

Sandtigerhai
Carcharias taurus • The Sand Tiger Shark • Le requin-taureau
- Körperbau und Körperfunktionen
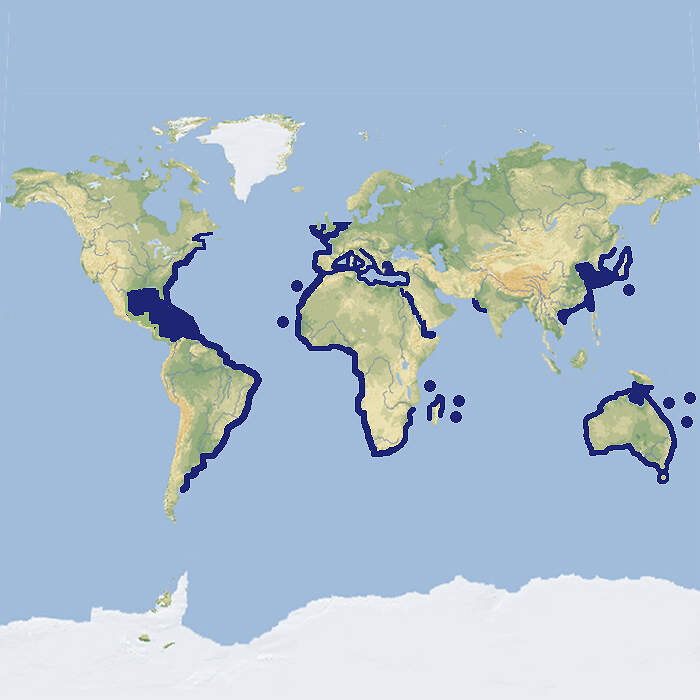
- Verbreitung
- Lebensraum und Lebensweise
- Gefährdung und Schutz
- Bedeutung für den Menschen
- Haltung
- Taxonomie und Nomenklatur
- Literatur und Internetquellen
|
Weitere Bilder auf BioLib.cz |
Der im Freiland gefährdete Sandtigerhai ist eine relativ oft in europäischen Zoos und Schauaquarien zu sehende mittelgroße Haiart. Körperbau und KörperfunktionenDer Sandtigerhai hat eine kurze, spitze Schnauze, kleine Augen, beidseits fünf Kiemenspalten und vorstehende, dornartige Zähne, die in mehreren Reihen angeordnet sind. Die Tiere werden mit einer Länge von rund 220 cm geschlechtsreif und können eine Länge von 350(-430) cm erreichen Mit der gelblichbraunen bis gräulichen Färbung ihrer Oberseite, die oft mit unregelmäßig verteilten braunen Flecken gezeichnet ist, sind sie außerordentlich gut dem sandigen Meerboden angepasst. Der Bauch ist heller [1; 3; 6; 7]. VerbreitungWeltumspannend, vielleicht mit Ausnahme des Ost-Pazifiks: Im Indopazifik vom Roten Meer und der afrikanischen Küste bis nach Japan, Korea und Australien einschließlich der Arafurasee zwischen Neuguinea und Nordaustralien und der Tasmansee. Im West-Atlantik vom Golf von Maine bis Argentinien einschließlich des Karibischen Meers, im Ostatlantik von der europäischen Küste und dem Mittelmeer bis Südafrika, möglicherweise mit Unterbrüchen (widersprüchliche Angaben der einzelnen Quellen) [2; 5; 6]. Lebensraum und LebensweiseDer Sandtigerhai lebt in Bodennähe der Schelfregion in Tiefen bis 200 m. Er erleichtert sein Körpergewicht, indem er Luft schluckt und sie im Magen behält, der so als eine Art Schwimmblase funktioniert. Er schwimmt ständig umher, um seine Sauerstoffversorgung zu gewährleisten, jagt aber hauptsächlich nachts. Er ernährt sich von verschiedenen Bodenfischen, fängt aber auch Tintenfische und Kraken sowie Krebstiere. Er ist lebendgebärend. Die Jungtiere schlüpfen bereits im Uterus und dezimieren sich gegenseitig, sobald der Dottervorrat aufgebraucht ist. Deshalb kommen 8-9 Monate nach der Paarung jeweils nur zwei Jungtiere - aus jedem Utrerushorn eines - zur Welt [3; 7]. Gefährdung und SchutzKommerzielle Fischerei, Sportfischen und das Verbauen von Stränden mit Schutznetzen haben gebietsweise zu einer markanten Abnahme der Bestände geführt. Die Art gilt daher aufgrund einer Beurteilung aus dem Jahr 2005 als gefährdet [5]. Der internationale Handel ist durch CITES nicht geregelt. Zoogestützte Artenschutzprojekte (Beispiele):
Bedeutung für den MenschenIn Europa kommt der Sandtigerhai zwar ins flache Wasser von Badestränden, geift aber keine Menschen an, dies im Gegensatz zur Population in Südafrika, die als für den Menschen sehr gefährlich gilt [3]. Regional, etwa in Japan, ist der Sandtiger ein begehrter Speisefisch. In Australien hat er große Bedeutung in der Sportfischerei [5]. HaltungSandtigerhaie werden gelegentlich in Aquarien gezüchtet, es gibt Zuchtberichte z.B. aus den Jahren 1993 und 1997 [4]. Haltung in europäischen Zoos: Die Art wird in rund 40 europäischen Einrichtungen gezeigt, von denen sich wenige im deutschsprachigen Raum befinden. Für Details siehe Zootierliste. Mindestanforderungen: In Deutschland und Österreich gibt es keine konkreten Mindestnormen. Die "Mindestnormen für das Halten von Fischen zu Zierzwecken" der Schweizerischen Tierschutzverordnung dürften auf Knorpelfische nicht anwendbar sein, jedoch ist für das private Halten von Haien und Rochen eine Bewilligung erforderlich. Taxonomie und NomenklaturDie Art wurde 1810 von dem in Marseille aufgewachsenen, hauptsächlich in den USA tätigen Universalgelehrten Constantine Samuel RAFINESQUE unter ihrem heute noch gültigen Namen erstmals beschrieben [2]. Literatur und Internetquellen
|
Zurück zu Übersicht Fische
Weiter zu Adlerrochen (Myliobatis aquila)
FERGUSON, A. & PEARCE-KELLY, P. (2005)
Captive management of the Frégate Island giant tenebrionid beetle Polposipus herculeanus.
Phelsuma 13: 25-43.
Abstract:
The Frégate Island giant tenebriond beetle Polposipus herculeanus is a Critically Endangered species restricted to Frégate Island, Seychelles. The ex-situ conservation programme at the Zoological Society of London and the European Endangered Species Programme are described. Captive propagation started in 1996 and has been highly successful with the programme holding 980 adult beetles by the end of 2003. Reproductive data is described and the finding of pathological infections of the fungus Metarhizium anisopliae var. anisopliae is discussed.
Giftiger Krötenlaubfrosch
Ordnung: Froschlurche (ANURA)
Unterordnung: Moderne Froschlurche (NEOBATRACHIA)
Familie: Laubfrösche (Hylidae)
Unterfamilie: Eigentliche Laubfrösche (Hylinae)

Giftiger Krötenlaubfrosch
Trachycephalus venulosus = typhonius • The Veined Tree Frog • La rainette réticulaire
- Körperbau und Körperfunktionen
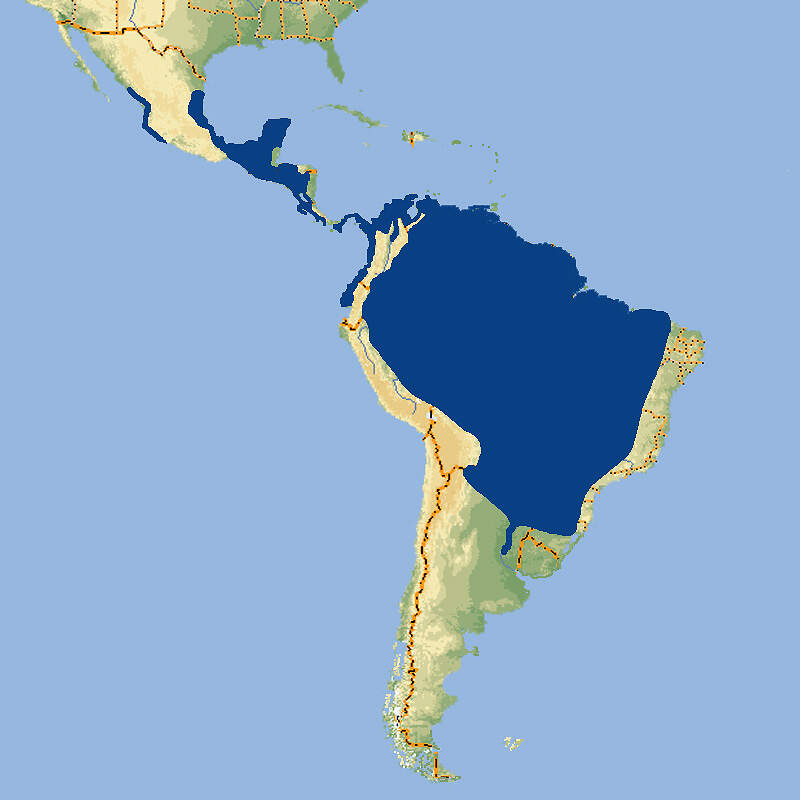
- Verbreitung
- Lebensraum und Lebensweise
- Gefährdung und Schutz
- Bedeutung für den Menschen
- Haltung
- Taxonomie und Nomenklatur
- Literatur und Internetquellen
|
Weitere Bilder auf BioLib
|
Mit seinem kurzen Kopf und den großen Augen entspricht der Giftige-Krötenlaubfrosch dem Kindchenschema. Er wirkt so als Sympathieträger, der sich gut als Botschafterart für den Amphibienschutz und den Schutz der südamerikanischen Regenwälder eignet, wurde in dieser Funktion aber weitgehend vom Baumhöhlen-Krötenlaubfrisch abgelöst und ist aus europäischen Zoos weitgehend verschwunden. Körperbau und KörperfunktionenJe nach Herkunft variieren die Zeichnungsmuster sehr stark und die Körpergröße schwankt populationsabhängig zwischen 60 und 114 mm bei den Weibchen und 58-101 mm bei den Männchen, was damit zusammenhängen könnte, dass es sich beim Giftigen Krötenlaubfrosch möglicherweise gar nicht um eine Art, sondern um einen Artkomplex handelt [4]. VerbreitungVon Südmexiko hinunter bis Nordargentinien: Argentinien, Belize, Bolivien, Brasilien, Costa Rica, Ekuador, El Salvador, Französisch Guiana, Guatemala, Guyana, Honduras, Kolumbien, Mexiko, Nikaragua, Panama, Paraguay, Peru, Surinam, Trinidad und Tobago, Venezuela [5]. Lebensraum und LebensweiseDie Art kommt in Primärwald, Sekundärwald, Savanne und Kulturland vom Flachland bis auf 2'400 Höhenmeter vor. Die Paarung erfolgt in temporären Tümpeln, Bächen oder Pfützen in Astgabeln. Das Weibchen legt bis zu 3'000 Eier ins Wasser, die einen Oberflächenfilm bilden. Die Larven schlüpfen nach einem Tag. Bis zur Metamorphose, die nach 42 Tagen erfolgt, werden sie bis zu 49 mm lang [3]. Gefährdung und SchutzDie Art ist weit verbreitet, häufig und hat einen anscheinend stabilen Bestand, obwohl viele Populationen unter Lebensraumverlust leiden. Nach einer Beurteilung aus dem Jahr 2009 gilt sie daher nicht als gefährdet [5]. Der internationale Handel ist durch CITES nicht geregelt. Bedeutung für den MenschenWie ihr Name sagt, können Giftige Krötenlaubfrösche aus ihren Hautdrüsen große Mengen eines stark giftigen Schleims ausscheiden, wenn sie bedroht, also z.B. in die Hand genommen werden. Das Gift ist nicht nur stark schleimhautreizend, sondern es kann beim Menschen auch zu Hautrötungen oder -schwellungen und damit verbundenen Schmerzen führen [4]. HaltungHaltung in europäischen Zoos: Bis vor ein paar Jahren war die Art in mehreren deutschen Zoos zu sehen. Heute wird sie nur noch in ganz wenigen europäischen Einrichtungen gezeigt. Für Details siehe Zootierliste. Mindestanforderungen an Gehege: In Deutschland gibt es keine konkreten Mindestanforderungen. In Österreich sind diese in Anlage 4 der 2. Tierhaltungsverordnung, in der Schweiz in Anhang 2, Tabelle 6 der Tierschutzverordnung festgelegt. Wie Krötenlaubfrösche gehalten werden (Beispiel): Vivarium im Tierpark Chemnitz siehe ZOOLEX Gallery. Taxonomie und NomenklaturDie Krötenlaubfrösche wurden im Lauf der Zeit allen möglichen Gattungen zugeordnet: Acrodytes, Argenteohyla, Hyla, Hypsiboas, Rana, Scytopis und zuletzt Phrynohyas. Heute wird die Gattung Trachycephalus genannt, sie umfasst mittlerweile 16 Arten [1; 2]. Der Giftige Krötenlaubfrosch wurde 1758 von Carl von LINNÉ als "Rana typhonia" beschrieben. Der Artname venulosus geht auf das Jahr 1768 zurück und war bis 2010 gültig. Dann wollten LAVILLA et al. (2010) herausgefunden haben, dass Carl von LINNÉ 1758 mit seiner Rana typhonia weder eine Kröte, noch einen asiatischen Frosch, sondern einen südamerikanischen Laubfrosch, eben den Giftigen Krötenlaubfrosch gemeint habe [1; 6]. Über die Sinnhaftigkeit, einen Namen zu ersetzen, der 242 Jahre in Gebrauch war, der in hunderten von Publikationen und auf ungezählten Zoo-Namensschildern zu finden ist, mag man streiten. Jedenfalls lautet die offizielle Artbezeichnung jetzt typhonius. Der frühere wissenschaftliche Name Phrynohyas venulosa wird aber immer noch gelegentlich verwendet. Literatur und Internetquellen
|
Zurück zu Übersicht Laub-, Ried- und Beutelfrösche
Tigerotter
Ordnung: Schuppenkriechtiere (SQUAMATA)
Unterordnung: Schlangen (SERPENTES)
Überfamilie: Nattern- und Vipernartige (Colubroidea oder Xenophidia)
Familie: Giftnattern (Elapidae)
Unterfamilie: Echten Giftnattern (Elapinae)

Gewöhnliche Tigerotter
Notechis scutatus • The Tiger Snake • Le serpent-tigre
- Körperbau und Körperfunktionen
- Verbreitung
- Lebensraum und Lebensweise
- Gefährdung und Schutz
- Bedeutung für den Menschen
- Haltung
- Taxonomie und Nomenklatur
- Literatur und Internetquellen
|
Weitere Bilder auf BioLib.cz |
Die Tigerotter ist eine relativ kurze, etwas plumpe Giftschlange aus dem Süden Australiens, die in europäischen Zoos nur ausnahmsweise zu sehen ist. Körperbau und KörperfunktionenTigerottern werden meist etwa 1.20 m, gelegentlich bis 1.50 m lang. Sie sind kräftig gebaut, der Kopf ist kaum vom Hals abgesetzt. die Augen sind klein mit runder Pupille. Die Färbung ist sehr variabel, von hellgrau über rotbraun bis olivgrün, oft mit mehr oder weniger deutlichen hellen Querbändern. Die Unterseite ist gelb. Es gibt auch ganz schwarze Exemplare [3: 4; 6]. VerbreitungSüden und Südosten Australiens: New South Wales, Queensland, Südaustralien, Tasmanien, Westaustralien [1; 2]./span> Lebensraum und LebensweiseDie Tigerotter lebt in der Nähe von Wasserläufen, etwa in Galeriewäldern, oder auf Inseln. Sie ernährt sich hauptsächlich von Amphibien, gelegentlich von Echsen, Kleinsäugern und allenfalls Jungvögeln. Die Art ist ovovivipar. Die Würfe umfassen 10-90(-107) Junge, die bei der Geburt etwa 25 cm lang sind [2; 3; 4]. Gefährdung und SchutzEinzelne Populationen sind zwar durch intensivierte landwirtschaftliche Nutzung gefährdet. Für die Art insgesamt, die eine weite Verbreitung und einen großen Gesamtbestand hat, trifft die nach einer Beurteilung aus dem Jahr 2010 aber nicht zu [2]. Der internationale Handel ist unter CITES nicht geregelt. Es gelten Ausfuhrbeschränkungen Australien. Bedeutung für den MenschenIn Südaustralien wird ein großer Teil der Todesfälle durch Schlangenbiss durch Tigerottern verursacht [3]. HaltungDie Tigerotter gehört zu den "Gefahrtieren", deren Haltung in manchen deutschen Bundesländern unter sicherheitspolizeilichen Aspekten eingeschränkt oder geregelt ist.Die Deutsche Gesellschaft für Herpetologie und Terrarienkunde (DGHT) und der Verband Deutscher Verein für Aquarien- und Terrarienkunde (DVA) haben zu dieser Thematik einen Leitfaden herausgegeben [7]. Haltung in europäischen Zoos: Die Art wird in Europa nur sporadisch gezeigt, nach 2010 gar nicht mehr. Für Details siehe Zootierliste. Mindestanforderungen an Gehege: Die Art ist weder im Reptiliengutachten 1997 des BMELF, noch in der Schweizerischen Tierschutzverordnung (Stand 01.06.2022) oder der 2. Tierhaltungsverordnung Österreichs (Stand 2023) erwähnt. Taxonomie und NomenklaturDie Art wurde 1861 von Wilhelm PETERS, der ab 1857 Direktor des Zoologischen Museums Berlin und ab demselben Jahr bis 1869 Direktor des Zoologischen Garten Berlin war, als "Naja (Hamadryas) scutata" beschrieben. Der heute gültige Name wurde 1896 von dem am British Museum tätigen belgischen Zoologen George Albert BOULENGER vergeben [6]. |
Literatur und Internetquellen
- ATLAS OF LIVING AUSTRALIA
- COGGER, H. (2010). Notechis scutatus. The IUCN Red List of Threatened Species 2010: e.T169687A6666605. http://www.iucnredlist.org/details/169687/0. Downloaded on 05 October 2017.
- MEHRTENS, J. M. (1993)
- O'SHEA, M. & HALLIDAY, T. (2002)
- THE REPTILE DATA BASE
- WILSON, S. & SWAN, G. (2013)
- DGHT/DVA (Hrsg. 2014)
Zurück zu Übersicht Schlangen
Weiter zu Östliche Braunschlange (Pseudonaja textilis)
DAUDIN, F. M. (1802-05)
Histoire naturelle, générale et particulière, des reptiles.
Ouvrage faisant suite à l'Histoire naturelle générale et particulière, composée par Leclerc de Buffon, et rédigée par C.S. Sonnini.
Tome 1 - 8 . Imprimerie de F. Dufart, Paris
DAUDIN's Naturgeschichte der Reptilien, die im Rahmen der Sonnini-Ausgabe von Buffon´s Naturgeschichte herausgegeben wurde, galt als Standardwerk und zu seiner Zeit vollständigstes Werk über Reptilien. Er beschrieb darin nach eigenen Angaben 517 Arten basierend auf 1100 Exemplaren, darunter einige Erstbeschreibungen. Das waren dreimal mehr Arten als in dem zuvor erschienenen Werk von Bernard Germain Lacépède.
Buschbock
Überordnung: LAURASIATHERIA
Taxon ohne Rang: CETARTIODACTYLA
Ordnung: Paarzeher (ARTIODACTYLA)
Unterordnung: Wiederkäuer (Ruminantia)
Familie: Hornträger (Bovidae)
Unterfamilie: Echte Rinder (Bovinae)
Tribus: Afrikanische Waldböcke (Tragelaphini)

Buschbock oder Schirrantilope
Tragelaphus scriptus • The Bushbuck • Le guib harnaché
- Körperbau und Körperfunktionen
- Verbreitung
- Lebensraum und Lebensweise
- Gefährdung und Schutz
- Bedeutung für den Menschen
- Haltung
- Taxonomie und Nomenklatur
- Literatur und Internetquellen
|
Weitere Bilder auf BioLib.cz |
Der Buschbock ist eine kleinere, äußerst attraktive Antilope mit deutlichem Sexualdimorphismus, die sowohl für das allgemeine Publikum als auch für die Zoopädagogik interessant wäre, die aber als weit verbreitete, nicht gefährdete Art vom Europäischen Zoo- und Aquarienverband als nicht prioritör eingestuft wurde und daher in den Zoos mittlerweile ausgestorben ist. Körperbau und KörperfunktionenDer Buschbock ist der kleinste der afrikanischen Waldböcke. Er zeigt einen stark ausgeprägten Sexualdimorphismus. Die Böcke erreichen eine Kopf-Rumpflänge von 114-150 cm, eine Schulterhöhe von 80 (65-100) cm und ein Gewicht von 40-80 kg. Die Ricken werden bis 132 cm lang, 70 (61-85) cm hoch und 24-60 kg schwer. Der Schwanz wird etwa 19-24 cm lang. Wie bei den anderen afrikanischen Waldböcken haben die Böcke schraubenartig gedrehte Hörner, die 40-55 cm lang werden können. Das Fell zeigt bei beiden Geschlechtern ein auffallendes Muster weißer Punkte und Streifen, wobei es erhebliche regionale Unterschiede gibt. An der Halsunterseite verlaufen 1-2 weiße Querbänder, die Schwanzunterseite ist weiß, die Schwanzspitze kann schwarz sein. Die Beine können je nach Unterart einfarbig sein oder eine weiß oder schwarzweiße Zeichnung aufweisen. Die Grundfarbe ist regional variabel, bei den Ricken meist rotbraun, bei den Böcken etwas dunkler, kastanienbraun oder schwarzgrau [2; 5; 8]. VerbreitungAfrika südlich der Sahara: Angola, Äquatorialguinea, Äthiopien, Benin, Botswana, Burkina Faso, Burundi, Elfenbeinküste, Gabun, Gambia, Ghana, Guinea, Guinea-Bissau, Kamerun, Kenia, Kongo, Kongo Dem., Liberia, Malawi, Mali, Mauretanien, Mosambik, Namibia, Niger, Nigeria, Ruanda, Sambia, Senegal, Sierra Leone, Simbabwe, Somalia, Südafrika, Südsudan, Sudan, Swasiland, Tansania, Togo, Tschad, Uganda, Zentralafrikanische Republik [4]. Lebensraum und LebensweiseBuschböcke benötigen Lebensraum mit viel Deckung. Sie kommen in Tropischen Regen- und Feuchtwäldern, Subtropischen Feuchtwäldern, und Gemäßigten immergrünen Feuchtwäldern, jeweils vorzugsweise an Waldrändern, Galeriewäldern, Trockenwäldern, Dornsavannen, Dickichten und Zuckerrohrpflanzungen vor. Die Nahrung dieser Selektiväser besteht überwiegend aus Blättern und Zweigen, aber auch zarte Gräser werden genommen. Buschböcke leben solitär, sind aber nicht territorial, sondern haben überlappende Streifgebiete [5; 8]. Es gibt keine definierte Fortpflanzungsperiode, allenfalls saisonale Spitzen der Brunftaktivitäten und der Geburten. Nach einer Tragzeit von rund 180 Tagen wird in der Regel ein einzelnes Kitz mit einem Gewicht von 3.1-4.5 kg geboren. Angaben über das Erreichen der Geschlechtsreife sind widersprüchlich. Bei Ricken dürfte dies mit etwa 1 Jahr der Fall sein, bei Böcken mit 1.5 Jahren, wobei sie effektiv meist erst mit 3 Jahren zur Forspflanzung kommen [5; 6; 8]. Gefährdung und SchutzDer Buschbock hat eine sehr weite Verbreitung und einen geschätzten Bestand von 1 bis 1.5 Millionen Adulttieren, der als stabil angesehen wird, außer in vom Menschen dicht besiedelten Regionen. Möglicherweise ist diese Schätzung wegen der heimlichen Lebensweise des Buschbocks zu tief. Er gilt daher seit 1996 als nicht gefährdet (Rote Liste: LEAST CONCERN) , was im Rahmen einer Beurteilung aus dem Jahr 2016 bestätigt wurde. Der Klimawandel macht der Art in den trockeneren Teilen ihres Areals zu schaffen, andererseits kann sie ihre Verbreitung im Gebiet der Regenwälder ausdehnen [4]. Der internationale Handel ist nicht unter CITES geregelt. Die Einfuhr lebender Exemplare aus den Ursprungsländern ist wegen der restriktiven Veterinärbestimmungen der EU so gut wie ausgeschlossen. Bedeutung für den MenschenDer Buschbock wird zur Gewinnung von Fleisch und als Sport gejagt. In Ruanda ist sein Fleisch deutlich billiger als jenes von Nutztieren und dementsprechend ist der Buschbock die häufigste Wildtierart, die auf Fleischmärkten angeboten wird. Im Rahmen der Sportjagd werden in Südafrika "Trophy Fees" von etwa 1'200-1'500 USD fällig, in anderen afrikanischen Ländern 400-1'100 USD. HaltungIn den 1950er Jahren wurde im Zoo Basel ein Buschbock kurze Zeit gemeinsam mit Sitatungas und Vierhornantilopen gehalten, um 1990 in Hannover gemeinsam mit Kirk-Dikdiks. Eine Gemeinschaftshaltung mit Sitatungas sollte sollte wegen der Gefahr der Bastardierung tunlichts vernieden werden Als Höchstalter gibt WEIGL über 15 Jahre und 3 Monate für ein im Ruhr-Zoo Gelsenkirchen geborenes und später in Hannover gehaltenes gehaltenes weibliches Tier an [7]. Haltung in europäischen Zoos: Die Art ist dem Collection Planning der EAZA zum Opfer gefallen und wird heute nicht mehr gehalten. Die britische (europäische?) Erstzucht gelang 1841 in der Menagerie des Earl of Derby in Knowsley (heute Safaripark). Der letzte Hinweis auf eine Nachzucht in Europa im International Zoo Yearbook bezieht sich auf das Jahr 1991 (Zoo Hannover). Bei den in Europa gehaltenen Tiere handelte es sich hauptsächlich um Senegal-Buschböcke, die z.B. in Hannover 31 Jahre lang gehalten und regelmäßig gezüchtet wurden, seltener um Kap-Buschböcke. Andere Unterarten waren Ausnahmeerscheinungen. Für Details siehe Zootierliste. Mindestanforderungen an Gehege: Nach Säugetiergutachten 2014 des BMEL soll für bis zu 5 Tieren ein Gehege von mindestens 200 m² zur Verfügung stehen. Für jedes weitere Tier kommen 20 m² zur Basisfläche dazu. Zudem wird ein Stall von etwa 3 m²/Tier vorgegeben. Die Schweizerische Tierschutzverordnung (Stand 01.06.2022) schreibt für theoretisch bis zu 10 Tieren ein Gehege mit Trenn- oder Absperrmöglichkeit vor, dessen Grundfläche 500 m² misst. Für jedes weitere Tier kommen 40 m² zur Basisfläche dazu. Ferner ist ein Stall mit einer Fläche von 4 m²/Tier erforderlich. Nach der 2. Tierhaltungsverordnung Österreichs (Stand 2023) ist für 1-5 Tiere ein Außengehege von 500 m² erforderlich, für jedes weitere 50 m² mehr. Zudem ist ein beheizter Stall mit einem Mindestausmaß von 4 m² pro Tier mit einer Mindesttemperatur von 10°C vorgeschrieben. Die Haltung hat in Gruppen mit einem erwachsenen Männchen, mehreren Weibchen und deren Nachwuchs zu erfolgen. Taxonomie und NomenklaturDer Buschbock wurde 1766 vom Berliner Naturforscher Peter Simon PALLAS, den Katharina die Große als Professor nach Petersburg berufen hatte, als "Antilope scripta" anhand eines Exemplars aus dem Senegal erstmals wissenschaftlich beschrieben. 1816 stellte ihn der französische Zoologe Henri Marie Ducrotay de BLAINVILLE als Typusart in die neue Gattung Tragelaphus. Traditionell wurde die Art in über 20 (bis etwa 40) Unterarten aufgeteilt. 2005 waren es noch 9. GROVES & GRUBB splitteten in ihrer umstrittenen Huftier-Taxonomie den Buschbock in 8 Arten auf, was Eingang in das Handbuch der Säugetiere fand, aber von der IUCN im Rahmen der Roten Liste nicht mitgemacht wurde [1; 3; 4, 8; 9].
|
Literatur und Internetquellen
- GROVES, C.P. & GRUBB, P. (2011)
- GRZIMEK, B. (ed., 1970)
- HALTENORTH, T. & TRENSE, W. (1956)
- IUCN SSC Antelope Specialist Group 2016. Tragelaphus scriptus (errata version published in 2017). The IUCN Red List of Threatened Species 2016: e.T22051A115165242. http://dx.doi.org/10.2305/IUCN.UK.2016-3.RLTS.T22051A50196111.en. Downloaded on 24 March 2019.
- MILLS, G & HES, L. (1999)
- PUSCHMANN, W., ZSCHEILE, D., & ZSCHEILE, K. (2009)
- WEIGL, R. (2005)
- WILSON, D. E. et al. eds. (2009-2019)
- WILSON, D. E. & REEDER, D. M. (2005)

Weiblicher Buschbock Tragelaphus scriptus sylvaticus) in seinem natürlichen Lebensraum im Pilanesberg-Nationalpark © Peter Dollinger, Zoo Office Bern
Zurück zu Übersicht Paarzeher
Weiter zu Sitatunga (Tragelaphus spekii)