Grosser Streifenbeutler
 |
Neue Tierart
|
Unterklasse: Beuteltiere (MARSUPIALIA)
Ordnung: Känguruverwandtschaft (DIPROTODONTIA)
Unterordnung: Kuskusse und Gleitbeutler (Phalangeriformes)
Familie: Gleitbeutler (Petauridae)

Großer Streifenbeutler
Datylopsila trivirgata • The Striped Possum • Le phalanger au pelage rayé
- Körperbau und Körperfunktionen
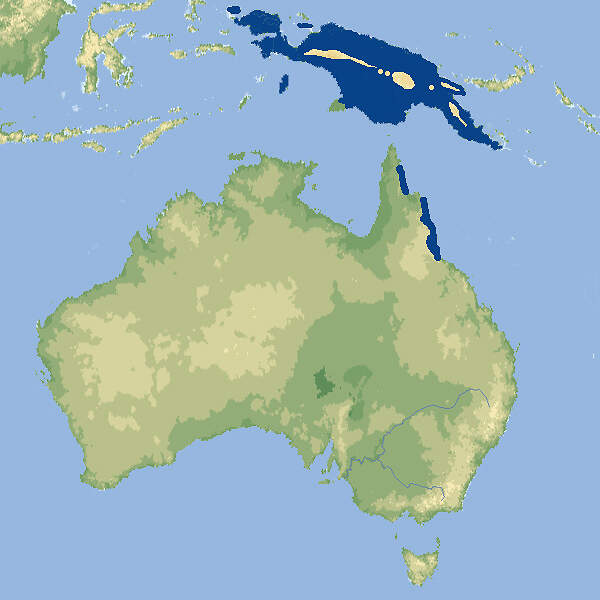
- Verbreitung
- Lebensraum und Lebensweise
- Gefährdung und Schutz
- Bedeutung für den Menschen
- Haltung
- Taxonomie und Nomenklatur
- Literatur und Internetquellen
|
Weitere Bilder auf BioLib |
Der Große Streifenbeutler gehört zu den mittelgroßen Arten der Gleitbeutler-Familie. Es handelt sich um eine nicht-gefährdete, nachtaktive Art, die in europäischen Zoos stets selten war und seit einigen Jahren nicht mehr gehalten wird, obwohl sie wegen ihrer Konvergenz zum Aye-Aye von zoopädagogischem Interesse ist Körperbau und KörperfunktionenGroße Streifenbeutler haben eine Kopf-Rumpfläng von 24-28 cm, der Schwanz ist mit 32.39 cm deutlich länger. Männchen wiegen 428-545 g und Weibchen 310-475 g. Das Fell weist eine schwarz-weiße oder schwarz-graue Längsstreifung auf. Der Schwanz ist grau-schwarz und längst nicht so buschig wie bei dem in etwa gleichgroßen Buschschwanz-Streifenbeutler (D. megalura). Die Weibchen haben in ihrem Beutel zwei Zitzen. Die Tiere haben einen äußerst unangenehmen Eigengeruch. Verschiedene Merkmale stellen eine konvergente Entwicklung zum Fingertier dar: Die Schneidezähne sind vergrößert, die oberen nach vorn gerichtet und die unteren stark verlängert, die Finger sind praktisch unbehaart, und der vierte Finger ist verlängert. Dies ermöglicht den Tieren, Löcher in die Baumrinde zu bohren und die darunter befindlichen Insektenlarven herauszuangeln [1; 6]. VerbreitungAustralasien: Indonesien (West-Papua, Aru-, Waigeo- und Yapen-Inseln), Papua-Neuguinea und Australien (Queensland) [3]. Lebensraum und LebensweiseGroße Streifenbeutler sind Baumbewohner, die primäre und sekundäre Feuchtwälder sowie angrenzende Eukalyptus- und Teebaum-Savannen (Melaleuca alternifolia) vom Meersspeigel bis auf eine Höhe von 2'300 m besiedeln. Sie sind nachtaktiv und schlafen tagsüber in Nestern aus Blättern, die in Baumhöhlen oder in Gewirren von Lianen angelegt werden. Sie leben außerhalb der Paarungszeit solitär bzw. in Mutterfamilien. Die Tiere können weite Sprünge von Baum zu Baum durchführen [1; 4; 6]. Große Streifenbeutler ernähren sich in erster Linie von Insekten, wie Ameisen, Termiten, Käfern, Grillen oder Schmetterlingen, daneben nehmen sie in geringem Umfang Baumsäfte, Pollen, Blütennektar und Früchte zu sich. Es gibt keine eigentliche Fortpflanzungsperiode, jedoch kommt es von März-Juni gehäuft zu Geburten. In Neuguinea wurden Paarungen von Januar-Oktober beobachtet. Die Weibchen bringen in der Regel einen Wurf mit (1-)2 Jungen pro Jahr zur Welt [1; 2]. Gefährdung und SchutzDer Große Streifenbeutler gilt trotz negativem Bestandstrend aufgrund einer Beurteilung aus dem Jahr 1996, letztmals überprüft 2016, nicht als gefährdet (Rote Liste: LEAST CONCERN), weil er weitverbreitet ist, mutmaßlich eine große Gesamtpopulation hat, in etlichen Schutzgebieten vorkommt, unterschiedliche Lebensräume nutzen kann und auch in veränderten, degradierten Lebensräumen leben kann [4]. Der internationale Handel ist nicht unter CITES geregelt. Für lebende Tiere gelten Ausfuhrbeschränkungen Australiens. Die nach Europa eingeführten Tiere stammten, soweit bekannt, aus Neuguinea (West-Papua). Bedeutung für den MenschenGroße Streifenbeutler werden von der indigenen Bevölkerung Neuguineas zur Fleisch- und Pelzgewinnung gejagt. Die Pelze werden für kulturelle Rituale verwendet [1; 4]. HaltungNach JACKSON soll für ein Paar Tiere eine Gehegefläche von 9 m² bei einer Höhe von 3 m nicht unterschritten werden, für jedes weitere Tier soll 4 m² Bodenfläche zusätzlich angeboten werden [2]. Der älteste bekannte Große Streifenbeutler in einem Zoo wurde im Londoner Zoo geboren und starb ebendort im Alter von 9 Jahren und 7 Monaten [5]. Haltung in europäischen Zoos: Die Art war in Zoos stets selten, Nachzuchten waren die Ausnahme, und 2020 starben die beiden letzten Tiere im Zoo von Jihlava / Iglau. Für Details siehe Zootierliste. Mindestanforderungen an Gehege: Nach Säugetiergutachten 2014 des BMEL soll das Gehege für 1 -2 Tiere eine Mindestfläche von 6 m² bei einer Höhe von 2 m messen. Für jedes weitere Tier soll die Grundfläche angemessen (um ca. 0.6 m²) erhöht werden. Die Tierschutzverordnung der Schweiz schreibt für 6 Tiere ein Innengehege von 6 m² bei 2 m Höhe vor. Für jedes weitere Tier wird 1 m² Fläche zusätzlich verlangt. Die 2. Tierhaltungsverordnung Österreichs verlangt für ein Paar ein Innengehege von 2 m² bei 3.5 m Höhe. Für weitere Tiere werden keine Vorgaben gemacht. Taxonomie und NomenklaturDie Art wurde 1858 von John Edward GRAY vom British Museum in London unter ihrem heute noch gültigen Namen erstmals wissenschaftlich beschrieben. Sie ist die Typusart der Gattung Dactylopsila, die heute fünf Arten umfasst. Gegenwärtig werden 4 Unterarten anerkannt [6]. Der Gattungsname bezieht sich auf die beinahe unbehaarten Finger der Tiere (δάκτυλος = Finger, ψιλός = kahl). |
Literatur und Internetquellen
- ANIMAL DIVERSITY WEB
- JACKSON, S. M. (2003)
- PUSCHMANN, W., ZSCHEILE, D., & ZSCHEILE, K. (2009)
- SALAS, L. et al. (2016). Dactylopsila trivirgata. The IUCN Red List of Threatened Species 2016: e.T6226A21960093. https://dx.doi.org/10.2305/IUCN.UK.2016-2.RLTS.T6226A21960093.en. Accessed on 18 April 2023..
- WEIGL, R. (2005)
- WILSON, D. E. et al. eds. (2009-2019)
Zurück zu Übersicht Kloaken- und Beuteltiere
MYSŁAJEK, R. W., STACHYRA, P., FIGURA, M. & NOWAK, S. (2021)
Food habits of the Eurasian lynx Lynx lynx in southeast Poland.
J. of Vertebrate Biology, 71(21061):21061.1-7 (2021). https://doi.org/10.25225/jvb.21061
Abstract:
We studied diet and prey preferences of the Eurasian lynx (Lynx lynx) inhabiting south-east Poland, based on kills found during GPS-GSM telemetry and opportunistic winter tracking. Among 64 lynx kills were roe deer (Capreolus capreolus) (91%), red deer (Cervus elaphus) (3%) and brown hare (Lepus europaeus) (6%). From the ungulate community, lynx selected roe deer (D = 0.845) and avoided all other ungulates. We recorded one case of surplus and two cases of parallel killing. Lynx visited the same killed roe deer on average for 2.3 days, and for up to six days when surplus or parallel killing occurred. High numbers of the roe deer in south-east Poland supports the persistence of the lynx, but we urge managers to take under consideration food requirements of the lynx when planning game management.
myslajek-biblio
YATES, A. M. (2015)
Thylacinus (Marsupialia: Thylacinidae) from the Mio-Pliocene boundary and the diversity of Late Neogene thylacinids in Australia.
PeerJ. 2015; 3: e931. Published online 2015 May 12. doi: 10.7717/peerj.931
Abstract:
Thylacinus yorkellus is described as a new, moderately small-bodied species of thylacinid from the latest Miocene or, more likely, earliest Pliocene of South Australia. The new species can be diagnosed by the autapomorphic presence a strongly developed precingulid that terminates in a cuspidule on the anterobuccal face of the paraconid of the lower molars and a tiny basal anterior cuspidule on P2, P3 and the lower molars. It is found by cladistic analysis to be the sister species of the recently extinct Th. cynocephalus and distinct from the approximately coeval Th. megiriani from the Northern Territory. New dentary material is described and referred to Th. megiriani. These add character data and allow this species to be re-diagnosed based on autapomorphic character traits. Each of the three known late Miocene to early Pliocene Thylacinus species (Th. potens, Th. megiriani and Th. yorkellus) suggest that, instead of declining, there was a modest radiation of Thylacinus in the late Miocene.
yates-biblio
BIROT, H., NOWAKOWSKI, A-, PETRY, A., BRANDO, S. & QUINTARD, B. (2022)
EAZA Best Practice Guidelines YELLOW-FOOTED ROCK WALLABY (Petrogale xanthopus).
Hrsg: Zoo Mülhausen im Elsass. 93 Seiten.
Summary:
Endemic from Australia, the yellow-footed rock wallaby(YFRW) is listed as Near Threatened (IUCN, 2016) because its habitat is fragmented and declining (probably not much greater than 20,000 km²) and its population is likely to be less than 10,000 mature individuals. Due to its IUCN status, YFRWs are under intensive level of management under an Ex-situ Programme (EEP) in European zoos. The purpose of this programme is to secure a genetically healthy and sustainable captive population which may serve as a backup population for the wild. This species is closely followed-up by the Australian government and deep cooperative conservation efforts are implemented between the EEP and the Australian government. It is an Ambassador Agreement (AA) species and the Department of the Environment and Water Resources (DEW) of Australia ensures that all holding institutions meet the husbandry and management requirements for the species, following their own Australian Animal Welfare Standards and Guidelines. These Best Practice Guidelines combine all our current knowledge about general biology and husbandry requirements to provide a high level of well-being for YFRWs in captivity. It is addressed to YFRWs holders to get the most up to date knowledge on housing this emblematic species in the appropriate and best possible way, and for future holders which should be prepared to offer to the animals optimal housing and care. Regularly consulting the Guidelines and sharing them with all staff members (especially keepers!) is recommended. Holders are advised to contact TAG members with any concerns or queries about YFRWs husbandry.
Section 1. Biology and Field Data reflects our current knowledge of this species in the natural environment using the most recent taxonomic information. The philosophy behind this is that ex-situ conservation can be used more effectively as a conservation tool if it is part of an integrated approach to species conservation (IUCN, 2014). The potential need for a conservation role of an EAZA ex-situ population has therefore been decided in consultation with in-situ specialists. This section provides wide and actual information.
Section 2. Management in Zoos covers housing and exhibition, nutrition, food presentation, welfare and enrichment, social structure, behaviour, and veterinary care. This part was written relying on one survey realized in March-April 2021 among all the 10 European institutions housing YFRWs. Control of breeding is an essential component of successful managed programmes and comprehensive information to assist zoo veterinarians to decide on the most appropriate contraception method for their animals is provided. Managed programmes rely on control of breeding and movement of animals between zoos. This document provides advice on birth control, handling, and transportation. A comprehensive veterinary section provides information on current knowledge on all aspects ofmedical care. It is essential that YFRWs are provided with complex environments and there is detailed practical information on environmental enrichment and medical training.
Section 3: References & Appendices includes, amongst other documents, a summary of references to each section and examples of appropriate YFRWs diet provided in different EEP institutions.
birot-biblio
SCHÜRER, U. (2019)
Zur Geschichte der Baumkänguru-Haltung in europäischen und einigen anderen Zoos.
BULETTE Berlin 7: 7-45.
Zusammenfassung:
Es wird über die frühe Haltung von Baumkängurus in Zoologischen Gärten berichtet in einem Zeitraum, der nicht oder nicht vollständig von den Listen des International Zoo Yearbook und der Internationalen Zuchtbücher bzw. vom Zoological Information Management System (ZIMS) erfasst ist. Bei der Verwendung von Angaben, die von Haltern z. B. an das International Zoo Yearbook gemacht worden sind, ist wegen häufiger Fehlbestimungen Vorsicht geboten. Sie waren nicht alle brauchbar. Insgesamt ist das Wissen über viele Kängurus aus Neuguinea lückenhaft.
Insgesamt sind acht der zehn heute allgemein anerkannten Baumkänguru-Arten gepflegt worden. Leider sind nicht von allen sich selbst erhaltende Zoobestände hervorgegangen. Das lag häufig an unzureichenden Haltungsbedingungen, fehlenden Informationen über das Sozialverhalten der einzelnen Arten und auch an mangelnden Kenntnissen der Zoologischen Gärten in der Baumkänguru-Pflege. Über das Verhalten von D. dorianus, D. matschiei und D. ursinus liegen wenigstens in Zoologischen Gärten angefertigte und publizierte Verhaltenscbeschreibungen vor. Diese Praxis ist heute leider nicht mehr üblich und bedeutet einen vermeidbaren Wissensverlust. Für D. goodfellowi und D. matschiei gibt es heute weltweit koordinierte Zuchtprogramme, für D. goodfellowi sogar ein "Global Management Species Program" GSMP der World Association of Zoos and Aquaria (WAZA).
Zentren der Baumkänguru-Haltung waren besonders der Zoo London, die Zoologischen Gärten von Amsterdam, Rotterdam und Berlin, der San Diego Zoo, die australischen Zoologischen Gärten, besonders Melbourne und Sydney und das Baiyer River Sanctuary in Papua-Neuguinea. Das heute leider nicht mehr bestehende Baiyer River Sanctuary war der einzige Ort, an dem mit drei Baumkänguru-Arten in großem Umfang planmäßige Zucht betrieben wurde. Bei meinem Aufenthalt im Jar 1974 war der Baumkänguru-Bestand dort 16 D. doriae, 21 D. matschiei und 21 D. goodfellowi. Viele der dortigen Nachzuchten sind dank des rührigen Leiters GRAEME G. GEORGE in andere Zoologische Gärten gelangt.
schürer-biblio
DABEK, L. (1994)
The Reproductive Biology and Behaviour of Captive Female Matschie's Tree Kangaroos Dendrolagus matschiei.
PhD Thesis, University of Washington, Seattle, Washington.
Abstract:
All species of tree kangaroos (Dendrolagus spp.) are considered vulnerable or threatened in the wild. Their numbers have been reported to be adversely affected by hunting and habitat destruction in Australia and New Guinea (Martin 1992, Hutchins & Smith 1990, Kennedy 1986, Pernetta & Hill 1986). In captivity, breeding has not sustained viable populations for most species and the reproductive rates of all species are below their potential (Steenberg & Smith 1990). One reason for problems in captive management is a lack of knowledge about Dendrolagus reproductive biology. This genus differs morphologically and behaviorally from the more well known terrestrial kangaroo species.The present study documented both the physiological and behavioral aspects of estrous cycles of captive Dendrolagus matschiei females. The estrous cycle-length data based on steroid hormones were obtained from radioimmunoassay measurements of estrogen and progestin concentrations from fecal samples. This was the first quantitative fecal steroid analysis study on a marsupial species. Behavioral correlates of estrus were measured through focal animal observations. From both of these data sets, hypotheses were tested addressing how this genus fits into the general pattern of marsupial reproduction.The mean ($\pm$ one standard deviation) length of the estrous cycles for captive D. matschiei was 56.83 $\pm$ 3.12 days (n = 6) based on fecal estrogen profiles and 54.17 $\pm$ 5.74 (n = 6) based on fecal progestin profiles. For two of the females, reproductive behaviors occurred at approximately the calculated time of estrus, giving further support to the duration of estrous cycles. Several behavioral indicators of estrus were documented. Two other general patterns emerged from the hormone profiles of the female D. matschiei: (1) A spike of estrogen around the time of ovulation and (2) a rise in progestin after the estrogen peak. D. matschiei seems to have a similar reproductive cycle with several notable differences to those of other known macropodids. The D. matschiei estrous cycle is longer than all other known macropod cycles by at least 10 days. The gestation length of 44.2 days for D. matschiei (Heath et al. 1990) is also longer than any other known macropodid species by at least 6 days. Life history data obtained from captive tree kangaroo historical records showed that D. matschiei has an extended age of female sexual maturity which is later than other macropodids, and that D. matschiei has a reduced fecundity rate. The reason for these differences could be based on D. matschiei's ecological niche. It is an arboreal folivore with a relatively low metabolic rate (McNab 1978) which could result in an overall slower reproductive output.
Volltext verfügbar auf:https://www.researchgate.net/publication/33519504_Reproductive_biology_and_behavior_of_captive_female_Matschie's_tree_kangaroos_Dendrolagus_matschiei
dabek-biblio
GRZIMEK, B. (1975)
Mit Grzimek durch Australien - vierfüßiger Australier. Abenteuer mit Tieren und Menschen des 5. Kontinents.
310 Seiten. Mit 107 Zeichnungen und Fotos, von denen Alan Root 62 für den Verfasser aufnahm.
Kindler Verlag GmbH, München.
Inhalt:
Sprung auf die Känguruhinsel; Großfußhühner erfanden den Brutapparat; Dreimal lernten Neuteltiere das Fliegen; Der Beutelwolf stirbt auf einer fernen Insel; Das Wundertier Känguruh, Unter Paradiesvögeln und Steinzeitmenschen; Säugetiere legen Eier; ferner über Dingo, Wildkaninchen, Beutelteufel, Wombat, Gleibeutler etc.
grzimek-biblio
SCHREINER, C., SCHWARZENBERGER, F., KIRCHNER, W.H. & DRESSEN, W. (2015)
Hormonphysiologische und ethologische Untersuchung am Goodfellow-Baumkänguru (Dendrolagus goodfellowi Thomas, 1908).
Zool. Garten N.F. 84, 45-60.
Abstract:
Currently seven animal species worldwide are managed in Global Species Management Programs (GSMPs). Since 2013 the Goodfellow's tree kangaroo (Dendrolagus goodfellowi) is the first marsupial in this group of species. The primary goal of the GSMP is to enhance the sustainability of the captive population. Reproductive cycles of seven female Goodfellow-tree kangaroo's kept in German zoos were studied during a period of 23 weeks. Faecal samples and behavioural data were collected in order to identify oestrous specific behaviour. Faecal hormone metabolites were analysed using an enzyme-immunoassay for 4-Pregnen-20α-ol-3-one (trivial name: 20α-Progesterone). Faecal hormone metabolites indicated reproductive activity in all females studied, even in a 19 year old individual. The average oestrous cycle was 54.3 ± 1.6 days. During oestrus periods females showed significantly more pouch licking behaviour (p < 0,01), while the breeding male had significantly more interest in females (p < 0,05) indicated by sniffling and vocalization (sound: clicking/“chitching”). Finally this study demonstrates that the applicability of faecal hormone analysis is an adequate method for reproductive monitoring in Goodfellow's tree kangaroos.
schreiner-biblio
Beutelwolf †
Unterklasse: Beuteltiere (MARSUPIALIA)
Ordnung: Raubbeutlerartige (DASYUROMORPHIA)
Familie: Beutelwölfe (Thylacinidae)
Beutelwolf
Thylacinus cynocephalus † • The Thylacine or Tasmanian Tiger • Le loup marsupial
- Körperbau und Körperfunktionen
- Verbreitung
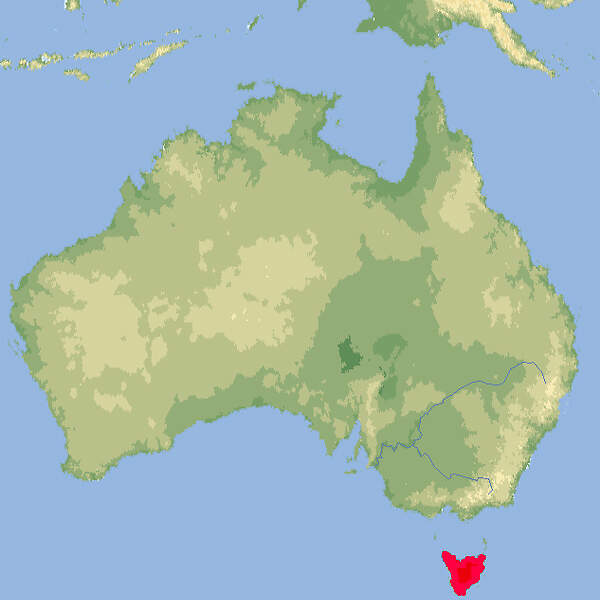
- Lebensraum und Lebensweise
- Gefährdung und Schutz
- Bedeutung für den Menschen
- Haltung
- Taxonomie und Nomenklatur
- Literatur und Internetquellen
|
Weitere Bilder auf BioLib.cz |
Der Beutelwolf war der größte Raubbeutler, der in geschichtlicher Zeit in Australien lebte. Etwa 30 Tiere wurden in europäischen Zoos gehalten, es kam aber zu keiner Zucht. Das letzte bekannte Tier, ein Weibchen, starb 1936 im Zoo von Hobart auf Tasmanien. Körperbau und KörperfunktionenDer in seinem Habitus einem Hund ähnliche Beutelwolf wies eine Kopf-Rumpflänge von 85-118 cm, eine Schwanzlänge von 33-61 cm und ein Gewicht von 15-35(-45) kg auf. Einzelne Individuen sollen noch viel größer gewesen sein. Das kurzhaarige Fell war graubraun, stellenweise ins Gelbliche gehend, und auf dem Rücken und der Schwanzwurzel befanden sich auffällige schwarzbraune Querstreifen, denen das Tier seinen englichen Namen "Tasmanian Tiger" verdankt. Die Weibchen hatten einen nach hinten geöffneten Beutel und vier Zitzen [4]. VerbreitungAustralien: Ehemals Tasmanien. Auf dem australischen Festland vor 2'000 Jahren, auf Neuguinea noch früher ausgestorben [1]. Lebensraum und LebensweiseMit Ausnahme der kühlen Feuchtwälder besiedelten Beutelwölfe alle Lebensräume Tasmaniens. Sie waren hauptsächlich nachtaktiv. Ihre Hauptbeute waren Kängurus und Wallabies, die sie einzeln oder zu zweit jagten [1]. Gefährdung und SchutzAuf der Roten Liste der IUCN ist die Art seit 1982 als ausgestorben aufgeführt [1]. Die Art unterlag Handelsbeschränkungen nach CITES-Anhang I, wurde aber mit Wirkung auf den 12. Juni 2013 aus dem Anhang gestrichen. Bedeutung für den MenschenDer Beutelwolf stand im Ruf, ein Schafräuber zu sein, und wurde deshalb intensiv verfolgt. Als er schon sehr selten war, kam die Sammeltätigkeit für Museen als weiterer, das Aussterben beschleunigender Faktor dazu. Es bestehen hier also Parallelen zum Aussterben des "Lämmergeiers" im Alpenraum [1]. Haltung im ZooIn europäischen Zoos wurden insgesamt etwa 30 Beutelwölfe gehalten, die meisten davon im Londoner Zoo, der erstmals 1850 ein Paar eingeführte. Der nächste traf 1856 aus dem damals „Van Diemen’s Land“ genannten Tasmanien ein [2]. Der letzte starb am 9. August 1931. Im deutschsprachigen Raum wurden zwischen 1864 und 1910 insgesamt 6 Beutelwölfe in den Zoos von Berlin und Leipzig gehalten. Für Details siehe Zootierliste. Lebenserwartung und Zucht: Der älteste bekannte Beutelwolf starb im Alter von 12 Jahren und 6 Monaten im Zoo von Hobart (Tasmanien) [3]. Mindestanforderungen an Gehege: Auch wenn die Art wider Erwarten nicht ausgestorben sein sollte, ist nicht davon auszugehen, dass sie je wieder in Europa gehalten wird. Daher gibt es keine Mindestanforderungen. Taxonomie und Nomenklatur1808 beschrieb der britische Kolonialbeamte George Prideaux Robert HARRIS den Beutelwolf als "Didelphys cynocephalus". Die Gattung Thylacinus wurde 1824 vom ersten Direktor des Leidener Naturkundemuseums, Coenraad Jacob TEMMINCK, im ersten Band seiner "Monographies de Mammalogie" aufgestellt. Es sind keine Unterarten anerkannt [1]. Die aus mindestens 8 Gattungen bestehende Familie der Beutelwölfe entstand im Oligozän, d h. vor rund 30 Millionen Jahren. Das am längsten überlebende Genus, Thylacinus, war, soweit man bis jetzt weiß, eine artenarme Gattung. Eine erste Art, Thylacinus macknessi, ist aus dem frühen Miozän (vor ca. 16 Millionen Jahren) bekannt. Zu Ende des Miozäns und im frühen Pliozän entwickelten sich vier Arten, von denen es nur Th. cynocephalus bis in das Pleistozän und die Jetztzeit schaffte [5]. |
Literatur und Internetquellen
- BURBIDGE, A.A. & WOINARSKI, J. (2016). Thylacinus cynocephalus. The IUCN Red List of Threatened Species 2016: e.T21866A21949291. http://www.iucnredlist.org/details/21866/0. Downloaded on 05 April 2018.
- SCLATER, P. L. (1862 ff). List(s) of the vertebrated animals now or lately living in the gardens of the Zoological Society of London. Printed for the Society; England.
- WEIGL, R. (2005)
- WILSON, D. E. et al. eds. (2009-2019)
- YATES, A. M. (2015)
Zurück zu Übersicht Kloaken- und Beuteltiere
Weiter zu Koala (Phascolarctos cinereus)