BURTON, J., HEDGES, S. & MUSTARI, A. H (2005)
The taxonomic status, distribution and conservation of the lowland anoa Bubalus depressicornis and mountain anoa Bubalus quarlesi.
Mammal Review. 35 (1): 25 - 50.
DOI: 10.1111/j.1365-2907.2005.00048.x
Zusammenfassung:
The anoas are two species of dwarf buffalo, the lowland anoa Bubalus depressicornis and mountain anoa Bubalus quarlesi that are endemic to the island of Sulawesi, Indonesia. The classification of the subgenus Anoa within Bubalus is upheld by assessment of recent genetic and morphological research. The classification of anoas into two species is still debated, but with the absence of significant opposing evidence, this position is adopted here. 2. Information about the distribution of the two species is presented that adds to but largely supports existing reports. However, it is still uncertain whether the two putative species are sympatric or parapatric in their distribution. A review of anoa distribution from historical reports and recent field data (1990s to 2002) highlights their decline throughout Sulawesi, especially in the southern and north-eastern peninsulas. The decline has been attributed to local hunting for meat and habitat loss. Most populations are rapidly becoming fragmented, suggesting that the conservation of viable populations may eventually require management of metapopulations. 3. There is an urgent requirement for conservation efforts to: (i) protect anoas from hunting; (ii) prevent habitat loss in key sites; (iii) complete genetic studies to better determine the number of anoa taxa and Management Units and assess their distribution; and (iv) determine the status of the remaining anoa populations.
burton-bilio
Westlicher-Baumschliefer
Überordnung: AFROTHERIA
Taxon ohne Rang: PAENUNGULATA
Ordnung: Schliefer (HYRACOIDEA)
Familie: Schliefer (Procaviidae)

Westlicher oder Regenwald-Baumschliefer
Dendrohyrax dorsalis • The Western Tree Hyrax • Le daman arboricole
- Körperbau und Körperfunktionen
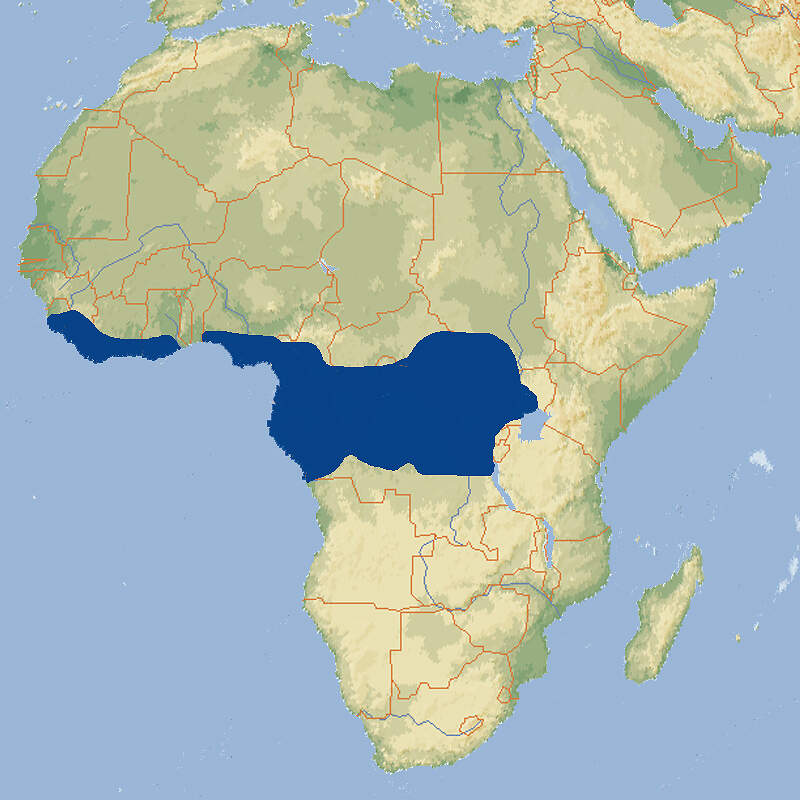
- Verbreitung
- Lebensraum und Lebensweise
- Gefährdung und Schutz
- Bedeutung für den Menschen
- Haltung
- Taxonomie und Nomenklatur
- Literatur und Internetquellen
|
Weitere Bilder auf BioLib |
Aufgrund ihrer anatomischen Besonderheiten und ihrer Eigenschaft als kleine Verwandte der Elefanten bieten die Schliefer Stoff für die Zoopädagogik. Anhand der Baumschliefer kann zudem über die Problematik des Buschfleischhandels und die zunehmende Zerstörung der Wälder Afrikas informiert werden. Allerdings sind die nachtaktiven Baumschliefer sehr viel seltener in europäischen Zoos zu sehen als die tagaktiven Klipp- oder Buschchliefer. Körperbau und KörperfunktionenWestliche Baumschliefer haben eine Kopf-Rumpflänge von 44-57 cm und wiegen 1.8-4.5 kg. Es gibt kaum einen Unterschied zwischen den Geschlechtern. Das Fell ist dunkelbraun bis schwarzbraun gefärbt, unterseits heller. Es ist kurz und rau. Die Nasenpartie ist praktisch unbehaart und es ist ein kleiner weißer Kinnfleck vorhanden. Der Rückenfleck ist ausgedehnter als beim Südlichen Baumschliefer und seine meist weißen, gelblichen oder ockerfarbenen Haare sind deutlich länger als bei jenem [3; 7]. VerbreitungWest- und Zentralafrika: Angola, Äquatorial-Guinea (Bioko), Elfenbeinküste Gabun, Ghana, Guinea, Kamerun, Kongo, Kongo Dem., Liberia, Nigeria, Sierra Leone, Sudan, Tansania, Uganda, Zentralafrikanische Republik [1]. Lebensraum und LebensweiseDer Westliche Baumschliefer besiedelt hauptsächlich feuchte Wälder des Tieflands und Feuchtsavannen, kommt aber auch in Bergwäldern bis auf eine Höhe von 3'500 m vor. Die Tiere sind dämmerungs- und nachtaktiv, in höheren Lagen teilweise tagaktiv. Sie leben meist einzeln, gelegentlich in Gruppen von 2-3 Individuen. Sie halten sich oft hoch in den Bäumen auf, wo sie sich von Blättern, Zweigen, Früchten und Baumrinde ernähren. Tagsüber schlafen sie in Baumhöhlen, nachts machen sie sich durch laute Rufe bemerkbar. Nach einer Trächtigkeit von etwa 200-220 Tagen werden 1-2 voll behaarte und sehtüchtige Junge mit einem Geburtsgewicht von 180-380 g geboren, die ab dem ersten Lebenstag geschickt klettern können [1; 2; 6]. Gefährdung und SchutzDie Art ist weit verbreitet, hat eine großen Bestand und kommt in zahlreichen Schutzgebieten vor. Aufgrund einer Beurteilung aus dem Jahr 2014 wurde sie deshalb als nicht-gefährdet eingestuft, obwohl keine Informationen über den Bestandstrend vorliegen [1]. Der internationale Handel ist durch CITES nicht geregelt. Bedeutung für den MenschenDie Art wird gebietsweise stark zur Gewinnung von Fleisch und Fellen bejagt. Auf den "Bush meat"-Märkten ist sie stets häufiger zu finden [1]. HaltungÜber die Frühzeit der Baumschlieferhaltung wird berichtet, dass ein Tier, das anfäglich nur schwer zum Fressen zu bringen war, an eine Diät bestehend aus Weißdornblättern, saftigem weichem Gras, Keks in Milchkaffee und in Rotwein getauchtes Brot gewöhnt wurde [3], was heute gewiss nicht als Empfehlung zu verstehen ist. Baumschliefer sind zur Haltung als Heimtiere wenig geeignet. Sie werden zwar zahm und stubenrein, setzen aber Harn als Duftmarke auf Möbelstücken ab und fressen Zimmerpflanzen [4]. Als Höchstalter werden 5 Jahre angegeben, was allerdings nicht der tatsächlichen Lebenserwartung in Menschenobhut entsprechen dürfte, sondern durch die geringe Zahl der Meldungen bedingt ist [5]. Haltung in europäischen Zoos: Im Gegensatz zu Klipp- und Buschschliefern werden Baumschliefer in europäischen Zoos nur sehr selten gezeigt. Dies gilt für beide Arten. Für Details siehe Zootierliste. Mindestanforderungen an Gehege: Im Säugetiergutachten 2014 des BMEL ist die Art nicht erwähnt. Die Schweizerische Tierschutzverordnung (Stand 01.06.2022) schreibt für 1-5 Tier ein Außen- und Innengehege von je 16 m² / 40 m vor. Für jedes weitere Tier kommen jeweil 3 m² zur Basisflächen dazu. Es steht zu vermuten, dass sich die Anforderungen der 2. Tierhaltungsverordnung Österreichs (Stand 2023) nur auf Klipp- und Buschschliefer beziehen, auch wenn das nicht so angegeben ist. Für Baumschliefer wären sie jedenfalls inadäquat. Taxonomie und NomenklaturDie Art wurde 1854 (1855) anhand eines Exemplars von der Insel Bioko von dem englischen Zoologen Louis FRASER als "Hyrax dorsalis" beschrieben. Später kam sie in die von John Edward GRAY vom British Museum in London aufgestellte, neue Gattung Dendrohyrax. Es wurden bisher sechs Unterarten beschrieben [3; 6; 7]. |
Literatur und Internetquellen
- BUTYNSKI, T., DOWSETT-LEMAIRE, F. & HOECK, H. 2015. Dendrohyrax dorsalis. The IUCN Red List of Threatened Species 2015: e.T6410A21282601. http://www.iucnredlist.org/details/6410/0. Downloaded on 25 July 2018.
- GRZIMEK, B. (Hrsg. 1970)
- HAHN, H. (1959)
- PUSCHMANN, W., ZSCHEILE, D., & ZSCHEILE, K. (2009)
- WEIGL, R. (2005)
- WILSON, D. E. et al. eds. (2009-2019)
- <WILSON, D. E. & REEDER, D. M. (2005)
Zurück zu Übersicht Afrotheria
Weiter zu Buschschliefer (Heterohyrax brucei)
THOULESS, C.R., DUBLIN, H.T., BLANC, J.J., SKINNER, D.P. et al. (2016)
African Elephant Status Report 2016 - An update from the African Elephant Database.
Occasional Paper of the IUCN Species Survival Commission No. 60
IUCN, Gland, Switzerland.
vi + 309pp.; ISBN13: 978-2-8317-1813-2.
Aus dem Executive Summary:
This is the fifth printed African Elephant Status Report (AESR) produced by the African Elephant Specialist Group (AfESG) of the IUCN Species Survival Commission (SSC). Like its predecessors, the AESR 2016 is based on data from the African Elephant Database (AED), the most comprehensive database on the status of any species of mammal in the wild. This is the first comparison of continental populations between 2006 and 2015 across the 37 range states of the African elephant. Importantly this report not only provides information on changes in elephant numbers but also, because it is spatial, shows where these changes have taken place.
Volltext: https://portals.iucn.org/library/sites/library/files/documents/SSC-OP-060_A.pdf
thouless-biblio
GRAF, R. & BITTERLIN, L. (2015)
Alpenkrähe in den Ostalpen - Vorstudie im Hinblick auf ein Artenförderprojekt.
MONTICOLA 107: 5-36.
Einleitung:
Die Alpenkrähe (Pyrrhocorax pyrrhocorax) ist ein felsenbrütender Standvogel, der schneearme Gebirgslagen besiedelt und seine Insektennahrung am bzw. im Boden in offenen Lebensräumen mit kurzer Vegetation findet. Im 20. Jahrhundert ist sie in Europa lokal selten geworden oder ganz verschwunden und gilt somit als verletzlich. In der Schweiz ist die Verbreitung auf eine Restpopulation im Wallis geschrumpft und die Alpenkrähe wird als stark gefährdet eingestuft. Von der Landschaftsveränderung bis zur direkten Verfolgung werden verschiedene Rückgangsursachen genannt, aber die Gründe für das Verschwinden der Alpenkrähe aus den Ostalpen sind nicht restlos geklärt. Vor diesem Hintergrund hat der Verein Monticola zusammen mit dem Natur- und Tierpark Goldau, dem Alpenzoo Innsbruck und dem Tierpark Dählhölzli ein Förderprojekt der Alpenkrähe mit allfälliger Wiederansiedlung in den Ostalpen lanciert. Diese Vorstudie verfolgt das Ziel, eine Auslegeordnung für das Förderprojekt zu erarbeiten und weiteren Klärungs- und Forschungsbedarf auszuweisen
graf-biblio
DÜMPELMANN (C. & KORTE, e. (2013)
Rote Liste der Fische und Rundmäuler Hessens (Pisces & Cyclostomata).
4. Fassung (Stand: September 2013)
34 Seiten
Erstellt im Auftrag des Hessischen Ministeriums für Umwelt, Klimaschutz, Landwirtschaft und Verbraucherschutz (HMUKLV).
ISBN 978-3-89274-366-8.
Die der vorliegenden Roten Liste der Fische und Rundmäuler Hessens zu Grunde liegenden Daten wurden im Rahmen der Erstellung des Hessischen Fischartenatlas erhoben und zusammengeführt. Der Gesamtdatensatz setzt sich aus den Einträgen der landesweiten Artendatenbank bei Hessen-Forst im Servicezentrum Forsteinrichtung und Naturschutz (FENA) sowie aus Literaturangaben,
Gutachten, belegten Hinweisen von Bearbeitern zum Hessischen Fischartenatlas und Sammlungsbelegen zusammen.
Volltext (PDF)
Sandtigerhai
Klasse: Knorpelfische (CHONDRICHTHYES)
Teilklasse: Plattenkiemer (ELASMOBRANCHII)
Taxon ohne Rang: Haie (SELACHII)
Überordnung: GALEOMORPHI
Ordnung: Makrelenhaiartige (LAMNIFORMES)
Unterordnung: Orectoloboidei
Familie: Sandtigerhaie (Odontaspididae)

Sandtigerhai
Carcharias taurus • The Sand Tiger Shark • Le requin-taureau
- Körperbau und Körperfunktionen
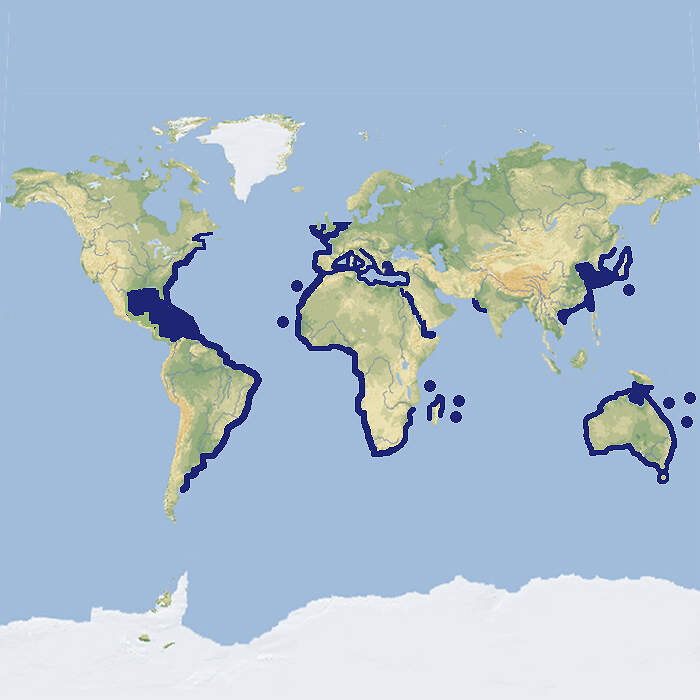
- Verbreitung
- Lebensraum und Lebensweise
- Gefährdung und Schutz
- Bedeutung für den Menschen
- Haltung
- Taxonomie und Nomenklatur
- Literatur und Internetquellen
|
Weitere Bilder auf BioLib.cz |
Der im Freiland gefährdete Sandtigerhai ist eine relativ oft in europäischen Zoos und Schauaquarien zu sehende mittelgroße Haiart. Körperbau und KörperfunktionenDer Sandtigerhai hat eine kurze, spitze Schnauze, kleine Augen, beidseits fünf Kiemenspalten und vorstehende, dornartige Zähne, die in mehreren Reihen angeordnet sind. Die Tiere werden mit einer Länge von rund 220 cm geschlechtsreif und können eine Länge von 350(-430) cm erreichen Mit der gelblichbraunen bis gräulichen Färbung ihrer Oberseite, die oft mit unregelmäßig verteilten braunen Flecken gezeichnet ist, sind sie außerordentlich gut dem sandigen Meerboden angepasst. Der Bauch ist heller [1; 3; 6; 7]. VerbreitungWeltumspannend, vielleicht mit Ausnahme des Ost-Pazifiks: Im Indopazifik vom Roten Meer und der afrikanischen Küste bis nach Japan, Korea und Australien einschließlich der Arafurasee zwischen Neuguinea und Nordaustralien und der Tasmansee. Im West-Atlantik vom Golf von Maine bis Argentinien einschließlich des Karibischen Meers, im Ostatlantik von der europäischen Küste und dem Mittelmeer bis Südafrika, möglicherweise mit Unterbrüchen (widersprüchliche Angaben der einzelnen Quellen) [2; 5; 6]. Lebensraum und LebensweiseDer Sandtigerhai lebt in Bodennähe der Schelfregion in Tiefen bis 200 m. Er erleichtert sein Körpergewicht, indem er Luft schluckt und sie im Magen behält, der so als eine Art Schwimmblase funktioniert. Er schwimmt ständig umher, um seine Sauerstoffversorgung zu gewährleisten, jagt aber hauptsächlich nachts. Er ernährt sich von verschiedenen Bodenfischen, fängt aber auch Tintenfische und Kraken sowie Krebstiere. Er ist lebendgebärend. Die Jungtiere schlüpfen bereits im Uterus und dezimieren sich gegenseitig, sobald der Dottervorrat aufgebraucht ist. Deshalb kommen 8-9 Monate nach der Paarung jeweils nur zwei Jungtiere - aus jedem Utrerushorn eines - zur Welt [3; 7]. Gefährdung und SchutzKommerzielle Fischerei, Sportfischen und das Verbauen von Stränden mit Schutznetzen haben gebietsweise zu einer markanten Abnahme der Bestände geführt. Die Art gilt daher aufgrund einer Beurteilung aus dem Jahr 2005 als gefährdet [5]. Der internationale Handel ist durch CITES nicht geregelt. Zoogestützte Artenschutzprojekte (Beispiele):
Bedeutung für den MenschenIn Europa kommt der Sandtigerhai zwar ins flache Wasser von Badestränden, geift aber keine Menschen an, dies im Gegensatz zur Population in Südafrika, die als für den Menschen sehr gefährlich gilt [3]. Regional, etwa in Japan, ist der Sandtiger ein begehrter Speisefisch. In Australien hat er große Bedeutung in der Sportfischerei [5]. HaltungSandtigerhaie werden gelegentlich in Aquarien gezüchtet, es gibt Zuchtberichte z.B. aus den Jahren 1993 und 1997 [4]. Haltung in europäischen Zoos: Die Art wird in rund 40 europäischen Einrichtungen gezeigt, von denen sich wenige im deutschsprachigen Raum befinden. Für Details siehe Zootierliste. Mindestanforderungen: In Deutschland und Österreich gibt es keine konkreten Mindestnormen. Die "Mindestnormen für das Halten von Fischen zu Zierzwecken" der Schweizerischen Tierschutzverordnung dürften auf Knorpelfische nicht anwendbar sein, jedoch ist für das private Halten von Haien und Rochen eine Bewilligung erforderlich. Taxonomie und NomenklaturDie Art wurde 1810 von dem in Marseille aufgewachsenen, hauptsächlich in den USA tätigen Universalgelehrten Constantine Samuel RAFINESQUE unter ihrem heute noch gültigen Namen erstmals beschrieben [2]. Literatur und Internetquellen
|
Zurück zu Übersicht Fische
Weiter zu Adlerrochen (Myliobatis aquila)
Giftiger Krötenlaubfrosch
Ordnung: Froschlurche (ANURA)
Unterordnung: Moderne Froschlurche (NEOBATRACHIA)
Familie: Laubfrösche (Hylidae)
Unterfamilie: Eigentliche Laubfrösche (Hylinae)

Giftiger Krötenlaubfrosch
Trachycephalus venulosus = typhonius • The Veined Tree Frog • La rainette réticulaire
- Körperbau und Körperfunktionen
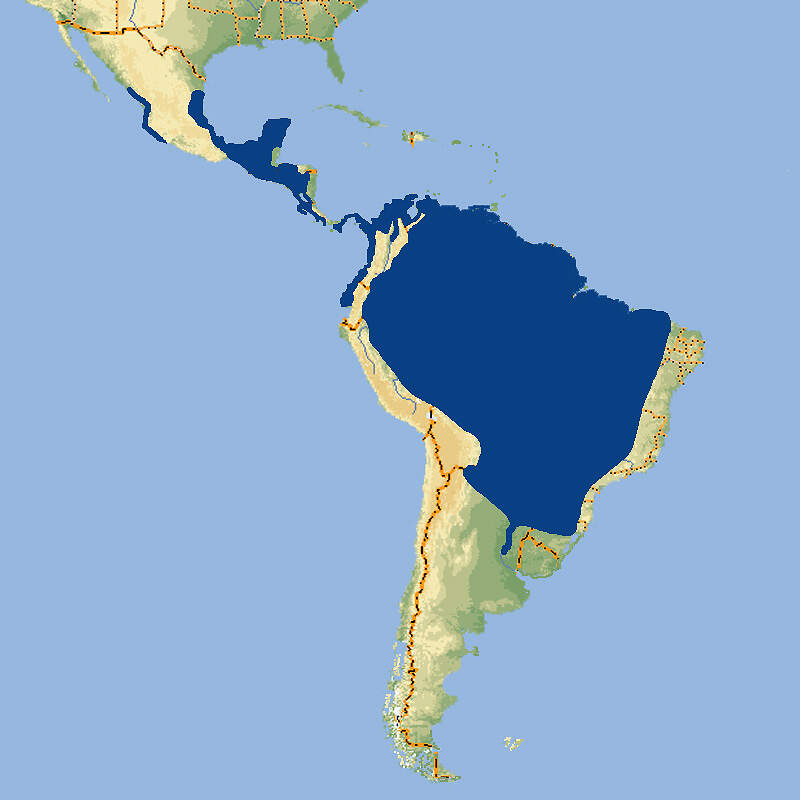
- Verbreitung
- Lebensraum und Lebensweise
- Gefährdung und Schutz
- Bedeutung für den Menschen
- Haltung
- Taxonomie und Nomenklatur
- Literatur und Internetquellen
|
Weitere Bilder auf BioLib
|
Mit seinem kurzen Kopf und den großen Augen entspricht der Giftige-Krötenlaubfrosch dem Kindchenschema. Er wirkt so als Sympathieträger, der sich gut als Botschafterart für den Amphibienschutz und den Schutz der südamerikanischen Regenwälder eignet, wurde in dieser Funktion aber weitgehend vom Baumhöhlen-Krötenlaubfrisch abgelöst und ist aus europäischen Zoos weitgehend verschwunden. Körperbau und KörperfunktionenJe nach Herkunft variieren die Zeichnungsmuster sehr stark und die Körpergröße schwankt populationsabhängig zwischen 60 und 114 mm bei den Weibchen und 58-101 mm bei den Männchen, was damit zusammenhängen könnte, dass es sich beim Giftigen Krötenlaubfrosch möglicherweise gar nicht um eine Art, sondern um einen Artkomplex handelt [4]. VerbreitungVon Südmexiko hinunter bis Nordargentinien: Argentinien, Belize, Bolivien, Brasilien, Costa Rica, Ekuador, El Salvador, Französisch Guiana, Guatemala, Guyana, Honduras, Kolumbien, Mexiko, Nikaragua, Panama, Paraguay, Peru, Surinam, Trinidad und Tobago, Venezuela [5]. Lebensraum und LebensweiseDie Art kommt in Primärwald, Sekundärwald, Savanne und Kulturland vom Flachland bis auf 2'400 Höhenmeter vor. Die Paarung erfolgt in temporären Tümpeln, Bächen oder Pfützen in Astgabeln. Das Weibchen legt bis zu 3'000 Eier ins Wasser, die einen Oberflächenfilm bilden. Die Larven schlüpfen nach einem Tag. Bis zur Metamorphose, die nach 42 Tagen erfolgt, werden sie bis zu 49 mm lang [3]. Gefährdung und SchutzDie Art ist weit verbreitet, häufig und hat einen anscheinend stabilen Bestand, obwohl viele Populationen unter Lebensraumverlust leiden. Nach einer Beurteilung aus dem Jahr 2009 gilt sie daher nicht als gefährdet [5]. Der internationale Handel ist durch CITES nicht geregelt. Bedeutung für den MenschenWie ihr Name sagt, können Giftige Krötenlaubfrösche aus ihren Hautdrüsen große Mengen eines stark giftigen Schleims ausscheiden, wenn sie bedroht, also z.B. in die Hand genommen werden. Das Gift ist nicht nur stark schleimhautreizend, sondern es kann beim Menschen auch zu Hautrötungen oder -schwellungen und damit verbundenen Schmerzen führen [4]. HaltungHaltung in europäischen Zoos: Bis vor ein paar Jahren war die Art in mehreren deutschen Zoos zu sehen. Heute wird sie nur noch in ganz wenigen europäischen Einrichtungen gezeigt. Für Details siehe Zootierliste. Mindestanforderungen an Gehege: In Deutschland gibt es keine konkreten Mindestanforderungen. In Österreich sind diese in Anlage 4 der 2. Tierhaltungsverordnung, in der Schweiz in Anhang 2, Tabelle 6 der Tierschutzverordnung festgelegt. Wie Krötenlaubfrösche gehalten werden (Beispiel): Vivarium im Tierpark Chemnitz siehe ZOOLEX Gallery. Taxonomie und NomenklaturDie Krötenlaubfrösche wurden im Lauf der Zeit allen möglichen Gattungen zugeordnet: Acrodytes, Argenteohyla, Hyla, Hypsiboas, Rana, Scytopis und zuletzt Phrynohyas. Heute wird die Gattung Trachycephalus genannt, sie umfasst mittlerweile 16 Arten [1; 2]. Der Giftige Krötenlaubfrosch wurde 1758 von Carl von LINNÉ als "Rana typhonia" beschrieben. Der Artname venulosus geht auf das Jahr 1768 zurück und war bis 2010 gültig. Dann wollten LAVILLA et al. (2010) herausgefunden haben, dass Carl von LINNÉ 1758 mit seiner Rana typhonia weder eine Kröte, noch einen asiatischen Frosch, sondern einen südamerikanischen Laubfrosch, eben den Giftigen Krötenlaubfrosch gemeint habe [1; 6]. Über die Sinnhaftigkeit, einen Namen zu ersetzen, der 242 Jahre in Gebrauch war, der in hunderten von Publikationen und auf ungezählten Zoo-Namensschildern zu finden ist, mag man streiten. Jedenfalls lautet die offizielle Artbezeichnung jetzt typhonius. Der frühere wissenschaftliche Name Phrynohyas venulosa wird aber immer noch gelegentlich verwendet. Literatur und Internetquellen
|
Zurück zu Übersicht Laub-, Ried- und Beutelfrösche
Tigerotter
Ordnung: Schuppenkriechtiere (SQUAMATA)
Unterordnung: Schlangen (SERPENTES)
Überfamilie: Nattern- und Vipernartige (Colubroidea oder Xenophidia)
Familie: Giftnattern (Elapidae)
Unterfamilie: Echten Giftnattern (Elapinae)

Gewöhnliche Tigerotter
Notechis scutatus • The Tiger Snake • Le serpent-tigre
- Körperbau und Körperfunktionen
- Verbreitung
- Lebensraum und Lebensweise
- Gefährdung und Schutz
- Bedeutung für den Menschen
- Haltung
- Taxonomie und Nomenklatur
- Literatur und Internetquellen
|
Weitere Bilder auf BioLib.cz |
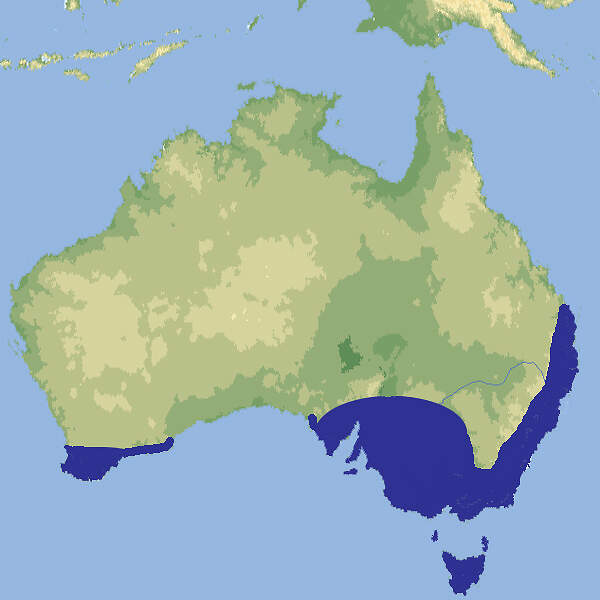
Die Tigerotter ist eine relativ kurze, etwas plumpe Giftschlange aus dem Süden Australiens, die in europäischen Zoos nur ausnahmsweise zu sehen ist. Körperbau und KörperfunktionenTigerottern werden meist etwa 1.20 m, gelegentlich bis 1.50 m lang. Sie sind kräftig gebaut, der Kopf ist kaum vom Hals abgesetzt. die Augen sind klein mit runder Pupille. Die Färbung ist sehr variabel, von hellgrau über rotbraun bis olivgrün, oft mit mehr oder weniger deutlichen hellen Querbändern. Die Unterseite ist gelb. Es gibt auch ganz schwarze Exemplare [3: 4; 6]. VerbreitungSüden und Südosten Australiens: New South Wales, Queensland, Südaustralien, Tasmanien, Westaustralien [1; 2]./span> Lebensraum und LebensweiseDie Tigerotter lebt in der Nähe von Wasserläufen, etwa in Galeriewäldern, oder auf Inseln. Sie ernährt sich hauptsächlich von Amphibien, gelegentlich von Echsen, Kleinsäugern und allenfalls Jungvögeln. Die Art ist ovovivipar. Die Würfe umfassen 10-90(-107) Junge, die bei der Geburt etwa 25 cm lang sind [2; 3; 4]. Gefährdung und SchutzEinzelne Populationen sind zwar durch intensivierte landwirtschaftliche Nutzung gefährdet. Für die Art insgesamt, die eine weite Verbreitung und einen großen Gesamtbestand hat, trifft die nach einer Beurteilung aus dem Jahr 2010 aber nicht zu [2]. Der internationale Handel ist unter CITES nicht geregelt. Es gelten Ausfuhrbeschränkungen Australien. Bedeutung für den MenschenIn Südaustralien wird ein großer Teil der Todesfälle durch Schlangenbiss durch Tigerottern verursacht [3]. HaltungDie Tigerotter gehört zu den "Gefahrtieren", deren Haltung in manchen deutschen Bundesländern unter sicherheitspolizeilichen Aspekten eingeschränkt oder geregelt ist.Die Deutsche Gesellschaft für Herpetologie und Terrarienkunde (DGHT) und der Verband Deutscher Verein für Aquarien- und Terrarienkunde (DVA) haben zu dieser Thematik einen Leitfaden herausgegeben [7]. Haltung in europäischen Zoos: Die Art wird in Europa nur sporadisch gezeigt, nach 2010 gar nicht mehr. Für Details siehe Zootierliste. Mindestanforderungen an Gehege: Die Art ist weder im Reptiliengutachten 1997 des BMELF, noch in der Schweizerischen Tierschutzverordnung (Stand 01.06.2022) oder der 2. Tierhaltungsverordnung Österreichs (Stand 2023) erwähnt. Taxonomie und NomenklaturDie Art wurde 1861 von Wilhelm PETERS, der ab 1857 Direktor des Zoologischen Museums Berlin und ab demselben Jahr bis 1869 Direktor des Zoologischen Garten Berlin war, als "Naja (Hamadryas) scutata" beschrieben. Der heute gültige Name wurde 1896 von dem am British Museum tätigen belgischen Zoologen George Albert BOULENGER vergeben [6]. |
Literatur und Internetquellen
- ATLAS OF LIVING AUSTRALIA
- COGGER, H. (2010). Notechis scutatus. The IUCN Red List of Threatened Species 2010: e.T169687A6666605. http://www.iucnredlist.org/details/169687/0. Downloaded on 05 October 2017.
- MEHRTENS, J. M. (1993)
- O'SHEA, M. & HALLIDAY, T. (2002)
- THE REPTILE DATA BASE
- WILSON, S. & SWAN, G. (2013)
- DGHT/DVA (Hrsg. 2014)
Zurück zu Übersicht Schlangen
Weiter zu Östliche Braunschlange (Pseudonaja textilis)
AMBACH, J. (2009)
Hügelbauende Waldameisen (Formica rufa-Gruppe) - Ein aktueller Überblick.
Denisia 25, zugleich Kataloge der oberösterreichischen Landesmuseen Neue Serie 85 (2009): 93–106.
Zusammenfassung:
Es wird ein Überblick über den aktuellen Stand der Waldameisentaxonomie, der sozialen Struktur von Waldameisennestern, sowie die Verbreitung und Gefährdung der Arten in Österreich gegeben. Die aus diesen Ergebnissen resultierenden, geeigneten Schutzmaßnahmen für die Arten werden diskutiert.
Abstract:
Mound building wood ants (Formica rufa group) – a review. An overview about the actual status of taxonomy and social structure of wood ants is given. The distribution and endangering of the species of the
Formica rufa group in Austria is commented. The resulting conservation measures are discussed.
Volltext:
https://www.zobodat.at/pdf/DENISIA_0025_0093-0106.pdf
CAMPOS SOARES de VASCONCELOS, R. (2010)
Integrative Approaches to the Systematics and Conservation of the Reptiles of the Cape Verde Islands.
PhD Thesis. Departamento de Biologia Faculdade de Ciências da Universidade do Porto
Volltext: http://www.scvz.org/pdf/TeseRVLowRes_ii.pdf
Summary:
Two of the main sensitivities of Conservation Biogeography are the inadequacies in taxonomic and chorological data, the so-called Linnean and Wallacean shortfalls, respectively. These shortfalls increase in the more remote areas such as oceanic islands. This thesis contributed to dilute those shortfalls in one of those remote areas, the Cape Verde Islands, for one of its least studied group, the reptiles.The specific goals of this thesis were related to answering to what diversity occurs there and to address putative biogeographic factors that explain why diversity is unevenly distributed. Then, it is aimed to answer where this biodiversity can be found and, based on all the gathered data, to plan how to better protect it at different levels.
First, the phylogeographic patterns of terrestrial reptiles were studied to identify an introduced agamid and cryptic endemic taxa of the three genera (Hemidactylus, Tarentola and Chioninia) and to clarify their systematics. The new introduced taxon in Cape Verde was identified as Agama agama. Also, some endemic subspecies were upgraded to the specific status and three new cryptic species (Hemidactylus lopezjuradoi, Tarentola bocageiand T. fogoensis) and subspecies (Chioninia vaillanti xanthotis, C. spinalis boavistensis and C. s. santiagoensis) were described using an integrative approach combining morphological, genetic and population analyses. These studies highlighted the usefulness of integrative datasets in the fields of Taxonomy and Phylogeography and how they can improve the performance of taxa estimations. In addition, the origin of the introduced Agama and the colonisation patterns of the endemic taxa were inferred and several historical and environmental factors, such as the Pleistocene sea-level falls and altitude, were related with the uneven distribution of diversity at intraspecific level. Low intraspecific divergence between reptile lineages of the same island has been explained by the recent volcanic activity and high ecological stress that could lead to population extinctions, and the low habitat diversity within some islands that could restrain opportunities for allopatric diversification.
Secondly, extensive sampling and bibliographic chorological data were compiled to produce and updated distribution atlas for all taxa addressing doubtful or erroneous records and to develop predictive maps of occurrence based on ecological niche-based models for most of the endemic taxa. This data also allowed the detection of the wide-spreading of the introduced H. angulatus in Santiago and Boavista and the colonisation of two new islands by the exotic H. mabouia. In addition, it allowed updating the conservation status for the endemic taxa showing that around half of them are threatened under the IUCN criteria and that the most frequent classifying criterion was related to restricted geographic range. The most pervasive threats identified are related to natural disasters, as droughts and volcanic activity, intrinsic factors, such as low population densities and restricted range, and introduced species.
Finally, this work also demonstrated how ecological niche-based models are useful tools to infer ranges on relatively under-sampled and remote areas with high accuracies and how they can be applied to conservation, maximizing efficiency of reserve designs. Results depicted that in Santa Luzia, Branco, Raso, Sal, Boavista, Maio and Rombos designation of new protected areas is not a priority since the ones that are going to be implemented will reach the conservation targets for all identified evolutionary significant units of those islands and islets. On the other hand, new or modified reserves should be implemented on the remaining islands to cover all identified lineages of Cape Verdean reptiles. This measure is especially important in Fogo and Brava, where no planning unit selected by the area prioritisation scenarios is within the protected areas limits and no protected area is planned, respectively.
Altogether, this work exemplifies the usefulness of integrating different disciplines to more effectively allowing systematic conservation planning of biodiversity.