Grünflügelara
Ordnung: Papageienvögel (Psittaciformes)
Familie: Echte Papageien (Psittacidae)
Unterfamilie: Eigentliche Papageien (Psittacinae)
Tribus: Neuweltpapageien (Arini)

Grünflügelara, Dunkelroter Ara
Ara chloropterus (A. chloroptera) • The Red-and-green Macaw • L'ara à ailes vertes
- Körperbau und Körperfunktionen
- Verbreitung
- Lebensraum und Lebensweise
- Gefährdung und Schutz
- Bedeutung für den Menschen
- Haltung
- Taxonomie und Nomenklatur
- Literatur und Internetquellen
|
Weitere Bilder auf BioLib.czStimme auf XENO-CANTO |
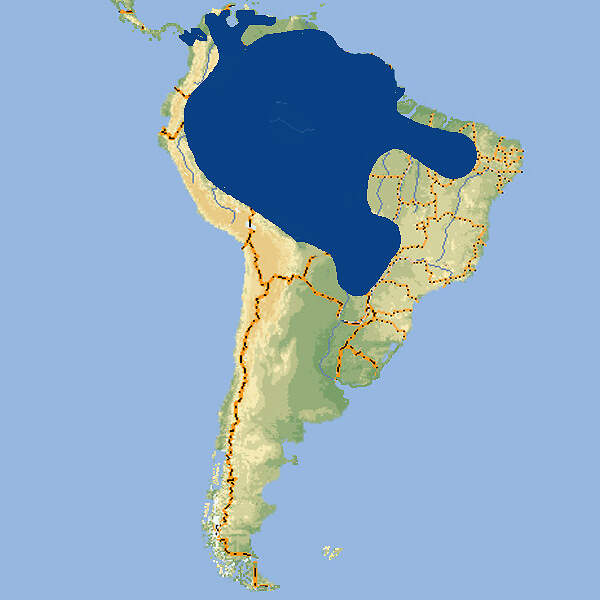
Der selbst nicht gefährdete Grünflügelara ist ein plakativ gefärbter Großpapagei, der beim Zoopublikum große Beachtung findet. Er eignet sich daher bestens als Botschafter für Natur- und Artenschutz in seinen südamerikanischen Heimatländern. Er wird aus diesem Grund und weil Zoos öfter in die Lage kommen, aus Tierschutzgründen Vögel aus Privathaltungen zu übernehmen, sehr häufig in europäischen Zoos gehalten. Körperbau und KörperfunktionenDer Grünflügelara ist mit 90 und mehr cm Gesamtlänge und einem Gewicht von etwa 1'050-1'700 g etwas größer als der Hellrote Ara. Die Grundfarbe seines Gefieders ist ein dunkleres Rot als bei jenem und die mittleren Flügeldecken sind grün anstatt gelb. Schnabel, Iris und Füße sind bei beiden Arten ähnlich gefärbt: der Oberschnabel zum größeren Teil hornfarben, der Unterschnabel grauschwarz, die Iris hellgelb und die Füße dunkelgrau. Der nackte Wangenbereich ist weiß mit roten Federfluren. Die großen Flügeldecken, die äußeren Armschwingen, die Außenfahnen der Handschwingen und die Schwanzspitzen sind blau [2; 4; 7; 8]. VerbreitungSüdamerika: Argentinien, Bolivien, Brasilien, Ekuador, Französisch Guiana, Guyana, Kolumbien, Panama, Paraguay, Peru, Surinam, Venezuela [1]. Lebensraum und LebensweiseDer Grünflügelara bewohnt hauptsächlich tropische Wälder unterschiedlichen Typs des Tieflandes, sowie Savannen einschließlich des Cerrado. Im Gebirge findet man ihn kaum noch in Höhenlagen über 1'500 m. Er nistet in Baum- oder Felshöhlen, nur selten in Palmenstämmen. Es werden 1-4 Eier gelegt, die 25-28 (24-29) Tage bebrütet werden. Die Nestlingszeit beträgt rund 90-103 Tage und mit 6-9 Monaten werden die Jungvögel selbständig [4; 6; 7; 8]. Gefährdung und SchutzDie Bestände des Grünflügelaras nehmen zwar etwas ab, das Verbreitungsgebiet ist aber so groß, dass die Art letztmals 2016 nicht als gefährdet taxiert wurde (Rote Liste: LEAST CONCERN) [1]. Der internationale Handel ist nach CITES-Anhang II geregelt. Bedeutung für den MenschenGrünflügelaras werden zur Gewinnung von Fleisch gejagt und für den nationalen und internationalen Heimtierhandel gefangen. Die Ursprungsländer registrierten von 2001-2018 Ausfuhren von 21'817 lebenden Wildfängen, wovon 17'711 aus Guyana, 4'091 aus Surinam kamen. Im selben Zeitraum wurden weltweit Exporte von 25'994 Nachzuchtvögeln erfasst, von denen 21'039 aus Südafrika stammten [1; 3]. HaltungVermutlich wurden die ersten Grünflügelaras bereits zu Beginn des 17. Jahrhunderts nach Europa gebracht. Die Welterstzucht gelang 1926 im San Diego Zoo, in Privathand glückte sie 1962 in England. Bei der Gemeinschaftshaltung mit anderen Ara-Arten kann es zu Bastardierungen kommen. Im Zoo Wuppertal z.B. haben ein Ararauna x Grünflügelara-Paar während 18 Jahren an die 40 Jungvögel produziert. Das Höchstalter in menschlicher Obhut wird mit gut 63 Jahren angegeben [6; 7; 9]. Haltung in europäischen Zoos: Die Art wird in rund 310 Zoos gezeigt, von denen sich etwa ein Viertel im deutschsprachigen Raum befinden. Für Details siehe Zootierliste. Mindestanforderungen an Gehege: Nach Papageiengutachten des BMELF von 1995 ist für die Haltung eines Paars oder ausnahmsweise eines Einzelvogels eine Voliere mit einer Fläche von 4 x 2 m und einer Höhe von 2 m erforderlich, ferner ein Schutzraum mit einer Grundfläche von 2 m². Für jedes weitere Paar sind die Grundflächen um 50% zu erweitern. Nach Schweizerischer Tierschutzverordnung (Stand 1.2.2022) sind Aras mindestens paarweise zu halten. Für ein Paar ist eine bei Bedarf unterteilbare Innenvoliere mit Badegelegenheit, einer Grundfläche von 10 m² und einem Volumen von 30 m³ vorgeschrieben, für jedes weitere Tier ist die Grundfläche um 1 m² zu erweitern. Ein Aussengehege ist fakultativ. Ist dieses vorhanden und permanent zugänglich, so können dessen Maße ans Innengehege angerechnet werden, wobei maximal ein Drittel des Innengeheges durch das Außengehege ersetzt werden kann. Die 2. Tierhaltungsverordnung Österreichs (Stand 2022)schreibt für die Haltung eines Paars oder ausnahmsweise eines Einzelvogels eine Voliere mit einer Grundfläche von 4 x 2 m Fläche und einer Höhe von 3 m sowie einen Schutzraum von 2 m² / 2 m Höhe mit einer Mindesttemperatur von 10°C vor. Je weiteres Paar sind die Flächen um 50% zu erweitern. Taxonomie und NomenklaturDer Grünflügelara wurde 1859 von dem britischen Zoologen George Robert GRAY als Ara chloroptera. erstmals wissenschaftlich beschrieben und hieß bis vor wenigen Jahren auch so. Nachdem in einer 2013 veröffentlichten Checkliste festgestellt wurde, dass das grammatikalische Geschlecht von Ara männlich sei, wurde der Artname auf chloropterus geändert. In der Literatur und auf Zoo-Namensschildern finden sich beide Bezeichnungen. Es gibt keine Unterarten [4; 5]. |
Literatur und Internetquellen
- BIRDLIFE INTERNATIONAL (2016). Ara chloropterus. The IUCN Red List of Threatened Species 2016: e.T22685566A93080287. http://dx.doi.org/10.2305/IUCN.UK.2016-3.RLTS.T22685566A93080287.en . Downloaded on 04 August 2019.
- CITES IDENTIFICATION MANUAL
- CITES TRADE DATA BASE
- DEL HOYO, J., ELLIOTT, A. et al. (eds., 1992-2013)
- DEL HOYO, J., COLLAR, N., CHRISTIE, D.A., ELLIOTT, A. & FISHPOOL L.D.C. (2014)
- GRUMMT, W. & STREHLOW, H. (2009)
- LANTERMANN, W. (1984)
- LEPPERHOFF, R. (2004)
- YOUNG, A. M., HOBSON, E. A., BINGAMAN LACKEY, L. & WRIGHT, T. F. (2012)
Zurück zu Übersicht Papageienvögel
Weiter zu Blaulatzara (Ara glaucogularis)
CHAPMAN, J. A. & FLUX, J. E. C. (1990)
Rabbits, Hares and Pikas : Status Survey and Conservation Action Plan.
168 Seiten, zahlreiche s/w-Fotos und Landkarten.
IUCN, Gland.ISBN 2-8317-0019-1.
Aus dem Vorwort:
The Lagomorph Specialist Group reviewed for the first time the status of the worlds’ lagomorphs, critically examined those species which appeared to require attention, and listed important decisions for future conservation action concerning the volcano rabbit Romerolagus diazi (Mexico), riverine rabbit Bunolagus monticularis (South Africa), hispid hare Caprolagus hispidus (India and Nepal), Sumatran rabbit Nesolagus netscheri (Indonesia) and Amami rabbit Pentalagus furnessi (Japan).
Emphasis was placed on the need for a comprehensive review of hares and for the development of programs for monitoring lagomorphs and their habitat wherever required. The need to bring these matters to the attention of Governments was given high priority. Project proposals resulting from these deliberations were submitted to the Commission for inclusion in the IUCN Conservation Programme for Sustainable Development.
The Lagomorph Group, building on its good start, soon assumed responsibility for providing the information necessary for preparing and updating lagomorph entries in the Red Data Book and for submissions to the Convention on International Trade in Endangered Species of Wild Fauna and Flora (CITES). It holds a strong position against the introduction of the eastern cottontail to Europe, and has willingly participated in discussions on the subject when requested.
The Group also continues to take the lead in keeping lagomorphs on conference agenda at international meetings, and has widened its in recent years to look at the status of some of the lesser known races or subspecies of the more common lagomorphs. Lagomorphs are relatively small mammals and do not excite the curiosity and appeal of some of their larger kind.
There has thus never been much financial support for conservation. But they are of critical importance in world ecosystems and I applaud the action taken by the Species Survival Commission in setting up this Group when it did. I am particularly pleased that IUCN has agreed to fund this publication of the Lagomorph Specialist Group Action Plan. The achievement of main objectives depends to a large extent on the continued activities of small teams of dedicated people like those who constitute this Group; the publication will give them an opportunity to say what they are trying to do.
MELLES, F., & T. BRANDT (2016)
Ein Versuch zur Wiederansiedlung der Moorente Aythya nyroca am Steinhuder Meer, Niedersachsen – erste Ergebnisse.
Vogelkdl. Ber. Niedersachs. 45: 37-52.
Zusammenfassung:
In 2012 startete der NABU Niedersachsen auf Initiative des Landes Niedersachsen nach umfangreichen Absprachen, Vorüberlegungen und -untersuchungen am Steinhuder Meer einen Versuch zur Wiederansiedlung der in Deutschland vom Aussterben bedrohten Moorente Aythya nyroca. Der letzte Brutnachweis der Moorente vom Steinhuder Meer stammt aus dem Jahr 1980. Seitdem waren durch Renaturierungsmaßnahmen und Neuanlagen zahlreiche neue, als Lebensraum für die Art geeignet erscheinende Gewässer entstanden. Die erste Phase des Ansiedlungsversuches wird beschrieben. Von 2012 bis Ende Juni 2015 wurden 237 Moorenten (121 Männchen, 112 Weibchen, 4 unbekannten Geschlechts) mit unterschiedlichen Methoden in Freiheit entlassen. Die Freilassungen führten ab 2013 zu einer dauerhaften Anwesenheit (auch im Winter) von mindestens 20, z. T. Paar bildenden Moorenten an Gewässern fünf unterschiedlich definierter Typen. Anhand von individuellen Ringmarkierungen konnten im geringen Umfang Abwanderungsbewegungen nachgewiesen werden. Beobachtungen zeigten eine erhebliche Variabilität in der Nahrungswahl, die nicht nur aus Pflanzen, sondern vor allem im Winter auch aus Fischen und im Frühling und Sommer aus Insekten bestand. Mitte Juni 2015 gelangen die ersten Brutnachweise auf einem Hochmoorgewässer, auf dem drei Weibchen zehn, sechs und zwei Jungvögel führten. Die bislang vorliegenden Ergebnisse werden diskutiert. Argumente, die für oder gegen das entsprechend der IUCN-Kriterien zur Wiederansiedlung ausgestorbener Tierarten durchgeführte Projekt sprechen, werden, so objektiv wie es den Verfassen möglich ist, aufgeführt und sollten die Grundlage für eine fachlich fundierte Meinungsbildung und sachliche Auseinandersetzung sein. Ob der Versuch zur Wiederansiedlung der Moorente in Niedersachsen gelingen kann, ist derzeit offen.
melles-biblio
06.12.2016 -69
Giraffenschutz in Uganda
Schutz der Rothschildgiraffe im Kidepo Nationalpark
Zoo und Zoostiftung Berlin

Rothschildgiraffen im Kidepo Nationalpark © Care for KaramojaDie bedrohte Rothschildgiraffe (Giraffa camelopardalis rothschildi) ist natürlicherweise weltweit nur noch in zwei Verbreitungsgebieten zu finden: Im Murchison Falls Nationalpark sowie im Kidepo Valley Nationalpark (beide Uganda). Während die mit etwa 1.000 Tieren deutlich größere Population im Murchison Falls Nationalpark teils von einer bislang nicht genauer untersuchten Hautkrankheit befallen ist, ist die Population im Kidepo Nationalpark unbelastet und daher von besonderer Wichtigkeit. Das Projekt „Care for Karamoja“, das vom Zoo Santa Barbara (USA) ins Leben gerufen wurde, hat es sich zur Aufgabe gemacht, diese sehr kleine Population von ca. 54 Tieren zu schützen.
Da der Kidepo-Nationalpark im Norden an den politisch extrem instabilen und von Armut gekennzeichneten Südsudan grenzt ist der Hauptbedrohungsfaktor für diese kleine Population die illegale Jagd für die Gewinnung von Fleisch und Fellen. Außerhalb des Parks gibt es wegen der dichten Besiedlung und intensiven Landnutzung keine Giraffen - und kaum anderes Großwild - mehr. Daher wurde mit der Uganda Wildlife Authority sowie dem Uganda Wildlife Education Centre (UWEC) ein Schutzprogramm erarbeitet. Dies beinhaltet in erster Linie die Unterstützung der Ranger im Kidepo NP, die dringend mit professionellem Equipment ausgestattet werden müssen. Weiterhin soll die lokale Bevölkerung langfristig für den Artenschutz sensibilisiert werden, indem u.a. lokalen Schulklassen der Besuch des Nationalparks ermöglicht wird. Der Zoo Berlin hält Rothschildgiraffen und unterstützt als größter europäischer Partner dieses Schutzprojekt, zu dem auch Zoos in den USA beitragen.
Literatur und Internetquellen:
- http://www.care4karamoja.org
- Pressemitteilung Zoo Berlin
Tierart-Datenblatt: Giraffe (Giraffa camelopardalis)
Lebensraum: Ostafrikanische Savanne
Zurück zu Übersicht Paarzeher
Zurück zu Giraffe (Giraffa camelopardalis)
Weiter zu Gabelbock (Antilocapra americana)
Wiederansiedlung Ringelnatter
Schutz der Ringelnatter im Ruhrgebiet
Zoo Duisburg
|
Flyer (PDF) |
Ringelnattern leben zumeist in Gewässernähe, wo sich diese völlig ungiftigen und für den Menschen somit absolut harmlosen Schlangen, die ausgezeichnete Schwimmer sind, vornehmlich von Amphibien ernähren. Aufgrund der Entwässerung von Feuchtgebieten, dem Rückgang von Überschwemmungsgebieten sowie der Trockenlegung vieler Gewässer wurde der Lebensraum der Ringelnatter stark dezimiert, weshalb Ringelnattern insbesondere in den vom Menschen geprägten Regionen mit Städtebau und intensiver Landwirtschaft selten geworden sind. So auch im größten Ballungsgebiet Deutschlands, dem Ruhrgebiet, wo die Ringelnatter nur noch sehr fragmentierte und kleine Biotope bewohnt. Mit Unterstützung und finanzieller Förderung der Stiftung Umwelt und Entwicklung Nordrhein-Westfalen und in Kooperation mit der Biologischen Station Westliches Ruhrgebiet (BSWR) initiierte der Zoo Duisburg ein Natur- und Artenschutzprojekt zum Erhalt der Ringelnatter im Ruhrgebiet.Oberstes Ziel ist es, den Bestand der Schlangen im Freiland zu stärken durch Bestandserfassungen, Unterschutzstellung geeigneter Habitate, künstlicher Aufzucht der Schlangen im Zoo zur Steigerung der Reproduktionsrate mit anschließender Auswilderung sowie Aufklärungsarbeit gegenüber der Bevölkerung. Ein wichtiger Mosaikstein des Projektes ist es, die Bevölkerung mit einzubinden. Ein Faltblatt bietet Informationen zum Projekt, ebenso wie verschiedene Artenschutzunterrichteinheiten sowohl des Zoos als der BSWR, um den Menschen die Ringelnattern näher bringen, und um die Menschen für die Schlangen und deren Schutzbedürfnisse zu sensibilisieren. Unter der Domäne www.ringelnatter.bswr.de wurde eine Fundmeldestelle aufgeschaltet, auf der jede Beobachtung einer Ringelnatter dokumentiert werden kann als Grundlage für eine zu aktualisierende Verbreitungskarte der Schlange. Für die Zucht der Ringelnatter wurde im Zoo Duisburg eine Aufzuchtstation errichtet. Im Frühjahr wird eine festgelegte Anzahl trächtiger Weibchen im Freiland aufgespürt und in die Zuchtstation überführt. Nach erfolgter Eiablage werden die Tiere am Fundort wieder ausgesetzt. Die Gelege werden in Inkubatoren des Zoos ausgebrütet. Nach dem Schlupf verbleiben die Jungschlangen ca. zwei Jahre in der Aufzuchtstation, so dass sie bei der darauf folgenden Auswilderung als ausgewachsene Tiere gute Überlebenschancen haben. Mit diesen verschiedenen Maßnahmen können nicht nur wertvolle wissenschaftliche Daten der Schlangen gewonnen werden, sondern es kann zudem der Wildbestand deutlich aufgestockt werden, um hiermit ein Überleben der Ringelnatter auch im vom Menschen dicht besiedelten Ruhrgebiet zu garantieren. 2018 wurden erstmals 25 Ringelnattern aus dem Projekt in der Rheinaue Walsum wiederangesiedelt, wo die Art früher natürlicherweise vorkam, aber lokal ausgestorben war. |
Literatur und Internetquellen
- NATURSCHUTZ RUHR (11.06.2018)
- SCHLÜPMANN, M. (2018)
- TEXT ACHIM WINKLER (28.11.2916)
Zurück zu Übersicht Schlangen
Weiter zu Würfelnatter (Natrix tessellata)
BERRY, F. J. & IVERSON, J. B. (2011)
Kinosternon scorpioides (Linnaeus 1766) – Scorpion Mud Turtle.
In: Rhodin, A.G.J., Pritchard, P.C.H., van Dijk, P.P., Saumure, R.A., Buhlmann, K.A., Iverson, J.B., and Mittermeier, R.A. (Eds.). Conservation Biology of Freshwater Turtles and Tortoises: A Compilation Project of the IUCN/SSC Tortoise and Freshwater Turtle Specialist Group. Chelonian Research Monographs No. 5, pp. 063.1–063.15, doi:10.3854/crm.5.063.scorpioides.v1.2011, http://www.iucn-tftsg.org/cbftt/.
Summary:
Kinosternon scorpioides, the Scorpion Mud Turtle (Family Kinosternidae), is a medium to large-sized mud turtle, with adult males in some populations regularly exceeding 200 mm in carapace length. The species occurs from the Mexican state of Tamaulipas in Gulf of Mexico drainages, southward throughout the Isthmus of Tehuantepec and the Yucatan Peninsula in Mexico, and throughout most of Central and South America in both Atlantic and Pacific drainages at least to the upper Río Paraná in northern Argentina. Four subspecies are currently recognized, which vary in morphology: K. s. scorpioides, K. s. abaxillare, K. s. albogulare, and K. s. cruentatum. Maximum size in various populations ranges from 150 to over 200 mm carapace length. Mature females lay up to five clutches of 1–8 eggs during an extended annual reproductive season. The species is exploited in parts of its range for tourist trinkets, pet trade, medicine, and food, but the greatest threats to its survival are from habitat degradation and alteration. Conservation measures should include expanded studies of the status of the species throughout its range, as well as detailed studies of its life history, habitat utilization, diseases, and the effects of habitat modification on individuals and populations across its range.
SWINGLAND, I. R. & KLEMENS, M. W., eds. (1989)
The Conservation Biology of Tortoises.
Occasional Papers of the IUCN Species Survival Commission (SSC) No. 5. 204 Seiten.
Published by IUCN, Gland, Switzerland. ISBN 2-88032-986-8.
Aus der Einleitung:
This contribution to the Occasional Papers of the IUCN Species Survival Commission (SSC) on the status and distribution of the Testudinidae, or terrestrial tortoises, is the result of five years of work by members of the IUCN/SSC Tortoise Specialist Group (which has since become the Tortoise and Freshwater Turtle Specialist Group) and is published on the occasion of the First World Congress of Herpetology at the University of Kent, September 1989. This work was stimulated by our lack of knowledge regarding the forty species of tortoises which became apparent at our inaugural meeting at Oxford in October 1981 and our inability to answer many of the basic questions relating to their conservation. It was executed under the title "Operation Tortoise."
We have provided the latest information on each species, including the Latin name, common names, description, taxonomy, geographic variation, status and distribution, habitat and ecology (particularly behaviour, reproduction, and feeding), threats to survival, conservation reserves and recommendations, and current research. We have also provided the most complete bibliography on the Testudinidae ever published.
In drawing up this report we have been concerned that the information is as up-to-date as possible, but we expect, indeed hope, that it will be redundant in a few years as more and more people work on these fascinating animals. We have also been conscious of the needs of the local people and their interests, a vital part of any successful conservation programme as so clearly demonstrated by the Group's successful Project Angonoka/Kapidolo in Madagascar, and the SOPTOM project in southern France. The SSC Tortoise and Freshwater Turtle Group Action Plan, also published at the Kent Congress, goes even further in an attempt to integrate scientific and practical conservation.
STANFORD, C. B., WANCHAI, P., SCHAFFER, C., SCHAFFER, R. & THIRAKHUPT, K. (2015)
Manouria emys (Schlegel and Müller 1840) – Asian Giant Tortoise, Giant Asian Forest Tortoise.
In: Rhodin, A.G.J., Pritchard, P.C.H., van Dijk, P.P., Saumure, R.A., Buhlmann, K.A., Iverson, J.B., and Mittermeier, R.A. (Eds.). Conservation Biology of Freshwater Turtles and Tortoises: A Compilation Project of the IUCN/SSC Tortoise and Freshwater Turtle Specialist Group. Chelonian Research Monographs (ISSN 1088-7105) No. 5, doi:10.3854/crm.5.086.emys.v1.2015, http://www.iucn-tftsg.org/cbftt/.
Summary:
The Giant Asian Forest Tortoise, Manouria emys (Family Testudinidae), is the largest tortoise species in mainland Asia, with a straight carapace length (CL) of up to at least 600 mm, and mass up to 37 kg. Two subspecies, M. e. emys and M. e. phayrei, are distinguished by geographic distribution, coloration, plastral scute pattern, and maximum size. Manouria is considered to be among the most primitive of living tortoise genera. The species occurs in hilly wet forest; its diet includes green vegetation, mushrooms, bamboo shoots, and fallen fruits. Unlike most tortoises, which tend to prefer relatively arid habitats, M. emys prefers a mesic habitat and is often found in and around cool flowing streams, sitting for days in water or mud, or foraging in such habitats. Although the species is active all year round, some individuals exhibit an inactive period of up to two months in the cool dry season. The species exhibits unusual nesting activity; females build mound nests of forest floor debris, deposit large annual clutches of up to 60 eggs, and guard the nest for the early portion of incubation. Despite their size, the behavioral ecology of M. emys has been little studied. The species has apparently been extirpated in the westernmost portion of its range and is highly threatened everywhere else. Healthy populations are known to occur in a few protected areas in Thailand and Indonesia, but most remaining habitat is being rapidly degraded and destroyed, and the species continues to be collected for food and smuggled into the pet trade.
KIESTER, A. R. & WILLEY, L. L. (2015)
Terrapene carolina (Linnaeus 1758) – Eastern Box Turtle, Common Box Turtle.
In: Rhodin, A.G.J., Pritchard, P.C.H., van Dijk, P.P., Saumure, R.A., Buhlmann, K.A., Iverson, J.B., and Mittermeier, R.A. (Eds.). Conservation Biology of Freshwater Turtles and Tortoises: A Compilation Project of the IUCN/SSC Tortoise and Freshwater Turtle Specialist Group. Chelonian Research Monographs 5(8):085.1–25, doi:10.3854/crm.5.085.carolina.v1.2015, http://www.iucn-tftsg.org/cbftt/.
Summary:
The Eastern Box Turtle, Terrapene carolina (Family Emydidae), as currently understood, contains six living subspecies of small turtles (carapace lengths to ca. 115–235 mm) able to close their hinged plastrons into a tightly closed box. Although the nominate subspecies is among the most widely distributed and well-known of the world’s turtles, the two Mexican subspecies are poorly known. This primarily terrestrial, though occasionally semi-terrestrial, species ranges throughout the eastern and southern United States and disjunctly in Mexico. It was generally recognized as common in the USA throughout the 20th century, but is now threatened by continuing habitat conversion, road mortality, and collection for the pet trade, and notable population declines have been documented throughout its range. In the United States, this turtle is a paradigm example of the conservation threats that beset and impact a historically common North American species. In Mexico, the greatest need for the subspecies that occur there is to further assess their distribution, habitat requirements, economic status, and conservation threats.
17.08.2016
SELMAN, W. & JONES, R. J. (2011)
Graptemys flavimaculata Cagle 1954 – Yellow-Blotched Sawback, Yellow-Blotched Map Turtle.
In: Rhodin, A.G.J., Pritchard, P.C.H., van Dijk, P.P., Saumure, R.A., Buhlmann, K.A., Iverson, J.B., and Mittermeier, R.A. (Eds.). Conservation Biology of Freshwater Turtles and Tortoises: A Compilation Project of the IUCN/SSC Tortoise and Freshwater Turtle Specialist Group. Chelonian Research Monographs No. 5, pp. 052.1–052.11, doi:10.3854/crm.5.052.flavimaculata.v1.2011, http://www.iucn-tftsg.org/cbftt/.
Summary:
The Yellow-blotched Sawback, Graptemys flavimaculata (Family Emydidae), is a small to medium-sized riverine species endemic to the Pascagoula River drainage of southeast Mississippi, USA. Sexual dimorphism is pronounced, with adult females attaining more than twice the length and ten times the mass of adult males. Although the species is locally abundant, populations are threatened by habitat destruction, collection for the pet trade, invasive species, water quality degradataion, and other human impacts. Previously listed as Endangered on the IUCN Red List, the species has recently been downlisted to Vulnerable due to improved population estimates, newly discovered localities, and improved water qualities leading to some recovered populations. It remains Threatened because of its small range, large number of potential threats, and moderately severe declines in the largest population.