Anderson-Querzahnmolch
Ordnung: Schwanzlurche (Caudata)
Überfamilie: Salamanderverwandte (Salamandroidea)
Familie: Querzahnmolche (Ambystomatidae)
Anderson-Querzahnmolch
Ambystoma andersoni • The Anderson's Salamander • La salamandre d'Anderson
- Körperbau und Körperfunktionen
- Verbreitung
- Lebensraum und Lebensweise
- Gefährdung und Schutz
- Bedeutung für den Menschen
- Haltung
- Taxonomie und Nomenklatur
- Literatur und Internetquellen
|
Weitere Bilder auf BioLib |
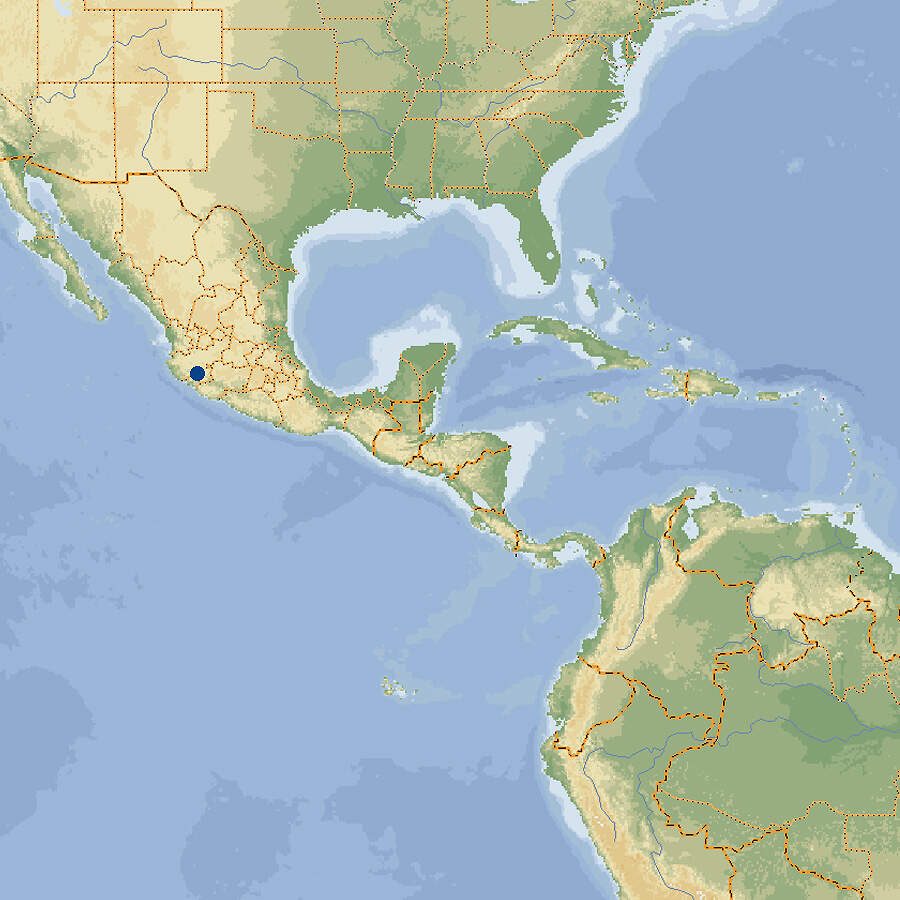
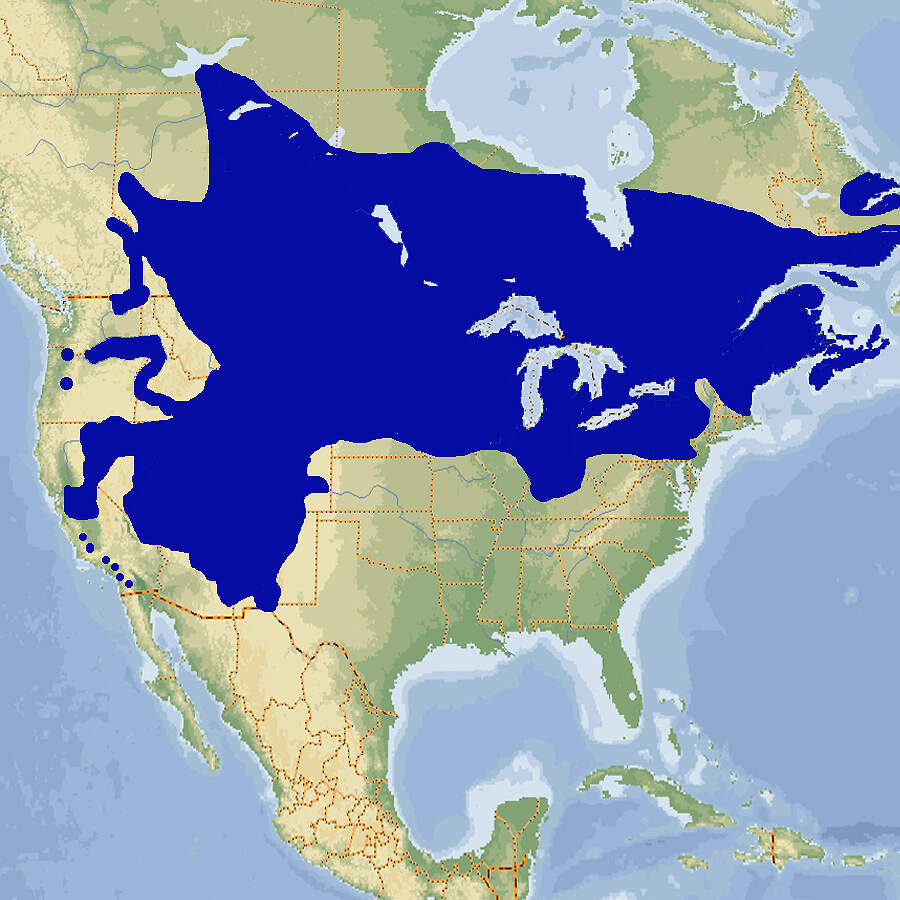
Der Anderson-Querzahnmolch ist eine in ihrer Heimat vom Aussterben bedrohte Art, für die wegen ihres beschränkten Lebensraums der Aufbau von ex situ-Reservepopulationen wichtig ist und für die sich deshalb die Organisation CITIZEN CONSERVATION engagiert. Körperbau und KörperfunktionenAnderson-Querzahnmolche durchlaufen keine Metamorphose zum Erwachsenenstadium, sondern werden als Larven geschlechtsreif. Voll ausgewachsene Larven haben eine Kopf-Rumpflänge von etwa 10-15 cm und eine Gesamtlänge bis 28 cm. Der Kopf ist groß, mit kleinen, lidlosen Augen und beidseits drei federartigen äußerlichen Kiemenästen mit leuchtend roten Fäden. Der Körper ist relativ schlank mit einer flossenartigen Längsfalte auf dem Rücken, die höher ist, als beim Axolotl. Der Schwanz ist seitlich zusammengepresst und hat oben wie unten einen Flossensaum. Die Extremitäten haben vorne 4, hinten 5 Zehen. Die Färbung ist oberseits ocker-braun mit unregelmäßigen dunkeln Flecken, unterseits hellbeige bis weiß [2]. VerbreitungNordamerika: Mexiko, nur im 25 ha großen Zacapú-See und dessen Zu- und Abflüssen im Teilstaat Michoacán [1; 2; 3]. Lebensraum und Lebensweise
Wie der Axolotl erreicht der Anderson-Querzahnmolch seine Geschlechtsreife bereits im Larvenstadium, macht also keine Metamorphose zum Erwachsenenstadium durch. Dieses, Neotenie genannte Phänomen ist durch eine Unterfunktion der Schilddrüse bedingt. Er hat deshalb eine rein aquatische Lebensweise. Seine Nahrung besteht hauptsächlich aus Mollusken und Kleinkrebschen. Die dunkel gelbbraunen Eier haben einen Durchmesser von 2.2–2.3 mm. Die Schlüpflinge haben eine Gesamtlänge von 12–13 mm. Sie werden in etwa einem Jahr erreicht, bei einer Kopf-Rumpflänge von ca. 9 cm geschlechtsreif [2; 3]]. Gefährdung und SchutzDer Anderson-Querzahnmolch ist im Freiland hochgradig bedroht, weil er nur an einem Ort ein begrenztes Areal hat und die Bestände wegen Gewässerverschmutzung, nicht nachhaltigem Fang und wohl auch wegen eingesetzter Raubfische laufend abnehmen. Nach einer Beurteilung aus dem Jahr 2004, letztmals überprüft 2014 , wird er von der IUCN als vom Aussterben bedroht (Rote Liste: CRITICALLY ENDANGERED) bedroht taxiert [3]. Der internationale Handel ist unter CITES nichtgeregelt. Bedeutung für den MenschenDie Tiere werden zu Speisezwecken und wegen vermuteter medizinischer Wirkungen gesammelt [2; 3]. HaltungHaltung in europäischen Zoos: Der Anderson-Querzahnmolch wird erst seit wenigen Jahren in europäischen Zoos gehalten, gegenwärtig (2023) in 7 Institutionen, wovon 5 in Deutschland. Für Details siehe Zootierliste. Es handelt sich um eine der Arten, um die sich die Organisation CITIZEN CONSERVATION kümmert. Diese strebt einen Bestand von 40 öffentlichen oder privaten Haltungen mit insgesamt 225 Tieren an. Sie empfiehlt für die Haltung eines Paars oder einer Gruppe ein Becken ab 200 Liter mit Filter, mit einer Wassertemperatur von 16-20°C, einem pH-Wert von 6.8–8.2 und einer Härte von 4–5°dH sowie Sand oder Kies unter 3 mm Körnung als Bodengrund. Versteckplätze und Wasserpflanzen [2]. Mindestanforderungen an Gehege: In Deutschland gibt es keine konkreten Mindestanforderungen. In Österreich sind diese in Anlage 4 der 2. Tierhaltungsverordnung, in der Schweiz in Anhang 2, Tabelle 6 der Tierschutzverordnung festgelegt. Taxonomie und NomenklaturDie Gattung Ambystoma war bereits 1838 von dem Schweizer Naturforscher, Arzt und Diplomaten Johann Jakob von TSCHUDI aufgestellt worden- Die Art Ambystoma andersoni wurde erst 1984 vom US-amerikanischen Herpetologen-Team Salome LITWIN KREBS und Ronald A. BRANDON unter ihrem heute noch gültigen Namen erstmals wissenschaftlich beschrieben [1]. |
Literatur und Internetquellen
- AMPHIBIAN SPECIES OF THE WORLD
- CITIZEN CONSERVATION
- IUCN SSC Amphibian Specialist Group. (2015). Ambystoma andersoni (errata version published in 2020). The IUCN Red List of Threatened Species 2015: e.T59051A176772780. https://dx.doi.org/10.2305/IUCN.UK.2015-4.RLTS.T59051A176772780.en. Accessed on 28 June 2023.
- ZOO OSNABRÜCK - PRESSEMITTEILUNG vom 01.02.2023
Zurück zu Übersicht Schwanzlurche
Kolumbianische Riesenkröte
Ordnung: Froschlurche (Anura)
Unterordnung: Moderne Froschlurche (Neobatrachia)
Familie: Kröten und Stummelfüße (Bufonidae)

Kolumbianische Riesenkröte
(Bufo =) Rhaebo blombergi • The Blomberg's Toad • Le craupaud de Blomberg
- Körperbau und Körperfunktionen
- Verbreitung
- Lebensraum und Lebensweise
- Gefährdung und Schutz
- Bedeutung für den Menschen
- Haltung
- Taxonomie und Nomenklatur
- Literatur und Internetquellen
|
Weitere Bilder auf BioLib |
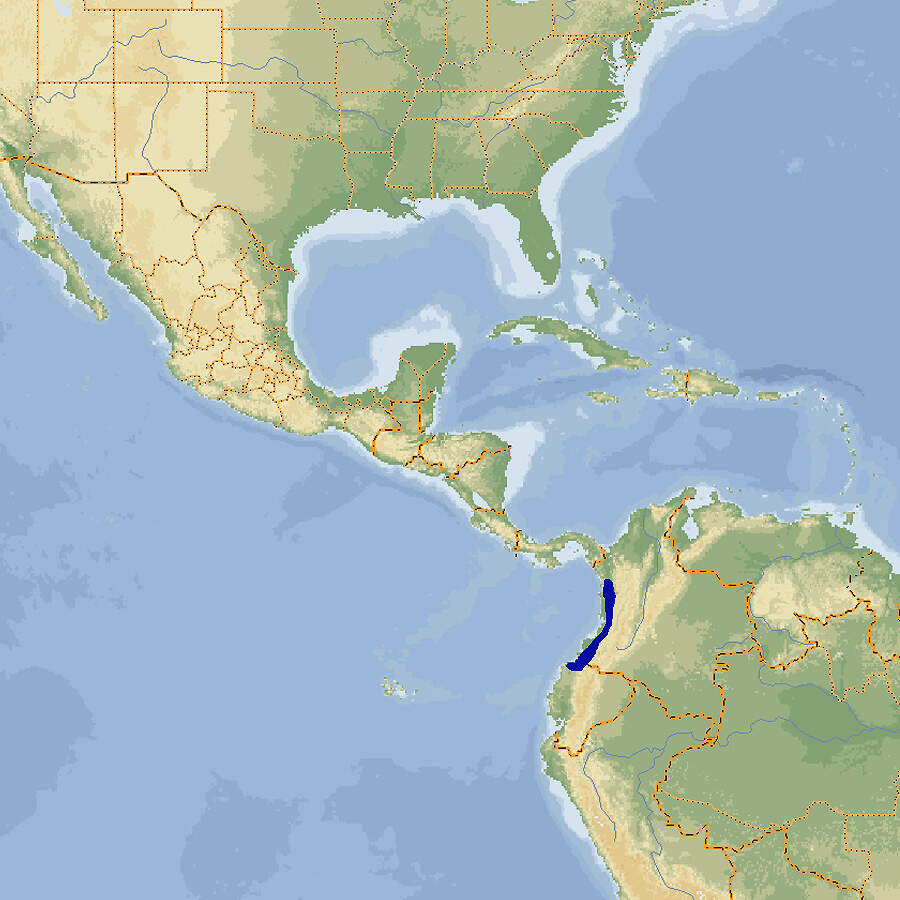
Die erst 1950 entdeckte Kolumbianische Riesenkröte ist die größte Kröte überhaupt. Sie war deshalb bei Terrarianern sehr begehrt, entsprechend häufig im Handel und auch in Zoos anzutreffen. Mittlerweile ist die als potenziell gefährdet geltende Art aus europäischen Zoos vollständig verschwunden. Körperbau und KörperfunktionenDie Kolumbianische Riesenkröte ist mit einer Länge von 15-17 cm bei den Männchen und 20-25 cm bei den Weibchen der größte Vertreter der Bufoniden. Sie hat kurze Beine, Zehen ohne erweiterte Scheiben, einen dunkelbraune Iris und große, ovale Ohrspeicheldrüsen. Es fehlen entwickelte Schädelkämme. Die Haut an Rücken und Bauch ist größtenteils glatt. Rücken und Oberkopf sind hellbraun gefärbt, Kopf- und Körperseiten sowie die Beine dunkelbraun, der Bauch wiederum heller [2; 5]. VerbreitungSüdamerika: Von Nord-Ekuador bis West-Kolumbien auf der Pazifikseite der Cordillera Occidental [3; 5]. Lebensraum und LebensweiseDie Kolumbianische Riesenkröte bewohnt primäre Tropenwälder oder Sekundärwälder mit gutem Unterwuchs und wenig menschlichem Eingriff. Sie ist tag- und nachtaktiv. Jungtiere halten sich an den Ufern von Fließgewässern auf. Adulte kommen zur Fortpflanzung zu temporären oder permanenten Tümpeln oder Weihern in Flussnähe, ansonsten leben sie auch tief im Inneren der Wälder. Ein Weibchen produziert pro Fortpflanzungsperiode bis 80'000 (durchschnittlich 34'500) 1-2 mm große Eier, die in langen Laichschnüren abgelegt werden [2; 3; 5; 6; 7; 8]. Gefährdung und SchutzDie Kolumbianische Riesenkröte hat eine recht kleine Verbreitung, die etwa der Fläche Hessens oder Medcklenburg-Vorpommerns entspricht, und die Qualität ihres Lebensraums nimmt ab. Sie ist gilt daher nach einer revisionsbedürftigen Beurteilung aus dem Jahr 2004 als potenziell gefährdet (Rote Liste: NEAR THREATENED) [3]. Der internationale Handel ist durch CITES nicht geregelt. Bedeutung für den MenschenDie Art befindet sich für die Zwecke der Liebhaberei und der pharmazeutischen Forschung im internationalen Tierhandel [3; 4]. HaltungHaltung in europäischen Zoos: Die Art war in den 1960/70er Jahren relativ häufig in Zoos anzutreffen. 1972 gelang in Krefeld die vermutliche Welterstzucht in einem Zoo [7; 8]. Nach dem Jahr 2000 gab es nur noch vereinzelte Haltungen, und mittlerweile gibt es in europäischen Zoos wahrscheinlich keine mehr. Für Details siehe Zootierliste. Mindestanforderungen an Gehege: In Deutschland gibt es keine konkreten Mindestanforderungen. In Österreich sind diese in Anlage 4 der 2. Tierhaltungsverordnung, in der Schweiz in Anhang 2, Tabelle 6 der Tierschutzverordnung festgelegt. Taxonomie und NomenklaturDie Kolumbianische Riesenkröte wurde erst 1950 von dem schwedischen Forschungsreisenden Rolf BLOMBERG entdeckt und 1951 von den amerikanischen Zoologen George Sprague MYERS und John William FUNKHOUSER wissenschaftlich beschrieben und zu Ehren ihres Entdecker Bufo blombergi benannt. Im Zuge der Aufspaltung der Gattung Bufo kam sie 2006 in die von Edward Drinker COPE 1862 aufgestellte Gattung Rhaebo, die in der Folge zeitweilig als Untergattung aufgefasst wurde [1; 2; 5]. |
Literatur und Internetquellen
- AMPHIBIAN SPECIES OF THE WORLD
- AMPHIBIAWEB
- BOLÍVAR, W., COLOMA, L. A., RON, S. & CISNEROS-HEREDIA, D. (2004). Rhaebo blombergi. The IUCN Red List of Threatened Species 2004: e.T54590A11157227. https://dx.doi.org/10.2305/IUCN.UK.2004.RLTS.T54590A11157227.en. Accessed on 21 November 2022.
- GRZIMEK, B. (Hrsg. 1970)
- JAMBATU
- HERRMANN, H. J. (2005)
- SCHMIDT, A. A. (1976)
- VOGT, P . (1974)
Zurück zu Übersicht Stummelfüße und Kröten
Weiter zu Erdkröte (Bufo bufo)
ERNST, R., LAUTENSCHLÄGER, T., FUTURO BRANQUIMA, M. & HÖLTING, M. (2020)
At the edge of extinction: a first herpetological assessment of the proposed Serra do Pingano Rainforest National Park in Uíge Province, northern Angola.
Zoosystematics and Evolution 96(1): 237-262.
Volltext: https://doi.org/10.3897/zse.96.51997
Abstract:
We systematically assess the herpetofaunal diversity of the Serra do Pingano Forest Ecosystem (SPFE) and additional localities throughout the northern Angolan province of Uíge during four independent Rapid Assessment (RA) field campaigns held between 2013 and 2019. These assessments represent the first systematic surveys of amphibians and reptiles from the province, and thus we provide the first province-wide species list. We collected data on the status and current threats to amphibians and reptiles in the proposed Serra do Pingano Rainforest National Park and were able to document 33 species of reptiles from Uíge province. Of the 33 species recorded from the province, 10 species are exclusively found in the SPFE. Amphibian surveys yielded 47 amphibian species from the province. These include 14 new country records and additional records that may represent undescribed species. This raises the amphibian count for Angola to at least 133 species, which includes 18 species exclusively found within the SPFE. Species-richness estimators indicate that more species should be detected if survey efforts are intensified. The species composition in the SPFE is unique and consists of a high proportion of forest specialists with restricted ranges and species found nowhere else in the country. This emphasizes today’s paramount importance of the SPFE, which is threatened by increasing agricultural encroachment and uncontrolled timber extraction and charcoal production. These principal factors need to be controlled and/or abandoned in already impacted areas. Conservation strategies should particularly consider the strict protection of remaining intact forests and both lentic and lotic aquatic systems. They are not only crucial for safeguarding a significant number of species that depend on these habitats for reproduction; they also provide key ecosystem services to the local population. Angola, and Uíge province in particular, is at a crossroads concerning decisions and trade-offs among utilization, conservation, and preservation of its forests and, thus, substantial parts of the country’s biodiversity. The establishment of a National Protected Area in the Serra do Pingano Ecosystem is therefore a necessary and urgently needed first step towards protecting Angola’s national biodiversity heritage.
ernst-biblio
Zipfelkrötenfrosch
 |
Neue Tierart
|
Ordnung: Froschlurche (Anura)
Unterordnung: Mittelalte Froschlurche (Mesobatrachia)
Überfamilie: Krötenfrösche (Pelobatoidea)
Familie: Asiatische Krötenfrösche (Megophryidae)
Unterfamilie: Megophryinae

Zipfelkrötenfrosch
Megophrys nasuta = Pelobatrachus nasutus • The Long-nosed horned frog •
La grenouille cornue asiatique
- Körperbau und Körperfunktionen
- Verbreitung
- Lebensraum und Lebensweise
- Gefährdung und Schutz
- Bedeutung für den Menschen
- Haltung
- Taxonomie und Nomenklatur
- Literatur und Internetquellen
|
Weitere Bilder auf BioLib
|
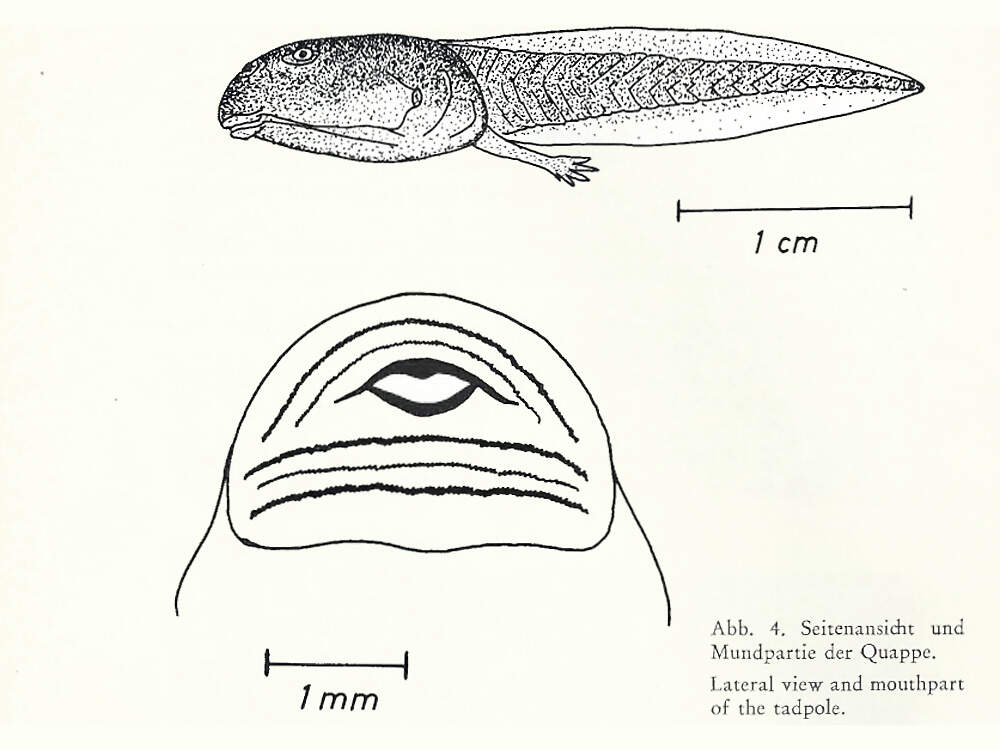
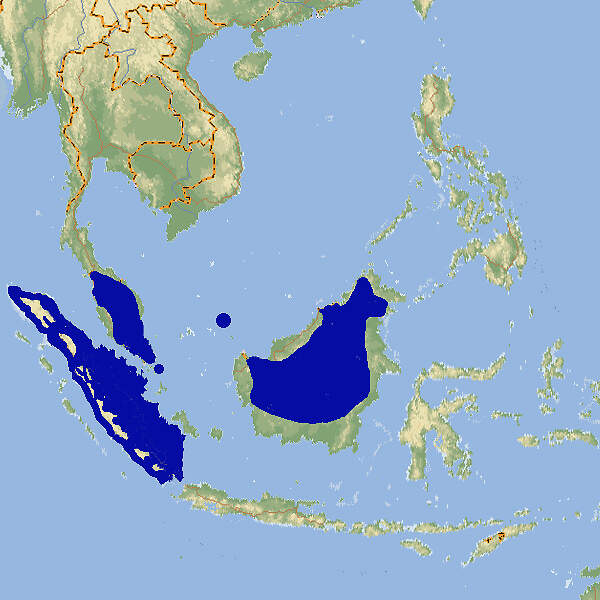
Der Zipfelkrötenfrosch ist eine nicht als gefährdet angesehene Art aus Südostasien. Wegen seines spektakulären Aussehens eignet er sich im Prinzip gut als Botschafter für seinen gefährdeten Lebensraum, die Regenwälder des malaiisch-indonesischen Tieflands. Allerdings ist sind die Tiere nachtaktiv und verstecken sich tagsüber häufig. Due Art wird deshalb regelmäßig in europäischen Zoos gezeigt, abr nicht in sehr vielen Haltungen. Körperbau und KörperfunktionenDer Zipfelkrötenfrosch, nicht zu verwechseln mit der Zipfelkröte (Sclerophrys superciliaris), verdankt seinen Namen den auffälligen, zipfelförmigen Auswüchsen über den Augen. Auch die Nase trägt einen spitzen Fortsatz. Weibchen werden bis ca. 12.5-16 cm lang. Männchen bleiben deutlich kleiner, selten sind sie mehr als halb so groß wie die Weibchen, maximal erreichen sie 10.5 cm. Von oben betrachtet ähnelt der Zipfelkrötenfrosch mit seiner Färbung, Gesamtform und sogar wie Blattadern aussehenden epidermalen Wucherungen einem Blatt. Dadurch wird er auf dem Waldboden nahezu unsichtbar. Er hat eine stark drüsige Haut, hauptsächlich in den Bereichen von Achseln, Brust- und Oberschenkeln [3; 7]. VerbreitungSüdostasien: Brunei, Indonesien (Sumatra, Kalimantan), Malaysia (Halbinsel, Sabah, Sarawak), Singapur, Thailand (marginal) [4]. Lebensraum und LebensweiseDer Zipfelkrötenfrosch besiedelt intakte Tiefland- und submontane Regenwälder bis in Höhenlagen von 1'300 m, meist in der Nähe von Waldbächen. Mit Störungen seines Lebensraums kommt er nur schlecht zurecht. Ausgewachsene Tiere leben an Land, die Kaulquappen in klaren Waldbächen. Die Tiere sind nachtaktiv und schlechte Springer, sondern ziehen es vor, zu gehen. Das Beutespektrum besteht hauptsächlich aus nestjungen Nagetieren, Echsen, Fröschen, Krabben, Skorpionen und Spinnen [3; 4; 7]. Die Eiablage erfolgt nach Einsetzen der Regenzeit im Wasser. Die Gelege umfassen rund 50-300 Eier. Die Kaulquappen schlüpfen etwa eine Woche nach Eiablage. Die Dauer bis zum Abschluss der Metamorphose ist temperaturabhängig und beträgt 2.5-3.5 Monate. Die Zipfel über den Augen beginnen sich etwa 2-3 Wochen später zu entwickeln [6; 7]. Gefährdung und SchutzDie Art ist weit verbreitet und offenbar häufig. Sie wurde daher aufgrund einer Beurteilung aus dem Jahr 2014, überprüft 2020, als global nicht-gefährdet taxiert. In der Roten Liste Singapurs aus dem Jahr 2011 wird sie jedoch als stark gefährdet eingestuft [2; 4]. Der internationale Handel wird durch CITESnicht geregelt. Bedeutung für den MenschenDer Zipfelkrötenfrosch wird in mäßigem Umfang für den Heimtierhandel gesammelt und exportiert. Abgesehen davon wird er lokal in Schmetterlingsfarmen ausgestellt [4]. HaltungWegen Kannibalismusgefahr wird empfohlen, unterschiedlich große Tiere einzeln zu halten oder sie nur zur Paarung zu vergesellschaften. Der Behälter sollte mindestens 80 cm lang sein und 15 cm tiefes Bodensubstrat aufweisen, damit sich die Tiere eingraben können [5]. Haltung in europäischen Zoos: Die Art wird regelmäßig, aber nicht sehr häufig in europäischen Zoos gezeigt. Nach Zootierliste liegt die Zahl der Haltungen gegenwärtig (2022) bei 16, davon 7 im deutschsprachigen Raum. Zoogestützte Forschung: Die Larvenentwicklung des Krötenzipfelfroschs wurde am Kölner Zoo erforscht [6; 7]. Mindestanforderungen an Gehege: In Deutschland gibt es keine konkreten Mindestanforderungen. In Österreich sind diese in Anlage 4 der 2. Tierhaltungsverordnung, in der Schweiz in Anhang 2, Tabelle 6 der Tierschutzverordnung festgelegt. Taxonomie und NomenklaturDer Zipfelkrötenfrosch wurde 1885 von dem aus Thüringen stammenden, am Naturhistorischen Museum Leiden tätigen Zoologen Hermann SCHLEGEL unter der Bezeichnung "Ceratophyne nasuta" erstmals wissenschaftlich beschrieben. 1873 stellte ihn der aus Esslingen stammende und am Natural History Museum in London tätige Zoologe Albert Carl Ludwig Gotthilf GÜNTHER in die Gattung Megophrys, die bis 2021 allgemein verwendet wurde. 2021 stellte ihn ein chinesisches Autorenteam, wie 1908 schon der englische Zoologe Frank Evers BEDDARD, in die Gattung Pelobatrachus, was aber von der IUCN nicht anerkannt wird [1; 2; 4]. |
Literatur und Internetquellen
- AMPHIBIAN SPECIES OF THE WORLD
- AMPHIBIAWEB
- ANIMAL DIVERSITY WEB
- IUCN SSC AMPHIBIAN SPECIALIST GROUP (2021). Megophrys nasuta. The IUCN Red List of Threatened Species 2021: e.T57582A114918773. https://dx.doi.org/10.2305/IUCN.UK.2021-3.RLTS.T57582A114918773.en . Accessed on 12 October 2022.
- TERRARISTIK FORUM
- VAN DER STRAETEN, K., KARBE, D., OLBORT, S. & T. ZIEGLER (2007): Erste Nachzucht des Zipfelkrötenfrosches, Megophrys nasuta, im Aquarium des Kölner Zoos. Terraria Nr. 6 2(4): 45-51.
- WILDENHUES, M., RAUHAUS, A., BACH, R., KARBE, D., VAN DER STRAETEN, K., HERTWIG, S. T. & T. ZIEGLER (2012). Husbandry, captive breeding, larval development and stages of the Malayan horned frog Megophrys nasuta (Schlegel, 1858) (Amphibia: Anura: Megophryidae). Amphibian and Reptile Conservation 6(1): 15-28.
Zurück zu Übersicht Stummelfüße und Kröten
Weiter zu Wechselkröte (Bufo = Bufotes viridis)
REINHARD, S., VOITEL, S. & KUPFER, A. (2015)
Haltung und Vermehrung des Kleinen Armmolchs Siren intermedia mit Berichten zum Fortpflanzungs- und Brutpflegeverhalten.
amphibia 14(1): 16-24
Volltext
reinhard-biblio
COSEWIC (2009)
COSEWIC assessment and update status report on the Northern Leopard Frog Lithobates pipiens, Rocky Mountain population, Western Boreal/Prairie populations and Eastern populations, in Canada.
Committee on the Status of Endangered Wildlife in Canada, Ottawa. vii + 69 pp. (www.sararegistry.gc.ca/status/status_e.cfm)
Species information:
The Northern Leopard Frog (Lithobates pipiens) is 60 to 110 millimetres in length, with females generally larger than males. It may be either green or brown on the dorsal surface, which is covered with large, rounded dark spots outlined with light halos. The underside is white. Two light-coloured dorsolateral ridges line its back, one on each side, from behind the eyes to the lower back.
Three designatable units (DUs) are recognized in order to accurately portray the status of the Northern Leopard Frog in Canada. These are based on evidence for genetic distinction between western and eastern populations and the isolation of populations west of the Rocky Mountains. The Rocky Mountain DU consists of populations in British Columbia. The Prairie/Western Boreal DU contains the populations in the Alberta, Saskatchewan, the Northwest Territories and Manitoba approximately west of the Canadian Shield. The Eastern DU consisting of all those populations of the Canadian Shield, Great Lakes/St. Lawrence, Appalachian/Atlantic Coast and Carolinian faunal provinces.
cosewic-biblio
Leopardfrosch
Ordnung: Froschlurche (Anura)
Unterordnung: Moderne Froschlurche (Neobatrachia)
Familie: Eigentliche Frösche (Ranidae)

Leopardfrosch
Rana (=Lithobates) pipiens • The Northern Leopard Frog • La grenouille léopard
- Körperbau und Körperfunktionen
- Verbreitung
- Lebensraum und Lebensweise
- Gefährdung und Schutz
- Bedeutung für den Menschen
- Haltung
- Taxonomie und Nomenklatur
- Literatur und Internetquellen
|
Weitere Bilder auf BioLib |
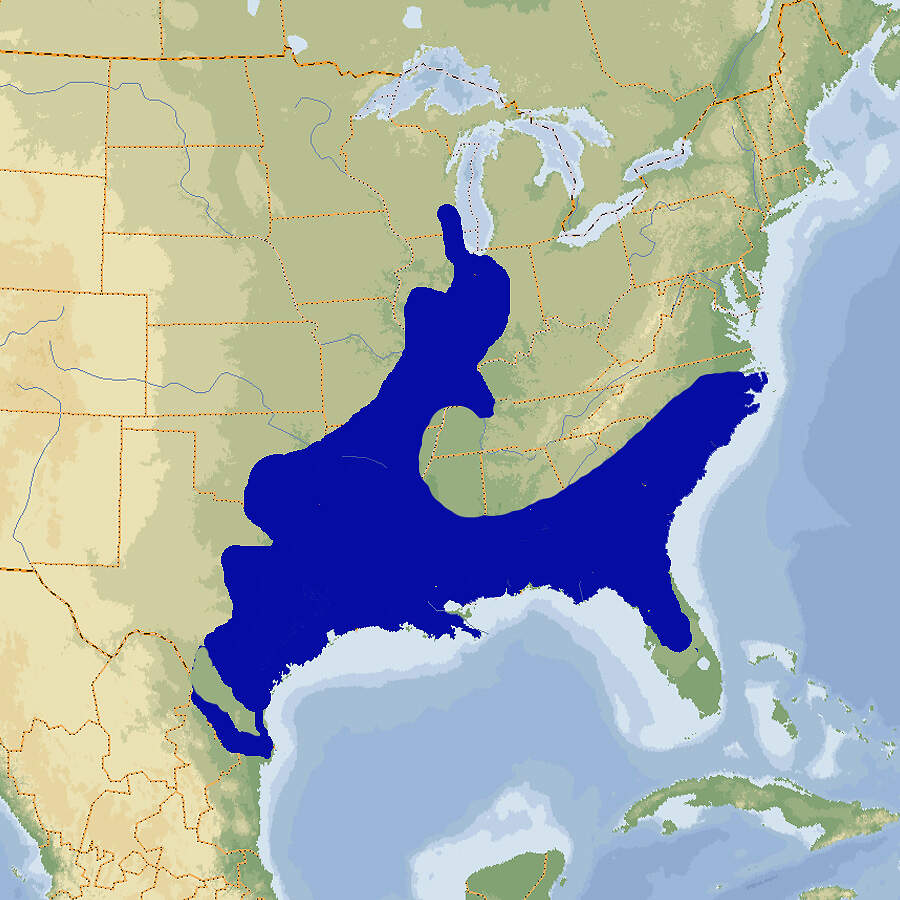
Der Leopardfrosch ist ein in Nordamerika weit verbreiteter und nicht-gefährdeter Frosch, der durch sein ausgeprägtes Fleckenmuster auf zumeist grünem Grund auffällt. In europäischen Zoos wird er, wie viele andere nordamerikanische Tierarten, nur ausnahmsweise gezeigt. Körperbau und KörperfunktionenDer Leopardfrosch ist ein schlanker Frosch mit kurzem Kopf und spitz abgerundetem Maul. Die Kopf-Rumpflänge variiert von 5 bis 11 cm. Die Pupillen sind waagrecht, und das das Trommelfell ist gut zu sehen. An den Rückenseiten verlaufen Drüsenfalten, dazwischen hat es 2-4 weitere Hautfalten. Die Schwimmhäute sind gut entwickelt. Die Grundfarbe der Oberseite ist in der Regel grün, es gibt aber auch eine braune Farbmorphe. Auf dem Rücken befinden sich große, dunkle Flecken mit hellem Rand, auf den Beinen entsprechende Querbänder. Der ungefleckte Bauch ist gelblich-weiß [2; 6]. VerbreitungNordamerika: Kanada, USA, mögliocherweise marginal in Mexiko. Bei einer aus Panama beschriebenen Population dürfte es sich um eine andere Art handeln [2; 4]. Lebensraum und LebensweiseLebensraumansprüche: Der Leopardfrosch besiedelt stehende und langsam fließende, mit Wasserpflanzen bestandene Gewässer sowie, während des Sommers, Feuchtwiesen und feuchte Felder. Meistens überwintert er unter Wasser. Erwachsene Frösche tolerieren Salzkonzentrationen bis 6 ppm, Larven bis unter 5 ppm [2; 3; 4; 5]. Biologie: Die Eiablage und Larvenentwicklung erfolgt meistens in flachen, gut besonnten stehenden Gewässern. Die ca. 1.6 mm großen Eier werden als Ballen von bis 6'500 Stück an Wasserpflanzen abgelegt. Der Schlupf erfolgt nach 3-6 Tagen, die Metamorphose nach 60-80 Tagen [2; 4; 5]. Gefährdung und SchutzDie Art wurde 2004, trotz negativer Bestandstendenz, als nicht-gefährdet (LEAST CONCERN) in die Rote Liste aufgenommen, weil sie eine weite Verbreitung und einen großen Bestand hat. In Kanada gelten die Rocky Mountains-Population (Britisch Kolumbien) als stark gefährdet und die westlichen Präriepopulationen als potenziell gefährdet [3; 4]. Der internationale Handel ist durch CITES nicht geregelt. Bedeutung für den MenschenWie Arten des Rana esculenta-Komplexes wird der Leopardfrosch zwecks Gewinnung von Froschschenkeln gefangen und wird er in der Forschung sowie der Lehre im Rahmen des Schul- bzw. Hochschulunterrichts verwendet [3; 5]. HaltungAls optimale Temperaturen werden 18-20ºC für das Wasser und 20-24ºC für die Luft angegeben. Eine kurze kühle Überwinterungsphase bei 5ºC wird empfohlen [5; 6]. Haltung in europäischen Zoos: Die Art war in europäischen Einrichtungen nie häufig und ist heute eine Rarität, die nur ganz ausnahmsweise in Zoos gezeigt wird. Für Details siehe Zootierliste. Mindestanforderungen an Gehege: In Deutschland gibt es keine konkreten Mindestanforderungen. In Österreich sind diese in Anlage 4 der 2. Tierhaltungsverordnung, in der Schweiz in Anhang 2, Tabelle 6 der Tierschutzverordnung festgelegt. Taxonomie und NomenklaturDer Leopardfrosch war bereits 1761 von dem schwedischen Zoologe Pehr Kalm und gestützt auf diesen 1766 von Carl von LINNÉ beschrieben und wissenschaftlich benannt worden. Diese Namen sind allerdings heute nicht mehr gültig. Verwendet wird vielmehr die vom thüringischen Naturforscher Johann Christian Daniel von SCHREBER 1782 eingeführte Bezeichnung Rana pipiens. 2006 wurde die Gattung Rana von dem amerikanischen Herpetologen Darrell FROST und Mitarbeitern aufgeteilt. Dabei wurden alle nordamerikanischen Arten der Gattung Lithobates zugeordnet, was von anderen Autoren später wieder infrage gestellt wurde. Gegenwärtig findet man in der Literatur beide Bezeichnungen [1; 2]. |
Literatur und Internetquellen
- AMPHIBIAN SPECIES OF THE WORLD
- AMPHIBIAWEB
- COSEWIC (2009)
- HAMMERSON, G. et al. (2004). Lithobates pipiens. The IUCN Red List of Threatened Species 2004: e.T58695A11814172. https://dx.doi.org/10.2305/IUCN.UK.2004.RLTS.T58695A11814172.en. Accessed on 06 July 2022.
- HERRMANN, H. J. (2005)
- NIETZKE, G. (1969/1972)
Zurück zu Übersicht Eigentliche Frösche und Ruderfrösche
Kleiner Armmolch
Ordnung: Schwanzlurche (Caudata)
Überfamilie: Armmolche (Sirenoidea)
Familie: Armmolche (Sirenidae)

Kleiner Armmolch
Siren intermedia • The Lesser Siren • La sirène mineure
- Körperbau und Körperfunktionen
- Verbreitung
- Lebensraum und Lebensweise
- Gefährdung und Schutz
- Bedeutung für den Menschen
- Haltung
- Taxonomie und Nomenklatur
- Literatur und Internetquellen
|
Weitere Bilder auf BioLib
|
Armmolche werden in Europa nur von wenigen Zoos gehalten, hauptsächlich aus zoopädagogischen Gründen, weil es sich um Dauerlarven handelt, die auch als Erwachsene noch äußerliche Kiemen haben. Körperbau und KörperfunktionenDer Kleine Armmolch wird 18-69 cm, im Mittel 43 cm lang und etwa 50 g schwer. Wie sein größerer Verwandter ist er eine Dauerlarve, d. h. macht keine Metamorphose durch (Neotenie), charakterisiert durch einen aalähnlichen Körper, äußere Kiemen mit je drei Ästen, neben denen er aber auch eine Lunge besitzt, kleinen Vorder- und fehlenden Hinterbeinen sowie einen seitlich abgeplatteten Schwanz, der der Fortbewegung dient. Männchen werden größer als Weibchen und haben eine ausgeprägtere Kiefermuskulatur. [2 3; 4; 7]. VerbreitungNordamerika: Östliche USA von Virginia bis Texas und im Einzugsgebiet des Mississippi nordwärts bis zum Michigansee, in Mexiko hauptsächlich im Einzugsgebiet des unteren Rio Grande [6]. Lebensraum und LebensweiseDer Kleine Armmolch besiedelt warme, ruhige, bisweilen trübe Gewässer mit reichlicher Vegetation, wie Sümpfe, Abzuggräben, Weiher oder Seen, in geringerem Ausmaß auch Flüsse und Bäche. Tagsüber versteckt er sich zwischen Wasserpflanzen oder im Schlamm. Wenn ein Gewässer austrocknet, gräbt er sich im Boden ein und kann dort mehrere Monate verweilen. Die Nahrung besteht hauptsächlich aus Kleingetier, Amphibieneiern und -larven, einschließlich solcher der eigenen Art, sowie erwachsenen Amphibien. Daneben werden pflanzliches Material und Schlamm aufgenommen. Die Tiere werden je nach Quelle mit 1 oder 2 Jahren geschlechtsreif. Die 150-360 (100-500) Eier werden von Januar bis März in Höhlen mit Pflanzenmaterial oder zwischen den Wurzeln von Wasserpflanzen abgelegt. Die Befruchtung erfolgt extern. Das Männchen betreibt Brutpflege. Die Larven schlüpfen nach 35 Tagen. Armmolche können unterschiedliche Laute von sich geben [2; 3; 4; 6; 7]. Gefährdung und SchutzDie Art hat eine weite Verbreitung und mutmaßlich einen großen Bestand. Sie ist nach einer Beurteilung aus dem Jahr 2008 nicht gefährdet (Rote Liste: LEAST CONCERN), wobei keine konkreten Informationen hinsichtlich des Bestandstrends vorliegen [6]. Der internationale Handel ist unter CITES nicht geregelt. Bedeutung für den MenschenAbgesehen davon, dass Kleine Armmolche gelegentlich im Tierhandel auftauchen, ist ihre unmittelbare Bedeutung für den Menschen gering [3] HaltungFür die Haltung eines Paars wird ein Aquarium mit einer Mindestlänge von 1 m, besser größer, mit einem Wasserstand bis zu 40 cm empfohlen. Es sollte bepflanzt sein, etwa mit Hornkraut und Javamoos, und es sollten Sichtbarrieren vorhanden sein, damit sich die Tiere aus dem Weg gehen können. Die Temperatur sollte im Sommer 25ºC nicht übersteigen und im Winter um bis zu 10-13ºC abgesenkt werden. Vorsicht: Die Tiere können beißen! [7]. Haltung in europäischen Zoos: Die Art wird laut Zootierliste (2022) in 5 Zoos gezeigt, von denen sich 4 im deutschsprachigen Raum befinden. Die durchschnittliche Haltungsdauer im Zoo-Aquarium Berlin lag bei 4 Jahren und 7 Monaten, das Maximum bei etwas über 9 Jahren [5]. Die mittlere Lebenserwartung wird mit 6 Jahren und 4 Monaten angegeben [3], das mögliche Höchstalter soll bei über 25 Jahren liegen [4] Mindestanforderungen an Gehege: In Deutschland gibt es keine konkreten Mindestanforderungen. In Österreich sind diese in Anlage 4 der 2. Tierhaltungsverordnung, in der Schweiz in Anhang 2, Tabelle 6 der Tierschutzverordnung festgelegt. Wie Armmolche gehalten werden (Beispiel):
Taxonomie und NomenklaturDie Art wurde 1826 von dem amerikanischen Naturforscher Daniel H. BARNES unter ihrem heute noch gültigen Namen erstmals wissenschaftlich beschrieben. Die intraspezifische Taxonomie ist umstritten, meistens werden drei Unterarten anerkannt [1; 2]. |
Literatur und Internetquellen
- AMPHIBIAN SPECIES OF THE WORLD
- AMPHIBIAWEB
- ANIMAL DIVERSITY WEB
- DUDLEY ZOO
- IBLER, B. (2012)
- PARRA-OLEA, G., WAKE, D. & HAMMERSONn, G.A. (2008). Siren intermedia. The IUCN Red List of Threatened Species 2008: e.T59491A11936674. https://dx.doi.org/10.2305/IUCN.UK.2008.RLTS.T59491A11936674.en. Accessed on 07 July 2022.
- REINHARD, S., VOITEL, S. & KUPFER, A. (2015)
Zurück zu Übersicht Schwanzlurche
Weiter zu Großer Armmolch (Siren lacertina)
LITVINCHUK, S. N., BORKIN, L. J. & ROSANOV, J. M. (2008)
Genome size variation in Rana arvalis and some related brown frog species, including taxonomic comments on the validity of the R. arvalis subspecies.
Zeitschrift für Feldherpetologie, Supplement 13: 95–112.
Volltext (PDF)
Zusammenfassung:
Der DNA-Gehalt des diploiden Zellkerns von Rana arvalis und acht nahe verwandter Braunfroscharten wurde mittels Durchflusszytometrie bestimmt. Auf Grund der Genomgrößen konnten wir drei Gruppen von Braunfröschen unterscheiden. Die erste Gruppe wies geringere Kern-DNA-Gehalte auf (10,04–11,76 pg) und bestand aus R. temporaria, R. dalmatina, R. asiatica, R. amurensis, R. dybowskii und R. pirica. Die zweite Gruppe mit intermediären Werten (12,52–13,76 pg) umfasste R. arvalis und R. macrocnemis, und die dritte Gruppe enthielt nur R. graeca (15,24–15,44 pg). Rana arvalis wies überlappende Genomgrößen nur zu R. macrocnemis auf. Bei den Unterarten von R. arvalis bestand der größte Unterschied zwischen R. a. arvalis und R. a. wolterstorffi (2,0 %); zwischen R. a. arvalis und R. a. issaitschikovi unterschieden sich die Genomgrößen um 1,7 %, und zwischen R. a. arvalis und R. a. altaica um 0,4 %. Die Taxonomie von R. arvalis wird diskutiert.
litvinchuk-biblio
TAPLEY, B., BRADFIELD, K. S., MICHAELS, C. & BUNGARD, M. (2015)
Amphibians and conservation breeding programmes: do all threatened amphibians belong on the ark?
Biodivers. Conserv. (2015). DOI 10.1007/s10531-015-0966-9
Abstract:
Amphibians are facing an extinction crisis, and conservation breeding programmes are a tool used to prevent imminent species extinctions. Compared to mammals and birds, amphibians are considered ideal candidates for these programmes due to their small body size and low space requirements, high fecundity, applicability of reproductive technologies, short generation time, lack of parental care, hard wired behaviour, low maintenance requirements, relative cost effectiveness of such programmes, the success of several amphibian conservation breeding programmes and because captive husbandry capacity exists. Superficially, these reasons appear sound and conservation breeding has improved the conservation status of several amphibian species, however it is impossible to make generalisations about the biology or geo-political context of an entire class. Many threatened amphibian species fail to meet criteria that are commonly cited as reasons why amphibians are suitable for conservation breeding programmes. There are also limitations associated with maintaining populations of amphibians in the zoo and private sectors, and these could potentially undermine the success of conservation breeding programmes and reintroductions. We recommend that species that have been assessed as high priorities for ex situ conservation action are subsequently individually reassessed to determine their suitability for inclusion in conservation breeding programmes. The limitations and risks of maintaining ex situ populations of amphibians need to be considered from the outset and, where possible, mitigated. This should improve programme success rates and ensure that the limited funds dedicated to ex situ amphibian conservation are allocated to projects which have the greatest chance of success.
Quote:
The moor frog (Rana arvalis), for example, exhibits a high degree of local adaptation to varying pH levels in breeding ponds across its large range (Rasanen et al. 2003a). The cost of mismatched adaptive traits and environmental pH is high (Andrén et al. 1989), therefore any conservation breeding initiative for this species would need to ensure that source and recipient habitats have similar pH values, or exploit the rapid evolutionary rate of this trait (Andrén et al. 1989; Rasanen et al. 2003a, b; Merila et al. 2004) to allow captive populations to track changes in their eventual release sites.
tapley-biblio